一种对Ba(OH)2·8H2O相变体系过冷问题的优化方法
2021-01-25胡苏楠
卢 露 王 琦 胡苏楠
(1.山东省建材工业协会,山东 济南 250022;2.济南大学材料科学与工程学院,山东 济南 250022;3.山东省商务发展研究院,山东 济南 250022)
0 引言
世界经济的高速增长导致了世界能源消耗的增加。化石燃料占世界能源市场的81%左右[1]。然而,化石能源正在耗尽,开发它们需要付出相当高的环境和经济代价。因此,能源的有效利用和可再生能源的利用率的提高越来越重要。太阳能作为一种可再生能源,已引起人们的极大关注。每年约5×1024J的能量由太阳提供,并到达整个地表[2]。这一能源量大约是全球每年实际能源消耗的1万倍。地球只捕获太阳产生的3.8×1020兆瓦总能量的一小部分(1.7×1014兆瓦)[2]。因此,我们需要找到一种更高效的方法来利用太阳能这一可再生资源。热能主要通过显热、潜热和化学反应等三种形式进行存储[3]。潜热不涉及吸收或释放过程中的温度变化,是用来克服物质在熔化过程中的分子间力[4]。显热储热是利用储热材料该物质自身的比热容这一性能, 通过温度的变化来进行热量的存储与释放。潜热储能(LHS)可以提供比显热储能更高的储能密度,使LHS成为一种高效的储能方式[5]。
潜热储能(LHTES)是利用相变材料(PCM)实现的,相变材料(PCMs)通过吸收和释放潜热的形式进行相变过程。这种可逆过程发生在几乎恒定的温度下[6]。PCMs的相变温度变化范围很广,适合于多种应用。相变材料可以通过固-液和液-固、固-气和液-气等相变过程中的潜热的吸收与释放来实现对能量的储存与释放[7,8,9]。然而,固液相变系统是目前唯一可用和有效的系统。八水合氢氧化钡,属于低温相变水合盐材料,其相变温度为 78℃,相变潜热约为300 J/g,是低相变温度(低于120℃)区单位体积相变潜热最高的结晶水合盐,具有极高的研究价值。Ba(OH)2·8H2O存在严重的过冷问题,过冷度高达20℃,由于较大的过冷度制约了其应用,所以本文以Ba(OH)2·8H2O为研究对象,探讨一下解决Ba(OH)2·8H2O强腐蚀性、较大的过冷度问题的方法。
1 材料与方法
1.1 材料与样品制备
按照一定质量比称取样品,将样品在烧杯中混合,橡胶塞塞紧烧杯,于85℃磁力搅拌加热器中边搅拌边加热,搅拌速度800RMP下搅拌,使其充分混合均匀,每5min观察一次混合物的形态,直至固相完全融化后,继续搅拌30min,冷却至结晶得到改性的Ba(OH)2·8H2O水合盐相变储能材料。其中各种原料的热物性见表1。

表1 原料的热力学性能
1.2 表征
利用德意志国布鲁克尔D8 ADVANCE XRD对EHS进行晶相分析。XRD仪器是由Cu-Kα发出x射线辐射,测试范围2θ范围为10°~80°,测试速率为1.2°/min。通过SEM (Carl Zeiss Jena,EVO LS15, 德国)观察EHS的微观结构。测试前EHS在空气湿润的密闭环境在养护防止失水。测试时在样品喷上金120s,进行电镜检测。
步冷曲线又叫冷却曲线,是指材料冷却时绘制的时间-温度的曲线。步冷曲线上的转折点对应的温度可视为材料的结晶温度,从冷却曲线可见,EHS液随着时间的推移,温度不断下降。当温度到达某一点时,温度不再继续下降,如图1所示出现一个平台,这个平台所对应的温度就是EHS的理论结晶温度。然而实际情况中,EHS要持续冷却到远低于该平台一下的某一温度才会结晶,这种现象称为过冷。理论结晶温度与实际结晶时的温度的差值,称为过冷度。

图1 经典步冷曲线示意图
2 实验与分析
2.1 改性Ba(OH)2·8H2O实验方案
通过预实验确定成核剂的大概添加范围应小于2%,否则Ba(OH)2·8H2O会与成核剂生成沉淀完全失去储热功能。成核剂Na2HPO4·12H2O的添加质量比例如表2所示。为了方便表述,将Ba(OH)2·8H2O中添加了成核剂Na2HPO4·12H2O的组记为BP组。
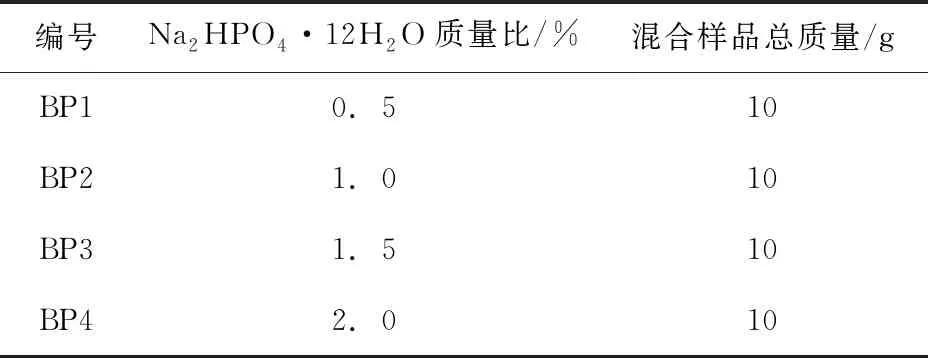
表2 BP组成核剂Na2HPO4·12H2O的添加比例表(一)
按表格中的质量比称取样品,将样品在烧杯中混合,橡胶塞塞紧烧杯,于85℃磁力搅拌加热器中边搅拌边加热,搅拌速度800RMP下搅拌,使其充分混合均匀,每5min观察一次混合物的形态,直至固相完全融化后,继续搅拌30min,冷却至结晶得到改性的Ba(OH)2·8H2O水合盐相变储能材料。
将制得的改性Ba(OH)2·8H2O水合盐相变材料,通过步冷曲线法,用4路温度巡检仪记录改性Ba(OH)2·8H2O降温过程中每一秒钟的温度,绘制步冷曲线,测得其结晶温度,从而得到过冷度,为相变温度与结晶温度的差值。
2.2 改性Ba(OH)2·8H2O的表征
图2是Na2HPO4·12H2O改性的Ba(OH)2·8H2O的固体扫描电镜图像,可以看出主要是棒状、粘连在一起的花瓣状的Ba(OH)2·8H2O晶体和极少部分纤维状的Na2HPO4·12H2O晶体,排列比较疏松,不致密。从SEM图片中可以看出由于作为成核剂的Na2HPO4·12H2O的添加量极少,并没有新的物质生成,制得的改性Ba(OH)2·8H2O仍然保持自身的优良性能,比如高潜热。
在结晶过程中,添加剂会干扰溶质分子的有序排列,影响晶体的成核或生长,从而引起晶体结构或形貌的改变。添加剂对晶体生长的影响主要体现在添加剂对晶体生长的影响上。当添加剂吸附在特定的晶体表面并与溶质分子相互作用时,会影响晶体表面的生长。

图2 Na2HPO4·12H2O改性的Ba(OH)2·8H2O的SEM图
由于Ba(OH)2·8H2O晶体和成核剂Na2HPO4·12H2O容易失水,熔融状态的Ba(OH)2·8H2O容易与空气中的CO2发生反应生成BaCO3。为了确定我们制得的样品为比较纯净的改性Ba(OH)2·8H2O,对试样进行了XRD检测,XRD图谱如图3所示。将样品的XRD图谱与Ba(OH)2·8H2O和Na2HPO4·12H2O的标准卡片进行比对,可见样品的衍射峰与Ba(OH)2·8H2O和Na2HPO4·12H2O物质的标准卡片基本一致。由此得出结论,本实验制得的试样基本为目标产物含有少量Na2HPO4·12H2O的改性Ba(OH)2·8H2O。
2.3 改性Ba(OH)2·8H2O的性能
根据实验方案,BP组制得的4组改性Ba(OH)2·8H2O水合盐相变材料,通过步冷曲线法,用4路温度巡检仪记录改性Ba(OH)2·8H2O降温过程中每一秒钟的温度,绘制步冷曲线如图4所示,测得其结晶温度,从而得到过冷度,为相变温度与结晶温度的差值,具体数值见表3。

图3 Na2HPO4·12H2O改性的Ba(OH)2·8H2O的XRD图
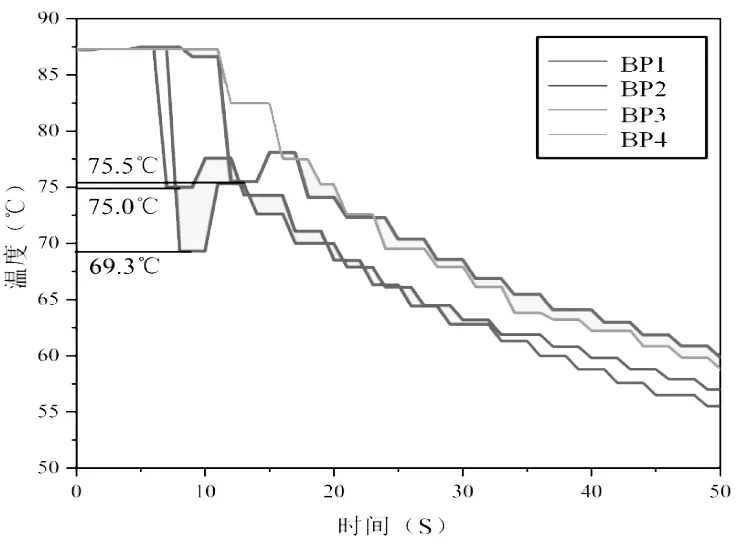
图4 BP组改性Ba(OH)2·8H2O相变储能材料步冷曲线(一)

表3 BP组改性Ba(OH)2·8H2O相变储能材料步冷曲线(一)
从图4与表3中可以看出,添加成核剂Na2HPO4·12H2O改性的Ba(OH)2·8H2O相变储能材料,Na2HPO4·12H2O在一定掺量条件下,随着成核剂添加量的增加,结晶温度越来越低,过冷度越来越大,Na2HPO4·12H2O的添加量并不是越多越好。在成核剂Na2HPO4·12H2O添加量为2%时,Na2HPO4·12H2O与Ba(OH)2·8H2O形成过多BaHPO4微溶物,出现沉淀,在冷却过程中当温度降到55℃时仍然未发生相变,失去了储热功能。Na2HPO4·12H2O掺加量为1.5%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为69.3℃,过冷度为8.7℃。Na2HPO4·12H2O掺加量为1.0%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为75℃,过冷度为3℃。Na2HPO4·12H2O添加量为0.5%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为75.5℃,过冷度为2.5℃。
因此我们进一步细化成核剂Na2HPO4·12H2O的添加梯度,探究最优的添加比例。实验设计方案如表4。

表4 BP组成核剂Na2HPO4·12H2O的添加比例表(二)
按照表4的成核剂添加比例进行实验,重复前面的制备方法与绘制步冷曲线的方法,绘制步冷曲线计算结晶温度与过冷度,如图5和表5所示。

图5 BP组改性Ba(OH)2·8H2O相变储能材料步冷曲线(二)

表5 BP组改性Ba(OH)2·8H2O相变储能材料步冷曲线(二)
根据表3和表5绘制出图6,为成核剂Na2HPO4·12H2O不同掺加比例改性的Ba(OH)2·8H2O相变储能材料的过冷度折线图。如图6所示,成核剂Na2HPO4·12H2O最优添加量为0.3%。成核剂Na2HPO4·12H2O的掺量并不是越少越好,掺量范围小于0.3%时,由于掺量不够,达不到最佳成核效果,改性Ba(OH)2·8H2O的过冷度反而呈增大的趋势。成核剂Na2HPO4·12H2O的掺量范围在0.3%至1.0%之间促进成核的效果最好,对Ba(OH)2·8H2O的过冷抑制效果最好,此范围内改性的Ba(OH)2·8H2O过冷度都在3℃以内,是极为理想的。

图6 Na2HPO4·12H2O不同掺量下的改性Ba(OH)2·8H2O过冷度
2.4 Na2SO4·10H2O改性Ba(OH)2·8H2O的储热性能
2.4.1 改性Ba(OH)2·8H2O的实验方案
通过预实验确定成核剂的大概添加范围应小于2%,否则Ba(OH)2·8H2O会与成核剂生成沉淀完全失去储热功能。成核剂Na2SO4·10H2O的添加质量比例如表6所示。为了方便表述,将添加了成核剂Na2SO4·10H2O的组记为BS组。

表6 BS组成核剂Na2SO4·10H2O的添加比例表
按表格中的质量比称取样品,将样品在烧杯中混合,橡胶塞塞紧烧杯,于85℃磁力搅拌加热器中边搅拌边加热,搅拌速度800RMP下搅拌,使其充分混合均匀,每5min观察一次混合物的形态,直至固相完全融化后,继续搅拌30min,冷却至结晶得到改性的Ba(OH)2·8H2O水合盐相变储能材料。
将制得的改性Ba(OH)2·8H2O水合盐相变材料,通过步冷曲线法,用4路温度巡检仪记录改性Ba(OH)2·8H2O降温过程中每一秒钟的温度,绘制步冷曲线,测得其结晶温度,从而得到过冷度,为相变温度与结晶温度的差值。
2.4.2 改性Ba(OH)2·8H2O的表征
图7是Na2SO4·10H2O改性的Ba(OH)2·8H2O的固体扫描电镜图像,可以看出主要是粘连在一起的棒状组成的珊瑚状的Ba(OH)2·8H2O晶体和极少部分球状的Na2SO4·10H2O晶体,排列非常致密,放大到一万倍可以看出珊瑚状是棒状粘连在一起的呈现的状态。从SEM图片中可以看出由于作为成核剂的Na2SO4·10H2O的添加量极少,并没有新的物质生成,制得的改性Ba(OH)2·8H2O仍然保持自身的优良性能,比如高潜热。

图7 Na2SO4·10H2O改性的Ba(OH)2·8H2O的SEM图
由于Ba(OH)2·8H2O晶体和成核剂Na2SO4·10H2O容易失水,熔融状态的Ba(OH)2·8H2O容易与空气中的CO2发生反应生成BaCO3。为了确定我们制得的样品为比较纯净的改性Ba(OH)2·8H2O,对试样进行了XRD检测,XRD图谱如图8所示。将样品的XRD图谱与Ba(OH)2·8H2O和Na2SO4·10H2O的标准卡片进行比对,可见样品的衍射峰与Ba(OH)2·8H2O和Na2SO4·10H2O物质的标准卡片基本一致。由此得出结论,本实验制得的试样基本为目标产物含有少量Na2SO4·10H2O改性Ba(OH)2·8H2O。

图8 Na2SO4·10H2O改性的Ba(OH)2·8H2O的XRD图
2.4.3 改性Ba(OH)2·8H2O的过冷情况分析
根据实验方案,BS组制得的4组改性Ba(OH)2·8H2O水合盐相变材料,通过步冷曲线法,用4路温度巡检仪记录改性Ba(OH)2·8H2O降温过程中每一秒钟的温度,绘制步冷曲线如图9所示,测得其结晶温度,从而得到过冷度,为相变温度与结晶温度的差值,具体数值见表7。

图9 BS组改性Ba(OH)2·8H2O相变储能材料步冷曲线(一)

表7 BS组改性Ba(OH)2·8H2O相变储能材料步冷曲线(一)
从图9与表7中可看出,添加成核剂Na2SO4·10H2O改性的Ba(OH)2·8H2O相变储能材料,Na2SO4·10H2O在一定掺量条件下,随着成核剂添加量的增加,过冷度出现一个先减小后增大的趋势。在成核剂Na2SO4·10H2O添加量为2%时,Na2SO4·10H2O与Ba(OH)2·8H2O形成过多BaSO4沉淀,在冷却过程中当温度降到50℃时仍然未发生相变,失去了储热功能。Na2SO4·10H2O掺加量为1.5%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为60.3℃,过冷度为17.7℃。Na2SO4·10H2O掺加量为1.0%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为73.2℃,过冷度为4.8℃。Na2SO4·10H2O添加量为0.5%时,改性的Ba(OH)2·8H2O相变储能材料的结晶温度为60.9℃,过冷度为17.1℃。
因此我们进一步细化成核剂Na2SO4·10H2O的添加梯度,探究最优的添加比例。实验设计方案如表8。
按照表8的成核剂添加比例进行实验,重复前面的制备方法与绘制步冷曲线的方法,绘制步冷曲线计算结晶温度与过冷度,如图10和表9所示。

表8 BS组成核剂Na2SO4·10H2O的添加比例表(二)

图10 BS组改性Ba(OH)2·8H2O相变储能材料步冷曲线(二)

表9 BS组改性Ba(OH)2·8H2O相变储能材料步冷曲线(二)

图11 Na2SO4·10H2O不同掺量下的改性Ba(OH)2·8H2O过冷度
根据表7和表9绘制出图11,为成核剂Na2SO4·10H2O不同掺加比例下改性的Ba(OH)2·8H2O相变储能材料的过冷度折线图。如图11所示,成核剂Na2SO4·10H2O的掺量越少,由于掺量不够达不到最佳成核效果,改性Ba(OH)2·8H2O的过冷度反而呈增大的趋势,Na2SO4·10H2O的掺量越多,形成沉淀失去储热效果。Na2SO4·10H2O掺量范围在0.5%至1.0%时,改性Ba(OH)2·8H2O的过冷度呈减小趋势。成核剂Na2SO4·10H2O的掺量范围在1.0%至1.5%时,改性Ba(OH)2·8H2O的过冷度呈增大趋势。成核剂Na2SO4·10H2O最优添加量为1.0%。对Ba(OH)2·8H2O的过冷抑制效果最好,改性的Ba(OH)2·8H2O过冷度在5℃以内,较为理想。
3 结 论
八水合氢氧化钡,属于低温相变水合盐材料,其相变温度为78℃,相变潜热约为300J/g,是已知的低相变温度(低于120℃)区单位体积相变潜热最高的水合盐,具有极高的研究价值。但Ba(OH)2·8H2O存在严重的过冷问题,过冷度大于20℃,严重制约了其应用,所以本文以Ba(OH)2·8H2O为研究对象,通过将Na2HPO4·12H2O与Na2SO4·10H2O作为成核剂加入Na2SO4·10H2O的方法对其改性优化有效降低了Ba(OH)2·8H2O过冷度,得出以下结论。
(1)将Na2HPO4·12H2O作为成核剂掺加到Ba(OH)2·8H2O中,制得改性Ba(OH)2·8H2O相变储能材料,对其微观形貌进行观察可以看出主要是棒状、黏连在一起的花瓣状的Ba(OH)2·8H2O晶体和极少部分纤维状的Na2HPO4·12H2O晶体。成核剂Na2HPO4·12H2O的掺量范围在0.3%至1.0%之间促进成核的效果最好,对Ba(OH)2·8H2O的过冷抑制效果最好,此范围内改性的Ba(OH)2·8H2O过冷度都在3℃以内,是极为理想的。
(2)将Na2SO4·10H2O作为成核剂掺加到Ba(OH)2·8H2O中,制得改性Ba(OH)2·8H2O相变储能材料,对其微观形貌进行观察可以看出主要是棒状、黏连在一起的花瓣状的Ba(OH)2·8H2O晶体和极少部分球状的Na2SO4·10H2O晶体。Na2SO4·10H2O掺量范围在0.5%至1.0%时,改性Ba(OH)2·8H2O的过冷度呈减小趋势。成核剂Na2SO4·10H2O的掺量范围在1.0%至1.5%时,改性Ba(OH)2·8H2O的过冷度呈增大趋势。成核剂Na2SO4·10H2O最优添加量为1.0%。对Ba(OH)2·8H2O的过冷抑制效果最好,改性的Ba(OH)2·8H2O过冷度在5℃以内,较为理想。
(3)综上得出结论,Na2HPO4·12H2O优于Na2SO4·10H2O,作为成核剂可以在极小的添加量(0.3%~1.0%)下达到极佳的抑制过冷效果,使改性Ba(OH)2·8H2O的过冷度降到3℃以下,添加0.3% Na2HPO4·12H2O改性的Ba(OH)2·8H2O具有极佳的储热性能在回收工业高温废气的应用上。
