miR-221/ 222 靶向抑制对三阴性乳腺癌MDA-MB-231 细胞顺铂敏感性的影响
2021-01-23叶惠荣袁惠玲王西跃吴丽华陈桂林陈丽娟张玉娟
叶惠荣 袁惠玲 曹 茵 王西跃 吴丽华 陈桂林 陈丽娟 张玉娟
广东省东莞市人民医院乳腺科,广东东莞 523000
微RNA(miR)-221/222 定位于人染色体Xp11.3[1],两者核心种子序列(68~72)完全同源,同时抑制miR-221/222 可抑制乳腺癌[2-3]、胶质瘤[4-5]等肿瘤细胞的增殖、迁移和侵袭。研究显示[6],耐药乳腺癌组织中miR-221/222 表达上调,但抑制miR-221/222 是否可增加三阴性乳腺癌(TNBC)的铂类药物敏感性目前较少见报道。鉴于此,本研究观察了抑制miR-221/222 对TNBC MDA-MB-231 细胞顺铂(DDP)敏感性的影响,现将结果报道如下:
1 资料与方法
1.1 一般资料
细胞株:TNBC MDA-MB-231 细胞购自美国模式菌种收集中心(ATCC)细胞库,编号:TCHU202,第2 代细胞。
试剂:miR-221 抑制剂、miR-222 抑制剂和miR-221/222 抑制剂(上海吉玛制药技术有限公司,货号:B05001);MTT 检测试剂盒(美国Trevigen 公司,货号:4890-25-01);Annexin V-FITC/PI 细胞凋亡试剂盒(大连美仑生物技术有限公司,货号:MA0220);Caspase-9、Bax、Bcl-2 一抗(美国Imgenex 公司,IMG-5709)。
仪器:GENios 多功能酶标仪(瑞士TECAN 公司);7900HT 实时荧光定量聚合酶链式反应(PCR)仪(美国ABI 公司);E10001 电泳槽(美国Invitrogen 公司)。
1.2 方法
1.2.1 细胞分组和转染 取对数生长期的MDA-MB-231 细胞,将其随机分为对照组、miR-221 抑制组、miR-222 抑制组和miR-221/222 抑制组,分别转染空白试剂、miR-221 抑制剂、miR-222 抑制剂和miR-221/222 抑制剂,转染后均给予DDP 5 μg/mL 进行细胞培养[7]。
1.2.2 荧光定量PCR 检测miR-221/222 mRNA 相对表达量 转染后24 h 时用Trizol 提取各组细胞的总RNA,采用荧光定量PCR 法检测各组MDA-MB-231细胞中miR-221/222 mRNA 的相对表达量,miR-221上 游:3’-ACACTCCAGCTGGGACCTTGGCATACA -ATGT-5’,下游:3’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAAATCT-5’;miR-222 上游:3’-ACACTCCAGCTGGGAGCTACATCTGGCTA-5’,下游:3’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACCCAG-5’;以U6 为内参(上游:3’-CTCGCTTCGGCAGCACA-5’,下游:3’-AACGCTTCACGAATTTGCGT-5’),逆转录反应操作均按照Takara036A(mRNA)/037A(micro RNA)公司逆转录试剂盒说明书进行,反应体系:SYBR®Premix Ex TaqTM(2×)5.0 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,ROX Reference DyeⅡ(50×) 0.2 μL,DNA 模板(上述逆转录产物)1.0 μL,dH2O 2.8 μL,Total 10.0 μL,反应体系20.0 μL,扩增条件37℃15 min,85℃5 s,4℃1 min,共40 个循环,反应终止后,将样本取出,-80℃冰箱内保存备用。采用2-ΔΔCt法分析计算[8]。
1.2.3 MTT 法检测细增殖抑制率 转染后24、48 h 时取各组细胞,采用MTT 法检测各组细胞吸光度(OD490)值,将孔板进行染色,每孔加20 μL MTT(5 mg/mL),常规培养4 h 弃孔内液体,每孔加入150 μL DMSO 溶解,摇床10 min 混匀,490 nm 波长在酶联免疫检测仪上测各孔的OD 值,实验重复3 次,计算细胞增殖抑制率,细胞增殖抑制率=(1-处理组A/对照组A)×100%[9]。
1.2.4 Annexin V-FTTC/PI 双染法检测细胞凋亡率转染后24、48 h 时取各组生长状态良好、密度在85%以上、贴壁完好的细胞,常规6 孔板接种,CO2培养箱37℃培养24 h,弃培养液,PBS 洗涤,0.25%胰酶消化细胞后加完全培养基,离心弃上清,PBS 重悬计数,离心弃上清,加Binding Buffer 悬浮细胞,加入V-FTTC 5 μL、PI 10 μL 避光5 min 以上后,进行流式细胞检测[10]。
1.2.5 蛋白质印迹法检查凋亡相关蛋白表达水平 转染后48 h 时取各组细胞,裂解后采用蛋白质印迹法检测各组Caspase-9、Bax、Bcl-2 蛋白表达水平:PBS清洗细胞,加RI-PA 进行裂解,蛋白电泳后湿转法转移蛋白至PVDF 膜,加Caspase-9、Bax、Bcl-2 蛋白抗体4℃孵育过夜,TBST 洗涤后孵育二抗,随后化学发光成像仪显影。以GAPDH 为内参,计算相对表达量[11]。
1.3 统计学方法
采用SPSS 23.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,采用单因素方差分析进行检验,进一步两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组miR-221/222 mRNA 相对表达量比较
各组间miR-221、miR-222 mRNA 相对表达量比较,差异均有统计学意义(P <0.05);进一步两两分析显示,miR-221 抑制组miR-221 mRNA 表达水平低于对照组,差异有统计学意义(P <0.05);miR-222 抑制组miR-221 mRNA 表达水平高于miR-221 抑制组,差异有统计学意义(P <0.05);miR-221/222 抑制组miR-221 mRNA 表达水平低于miR-222 抑制组,差异有统计学意义(P <0.05)。miR-221 抑制组与对照组miR-222 mRNA 表达水平比较,差异无统计学意义(P >0.05);miR-222 抑制组和miR-221/222 抑制组miR-222 mRNA 表达水平低于miR-221 抑制组和对照组,差异均有统计学意义(均P <0.05)。见表1。
表1 各组miR-221/222 mRNA 相对表达量比较(,n=6)

表1 各组miR-221/222 mRNA 相对表达量比较(,n=6)
注:与对照组比较,*P <0.05;与miR-221 抑制组比较,#P <0.05;与miR-222 抑制组比较,ΔP <0.05
2.2 各组细胞增殖抑制率比较
各组转染后24、48 h 的细胞增殖抑制率比较,差异均有统计学意义(均P <0.05);进一步两两比较显示,miR-221 抑制组与对照组转染后24、48 h 的细胞增殖抑制率比较,差异均无统计学意义(均P >0.05);miR-222 抑制组与miR-221 抑制组转染后24、48 h细胞增殖抑制率比较,差异均无统计学意义(均P >0.05);miR-221/222 抑制组转染后24、48 h 细胞增殖抑制率高于其余三组,差异均有统计学意义(均P <0.05)。见表2。
表2 各组细胞增殖抑制率比较(%,,n=6)

表2 各组细胞增殖抑制率比较(%,,n=6)
注:与对照组比较,*P <0.05;与miR-221 抑制组比较,#P <0.05;与miR-222 抑制组比较,ΔP <0.05
2.3 各组细胞凋亡情况比较
各组转染后24、48 h 的细胞凋亡率比较,差异均有统计学意义(均P <0.05);miR-221 抑制组与对照组转染后24、48 h 细胞凋亡率比较,差异均无统计学意义(均P >0.05);miR-222 抑制组与miR-221 抑制组转染后24、48 h 细胞凋亡率比较,差异均无统计学意义(均P >0.05);miR-221/222 抑制组转染后24、48 h 细胞凋亡率高于其余三组,差异均有统计学意义(均P <0.05)。见表3。
2.4 各组细胞凋亡相关蛋白相对表达水平比较
转染后48 h,各组间Caspase-9、Bcl-2 和Bax 表达水平比较,差异均有统计学意义(均P <0.05);进一步两两比较,miR-221 抑制组与对照组转染后48 h的细胞凋亡蛋白表达水平比较,差异均无统计学意义(均P >0.05);miR-222 抑制组与miR-221 抑制组转染后48 h 的细胞凋亡蛋白表达水平比较,差异均无统计学意义(均P >0.05);miR-221/222 抑制组转染后48 h 的Caspase-9 和Bax 水平高于其余三组,Bcl-2水平低于其余三组,差异均有统计学意义(均P <0.05)。见表4、图1。
表3 各组细胞凋亡情况比较(%,,n=6)

表3 各组细胞凋亡情况比较(%,,n=6)
注:与对照组比较,*P <0.05;与miR-221 抑制组比较,#P <0.05;与miR-222 抑制组比较,ΔP <0.05
表4 各组细胞凋亡相关蛋白相对表达水平比较(,n=6)

表4 各组细胞凋亡相关蛋白相对表达水平比较(,n=6)
注:与对照组比较,*P <0.05;与miR-221 抑制组比较,#P <0.05;与miR-222 抑制组比较,ΔP <0.05
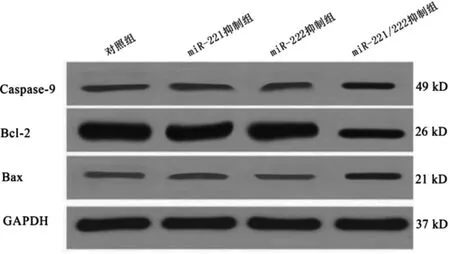
图1 蛋白质印迹法检查凋亡相关蛋白相对表达水平
3 讨论
乳腺癌是导致全球女性癌症相关死亡的重要因素,虽然手术为主的综合治疗方式取得了进展,患者5 年和10 年生存率不断提高,但复发和转移仍是影响乳腺癌患者10 年生存率不高的重大挑战,癌细胞对化疗的耐药性是导致乳腺癌复发和转移的主要原因之一。TNBC 是雌激素受体(ER)阴性、孕激素受体阴性和人类表皮生长因子受体2 阴性为免疫组化特征的乳腺癌亚型,占乳腺癌总数的10%~20%。与其他亚型比较,TNBC 恶性程度高、侵袭性强、预后较差,因为缺乏激素治疗的典型靶向受体,铂类药物是治疗TNBC 的常用化疗药物。DDP 是治疗TNBC 的常用化疗药物,DDP 耐药是导致TNBC 化疗失败的重要因素[12-15]。DDP 诱发肿瘤细胞DNA 损伤和细胞凋亡的同时,能激活DNA 修复系统,诱导核苷酸的切除修复和同源重组,进而导致细胞对DDP 产生耐药性,降低DNA 修复能力可增加肿瘤细胞的DDP 敏感性[16-19]。
TNBC 对铂类化疗的敏感性与基因组不稳定性之间存在相关性。miRNAs 是一类非编码的小RNA,参与包括肿瘤在内的多种生物学过程,通过3’非翻译区(3’UTR)碱基配对抑制靶基因mRNAs 的基因翻译和/或切割调控靶基因的表达,促进肿瘤的进展和耐药。miR-221/222 是位于X 染色体的miRNA 簇,既往研究显示[20],miR-221/222 在前列腺癌、结直肠癌、肝癌、乳腺癌等多种肿瘤中表达,并发挥癌基因的作用。近年来的研究显示[21],miR-221/222 除扮演癌基因角色外,还可影响肿瘤的耐药性。有研究显示,在脑胶质瘤中单纯抑制miR-221 可增加卡莫司汀的耐药性[22-24],乳腺癌MCF7 细胞单纯转染miR-221 后导致对选择性ER 下调剂氟维司群的耐药性增加[25]。但miR-221/222 与TNBC DDP 耐药的研究鲜见报道,尚需要进一步研究探讨。为了探讨miR-221/222 与TNBC DDP 耐药的关系,本研究采用荧光定量PCR 法检测了miR-221/222转染后DDP 培养的MDA-MB-231 细胞中miR-221和miR-222 的表达,结果显示,通过抑制miR-221、miR-222 及共抑制miR-221/22 后,MDA-MB-231 细胞中相应的miR-221/222 mRNA 表达减少,但单纯抑制miR-221 和miR-222 并未明显改变MDA-MB-231 细胞的增殖率和凋亡率,而共抑制miR-221/222可明显降低细胞的增殖率和凋亡率,蛋白质印迹法检测凋亡相关蛋白进一步证实了上述结果。本研究结果显示,miR-221/222 可促进TNBC MDA-MB-231 细胞对DDP 的耐药性,抑制miR-221/222 可增加MDAMB-231 细胞对DDP 的敏感性。
综上所述,本研究结果显示,miR-221/222 可调控TNBC 细胞的DDP 耐药性,为DDP 联合小分子非编码RNA 治疗TNBC 提供了新的研究方向。
