1,2-二羟基蒽醌降低金黄色葡萄球菌与白念珠菌混合生物膜的作用研究
2021-01-22张永臣
张永臣, 虞 玲, 黄 菁, 陈 飞
金黄色葡萄球菌(Staphylococcus aureus)和白念珠菌(Candida albicans)都是人体黏膜上常见的定植菌,可以分别引起一系列临床疾病,如败血症、尿路感染以及糖尿病足等[1-2]。然而,在临床环境中,细菌往往不单独存在,可以1种或者数种细菌形成混合感染,从而给临床抗感染治疗带来更大的挑战。金黄色葡萄球菌可以以白念珠菌的菌丝作为支架使二者在导管以及医疗器械表面形成混合生物膜。由于二者逐渐对临床上常用的抗菌药物耐药,因此迫切需要发现一些对细菌有抑制作用的化合物来解决临床上面临无药可用的局面[3]。1,2-二羟基蒽醌是一种源自茜草属根的天然化合物,毒性小,有研究表明其对白念珠菌的生物膜形成有一定的影响,而对金黄色葡萄球菌与白念珠菌混合生物膜的影响仍未知[4]。本研究旨在通过探究1,2-二羟基蒽醌对金黄色葡萄球菌与白念珠菌混合生物膜的影响及作用机制,进而为治疗由二者引发的混合感染奠定一定的基础,为临床治疗金黄色葡萄球菌和白念珠菌感染提供新的视角。
1 材料与方法
1.1 材料
1.1.1 菌株来源 选取2018年某医院临床分离鉴定并通过VITEK 2鉴定的2株耐甲氧西林金黄色葡萄球菌(MRSA),命名为SA1和SA2,以及2株对甲氧西林敏感金黄色葡萄球菌(MSSA),命名为SA3和SA4。白念珠菌DAY185购自国家卫生健康委员会临床检验中心。
1.1.2 仪器和试剂 本研究用仪器和试剂包括紫外可见分光光度计(美国Thermo公司),荧光定量PCR仪(美国Thermo公司),NanoDrop 2000/2000c 分光光度计(美国Thermo Fisher Scientific公司),96孔细胞培养板(美国Corning公司),氯仿、异丙醇(上海生工有限公司),1%结晶紫染液(美国ThermoFisher Scientific公司),反转录试剂盒(美国Thermo公司),实时荧光定量PCR检测试剂盒(美国Thermo公司),1,2-二羟基蒽醌(上海谱振生物科技有限公司)。
1.2 方法
1.2.1 1,2-二羟基蒽醌对混合菌生长能力检测 将4株金黄色葡萄球菌和白念珠菌DAY185分别接种到哥伦比亚血平板以及沙保弱平板上,于35 ℃条件下静置过夜培养。分别挑取单菌落于4 mL TSB培养基中,并于35 ℃、200 r/min条件下过夜培养,吸取100 μL过夜培养的菌液于10 mL新鲜的LB肉汤中,于37 ℃、200 r/min条件下继续传代培养,将传代培养后获得的菌液用TSB调至0.5 麦氏浊度,再将其1∶100稀释使其浓度达到106CFU/ mL,将金黄色葡萄球菌与白念珠菌按照1(10 μL)∶1(10 μL)的比例加入到4 mL TSB继续培养,同时设置加入10 mg/L 1,2-二羟基蒽醌的阳性对照组,以不加1,2-二羟基蒽醌的为正常组。每2小时用测定混合菌的吸光度值(D600)以检测1,2-二羟基蒽醌对金黄色葡萄球菌与白念珠菌的混合生长影响。此外,在相同条件下同时检测金黄色葡萄球菌与白念珠菌在无1,2-二羟基蒽醌条件下单独生长时以及1,2-二羟基蒽醌作用下金黄色葡萄球菌与白念珠菌生长能力的变化。
1.2.2 1,2-二羟基蒽醌对单菌种以及混合菌生物膜影响测定 使用半定量结晶紫染色法检测金黄色葡萄球菌和白念珠菌单独生长以及混合生长时生物膜形成的能力[5]。细菌的培养如前所述,将传代培养后的菌液用TSB调至0.5 麦氏浊度,再将其1∶100稀释使其浓度达到106CFU/ mL,分别吸取10 μL金黄色葡萄球菌和白念珠菌DAY185稀释后菌液加入到含有180 μL TSB的96孔板孔中,将96孔板置于37 ℃条件下静置培养24 h,实验设置3 个复孔,并以加入10 mg/L 1, 2-二羟基蒽醌为阳性对照组。培养结束后,弃菌液,使用无菌PBS冲洗3次,风干。用200 μL的100%甲醇将生物膜固定15 min。用PBS轻轻洗涤生物膜2次后风干,并用200 μL 1%结晶紫染色10 min。用PBS冲洗染色的生物膜(3次)以除去多余的污渍并干燥。然后加入100%乙醇100 μL。每孔分别吸取100 μL 测定D595值,计算3个复孔的平均值。实验独立进行3次。
1.2.3 统计学方法 应用GraphPad Prism 6.0对数据进行统计学分析以及图片绘制,以P<0.05为差异有统计学意义,P<0.01为差异具有显著统计学意义。
2 结果
2.1 1,2-二羟基蒽醌处理后混合菌生长能力分析
当未使用1,2-二羟基蒽醌处理时,金黄色葡萄球菌与白念珠菌混合菌群生长良好而稳定。在加入1,2-二羟基蒽醌的条件下,金黄色葡萄球菌与白念珠菌混合菌群生长受到抑制,光密度D595值下降1.5左右。MRSA和MSSA下降的趋势类似,与白念珠菌DAY185形成的生长曲线略有差异。此外,还研究了1,2-二羟基蒽醌对单种菌生长能力的影响,结果显示,其对金黄色葡萄球菌的生长能力影响较小,而对白念珠菌DAY185的生长能力影响较大,可以明显降低其生长能力。见图1。
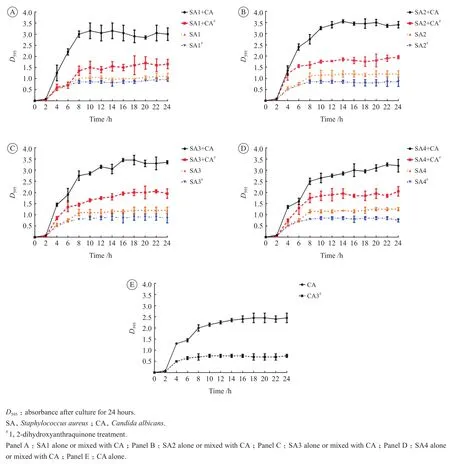
图 1 1,2-二羟基蒽醌对金黄色葡萄球菌与白念珠菌生长曲线的影响Figure 1 Effect of 1,2-dihydroxyanthraquinone on the growth of Staphylococcus aureus and Candida albicans
2.2 1,2-二羟基蒽醌作用后混合生物膜形成能力
静态生物膜形成的实验结果显示,当未使用1,2-二羟基蒽醌处理时,金黄色葡萄球菌与白念珠菌形成混合生物膜的能力强,D595值在4左右(图2A)。培养基中加入1,2-二羟基蒽醌10 mg/ L时,二者形成混合生物膜的能力明显下降,D595值下降幅度达到2.0~2.5。其中,对于SA4与白念珠菌DAY185形成的混合生物膜与未处理组相比,差异有统计学意义(P<0.05)。SA1、SA2、SA3与白念珠菌DAY185形成的混合生物膜与未加入1,2-二羟基蒽醌相比,差异有显著统计学意义(P<0.01)。进一步研究1,2-二羟基蒽醌对单菌种生物膜的影响,结果显示1,2-二羟基蒽醌对金黄色葡萄球菌生物膜形成能力的影响差异无统计学意义,对白念珠菌的影响差异具有显著统计学意义(P<0.01),结果如图2B所示。
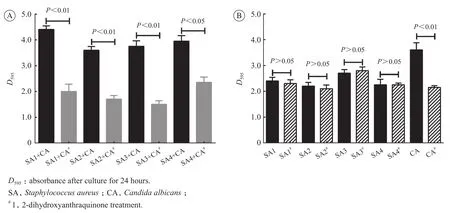
图 2 1,2-二羟基蒽醌对金黄色葡萄球菌和白念珠菌混生物膜形成能力的影响Figure 2 Effect of 1,2-dihydroxyanthraquinone on the formation of polymicrobial biofilms by Staphylococcus aureus and Candida albicans
3 讨论
金黄色葡萄球菌和白念珠菌是临床上重要的致病菌,两者可以分别形成单菌种生物膜[6]。之前的研究主要聚焦于单菌种生物膜,而对金黄色葡萄球菌与白念珠菌相互作用形成混合生物膜的研究甚少。研究的结果显示,与浮游状态下的细菌相比,生物膜状态下细菌的耐药性可以增加上千倍[7]。更令人担忧的是,相比单一菌生物膜,混合生物膜具有更强的致病性及抵御抗菌药物的能力。金黄色葡萄球菌与白念珠菌混合生物膜最初是在医疗器械及导管上形成的,随后才播散入血造成感染并重新在黏膜组织上定植形成抗菌药物难以清除的生物膜,因此有不少学者都提出可采用抗菌药物处理医疗器械及导管,从根源上避免感染发生。但是,抗菌药物往往有不良反应,因此人们逐渐将目光转移到可以降低生物膜的其他物质 上[8]。
蒽醌通常存在于茯苓等高等植物中,还有数种天然和合成的蒽醌类衍生物已显示具有抗微生物和抗炎活性[9-10]。1,2-二羟基蒽醌是蒽醌类的一种化合物,有研究表明其对白念珠菌有一定的抗菌作用,而对金黄色葡萄球菌与白念珠菌混合生物膜的抑制影响仍未知。本研究显示1,2-二羟基蒽醌对金黄色葡萄球菌与白念珠菌混合菌群的生长具有明显的抑制作用,其抑制作用可杀死部分金黄色葡萄球菌以及大多数白念珠菌,进一步研究显示1,2-二羟基蒽醌可以显著降低金黄色葡萄球菌和白念珠菌混合生物膜形成。推测其降低混合生物膜的能力主要是降低了白念珠菌生物膜的形成,使金黄色葡萄球菌失去了支架结构,进而使混合生物膜的形成明显减少[11]。因此可进一步探索与白念珠菌生物膜形成相关的基因的表达情 况。
本研究进一步探究了1,2-二羟基蒽醌是否对白念珠菌生物膜形成相关的黏附基因的表达有影响。结果显示:在1,2-二羟基蒽醌作用后,与白念珠菌菌丝形成相关的基因ALS3和RBT1明显下调,说明了1,2-二羟基蒽醌对金黄色葡萄球菌与白念珠菌混合生物膜的作用主要影响了白念珠菌菌丝的形成,导致混合生物膜的支架结构受损,最终导致了混合生物膜总量的下降。
本研究证实1,2-二羟基蒽醌具有一定的抑制金黄色葡萄球菌与白念珠菌混合生物膜形成的能力,将为临床上治疗由金黄色葡萄球菌与白念珠菌形成的混合感染奠定一定的基础。
