PM2.5暴露对哮喘大鼠气道形态及FOXP3基因DNA启动子区甲基化影响的实验研究*
2021-01-22林秀山周向东王才春
林秀山 周向东 王才春
(海南医学院第一附属医院呼吸内科,海口 570102)
支气管哮喘是呼吸道常见的慢性疾病,气道阻力增高以及高反应性是其显著特征[1-2]。越来越多的循证医学证据表明,哮喘发作与大气PM2.5浓度有明显相关关系,这种相关关系的发生机制十分复杂,表观遗传学(甲基化)的变化可能参与其中[3-4]。叉状头/翅膀状螺旋转录因子(fork head/winged helix transcription factor,FOXP3)是CD+CD25+Treg细胞表面的特异性信号分子,参与调控Treg细胞的形成与功能发挥[5],而TH1/TH2功能失衡是哮喘发病的重要机制,基于以上理论,课题组质疑FOXP3基因的甲基化可能参与了哮喘的发生以及发展。因此,本研究选取了50只SD大鼠为研究对象,构建哮喘模型并进行不同浓度PM2.5干预,探讨PM2.5暴露对哮喘大鼠气道形态及FOXP3基因DNA启动子区甲基化的影响。
1 材料与方法
1.1 PM2.5采集与处理
采用大流量颗粒采集装备,在早高峰及晚高峰时的繁华路口持续采集24 h。将采样后的滤膜进行切割、浸水后恒温振荡,洗脱后过滤,低温冻存;在真空中进行冷冻干燥处理,当水分完全蒸干时,容器底部可见呈灰白色絮状物的PM2.5颗粒。根据实验设计,采用生理盐水将PM2.5颗粒配置成1、5、25 mg/mL的悬浮液,现配现用。
1.2 实验动物模型建立及分组
50只SPF雄性SD大鼠(4~6周龄),体质量(203±15)g,购于四川大学实验动物实验中心,动物生产许可证号为SCXK(川)2013-026。根据干预措施及剂量的不同,将大鼠分为(1)对照组:给予与致敏剂同等剂量的生理盐水进行腹腔注射。(2)哮喘组:在实验的第1天,在大鼠大腿内侧皮下注射OVA悬液1 mL(卵清蛋白10 mg、氢氧化铝200 mg)进行致敏,同时腹腔注射百日咳杆菌悬液1 mL作为佐剂,在第8天、第15天各重复一次。大鼠出现典型激惹症状及肺组织出现大量炎性细胞浸润视为造模成功。(3)低剂量组:致敏方法同哮喘组。气管滴注PM2.5颗粒物悬液1.5 mg/kg体质量,3 d/次,共5次。(4)中剂量组:致敏方法同哮喘组。气管滴注PM2.5颗粒物悬液6 mg/kg,3 d/次,共5次。(5)高剂量组:致敏方法同哮喘组。气管滴注PM2.5颗粒物悬液24 mg/Kg,3 d/次,共5次。
1.3 肺泡灌洗液收集及肺组织切片
对大鼠进行动脉采血后处死,仰卧固定四肢,暴露胸腔,游离结扎左主支气管,在环状软骨上方向右支气管插入注射器,注射5 mL生理盐水,灌洗2次,收集约10 mL灌洗液。低温保存,2000 r/min离心15 min,收集上清,低温冻存。对离心后的沉淀进行重悬、稀释,在显微镜下用细胞计数板进行细胞总数计算。细胞沉淀涂片,干燥固定,染色后计数200个白细胞进行分类计算。处死大鼠并收集灌洗液后,取左肺下叶,用甲醛固定24 h后,石蜡包埋,切片约5 μm,进行HE染色。
1.4 RT-qPCR检测
采用TRlzol法提取肺组织中的RNA,采用β-action作为内参基因,参照反转录试剂盒说明书合成cDNA,利用SYBGGreen试剂盒进行RT-PCR反应。引物序列如下,
正向:GGCAAACGGAGTCTGCAAG,
反向:TGCTCCAGAGACTGCACCAC。
反应条件为,50 ℃ 2min,95 ℃变性15 s、30 ℃延伸30 s,40个循环。基因相对表达水平采用2-△△Ct法确定。
1.5 统计方法

2 结果
2.1 各组大鼠体质量变化
随着实验的延长,实验组大鼠摄食量减少,体质量增长速度减缓,毛发干枯竖立、无光泽,烦躁不安,易激惹,被激惹时有频繁点头、端坐呼吸等表现。与对照组相比,所有实验组大鼠的体质量均明显较低(P<0.05),与哮喘组相比,低、中、高剂量干预组的体质量均明显较低(P<0.05),见表1。

表1 各组大鼠体质量变化
2.2 各组大鼠脏器系数比较
5组大鼠的左肺指数、心脏指数、脾脏指数均存在明显差异(P<0.05),两两比较后发现,低、中、高剂量干预组的左肺指数及心脏指数显著高于对照组(P<0.05),但脾脏指数与对照组及哮喘组无明显差异(P>0.05)。见表2。
2.3 各组大鼠肺泡灌洗液细胞计数比较
与对照组比,哮喘组的细胞总数升高显著,低、中剂量干预组明显升高(P<0.05),高剂量干预组无明显变化(P>0.05)。与对照组及哮喘组比较,随着PM2.5干预剂量的升高,大鼠BALF内的嗜酸性粒细胞、中性粒细胞、淋巴细胞计数呈逐渐上升趋势,巨噬细胞呈逐渐下降趋势,差异均具有统计学意义(P<0.05),见表3。
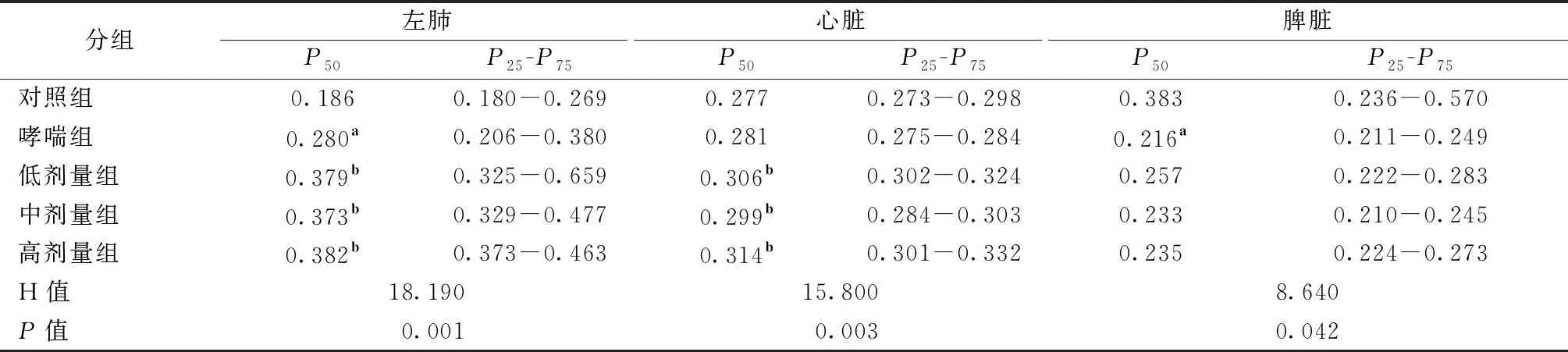
表2 各组大鼠脏器系数比较

表3 各组大鼠肺泡灌洗液细胞计数比较
2.4 各组大鼠肺组织HE染色
与对照组相比,哮喘组大鼠肺组织有明显的炎性细胞浸润,气道壁增厚。低剂量组炎症反应进一步加剧,并出现肺泡间隔断裂,正常结构破坏。中剂量组管腔内分泌物进一步增多,肺泡结构紊乱。高剂量组出现大量杯状细胞增生,正常肺泡结构少见,支气管上皮皱襞有断裂的趋势,少量细胞出现坏死,见图1。

图1 各组大鼠肺组织HE染色
2.5 FOXP3基因DNA启动子区甲基化及FOXP3 mRNA检测结果
将阳性对照标准品进行对倍稀释,对浓度取对数后作X轴,CT值为Y轴,可得FOXP3基因阳性对照标准曲线y=-1.39ln(x)+28.37=5,R2=0.996。结果发现,对照组、哮喘组、低剂量组、中剂量组、高剂量组的FOXP3基因DNA启动子区的甲基化水平分别为(7.24±0.91)、(5.04±3.08)、(1.87±1.46)、(1.57±0.64)、(2.04±1.14),FOXP3 mRNA相对表达量分别为(1.02±0.18)、(0.81±0.19)、(0.62±0.15)、(0.53±0.14)、(0.32±0.04),随着PM2.5干预剂量的提高,大鼠的FOXP3基因DNA启动子区的甲基化水平及FOXP3 mRNA相对表达量均逐渐降低。
3 讨论
PM2.5是指环境空气中直径≤2.5 μm的细小颗粒物,它能长时间在空气中悬浮,虽然在大气成分中含量很少,但会显著影响空气质量和能见度,且PM2.5颗粒径小,相对面积大,易附带有毒有害物质,对人体健康会造成明显的不良影响[6]。我国罹患哮喘的人口基数大,相关的医疗负担十分沉重[7]。其发病机制复杂,环境因素、遗传因素、生活习惯因素都参与了其中。PM2.5可明显促进哮喘等呼吸道疾病的发生发展,TH1/TH2功能失衡是重要机制,而FOXP3是调控Treg 细胞发育及启动抑制功能的关键基因,在近年来的研究中越来越受到重视[8-9]。
在本研究中,我们通过OVA悬液激发建立大鼠哮喘模型,随着实验的延长,大鼠摄食量减少,体质量增长速度减缓,毛发干枯竖立、无光泽,烦躁不安,易激惹,被激惹时有频繁点头、端坐呼吸等表现,与文献报道一致[10-11]。进一步行收集大鼠肺泡灌洗液,进行细胞计数后发现,哮喘组的细胞总数升高最显著,但高剂量干预组无明显变化。随着PM2.5干预剂量的升高,大鼠BALF内的嗜酸性粒细胞、中性粒细胞、淋巴细胞计数也呈逐渐上升趋势,巨噬细胞呈逐渐下降趋势。这表明大鼠哮喘模型建立成功。
Treg细胞分为天然型(nTreg)和诱导型(iTreg)两大类,参与调控免疫反应,对及时调整过度免疫反应、炎症反应起着关键作用[12]。FOXP3是CD+CD25+Treg细胞表面的特异性信号分子,参与调控Treg细胞的形成与功能发挥,对哮喘炎症有明显的缓解作用[13-14]。Coman等[15]将Treg细胞导入哮喘大鼠模型后,对肺组织进行染色后发现,嗜酸性粒细胞比例及TH2型细胞因子分泌量均显著下降,罗征秀等[16]报道称,与正常儿童相比,哮喘患儿痰液中的FOXP3+Treg 细胞比例明显降低。在本研究中,我们采用敏感度较高的PCR法检测了肺组织中FOXP3基因DNA启动子区甲基化及FOXP3 mRNA水平,结果发现,随着PM2.5干预剂量的提高,大鼠的FOXP3基因DNA启动子区的甲基化水平及FOXP3 mRNA相对表达量均逐渐降低。这表明,FOXP3基因启动子区的甲基化程度随着病情程度的加重,呈逐渐降低趋势,但相对而言,FOXP3 mRNA的表达水平受影响程度较小。我们推测,可能的原因有:(1)FOXP3的转录调控机制复杂,可能还受其他信号通路的影响。(2)本研究为动物实验,与人类基因研究存在种属差异性。(3)本研究中的甲基化引物是根据基因启动子区位点设计的,不能完全排除此位点的特异性。但实验中FOXP3基因的总体变化趋势与预想一致,表明随着哮喘的加重,FOXP3的基因表达量会受到明显抑制,这与其他研究者的结论相同。
综上所述,本研究发现,PM2.5对哮喘大鼠的损伤有一定的剂量依赖性,这可能与调低基因FOXP3基因DNA 启动子区甲基化水平及FOXP3 mRNA相对表达量有关。
