PTS预处理对大鼠心肌缺血再灌注损伤保护效果及机制研究
2021-01-22洪炳哲张习敬任海勤葛鲁敏
王 静 洪炳哲 张习敬 任海勤 葛鲁敏
(1.贵州盘江投资控股(集团)有限公司总医院,盘州市 553536)(2.齐齐哈尔医学院附属第三医院,齐齐哈尔 161000)
心肌缺血再灌注损伤(MIRI)指心肌组织经过一段时间缺血,血液恢复灌注后导致再灌注区心肌细胞出现功能障碍及进一步损伤的现象。这是心脏手术、器官移植及心脏缺血性疾病中常见的损伤[1]。人参,系五加科人参属植物,作为我国传统宝贵的药材,具有调节免疫,改善循环,抗氧化,抗炎等作用,不仅用于保健养生方面,还对多种疾病具有预防作用[2]。人参性温,味甘,微苦,其主要有效成分为人参皂苷。迄今为止,大概有40余种皂苷成分被分离出来,可分为3类,人参二醇皂苷、人参三醇皂苷、齐墩果烷皂苷。其中人参三醇皂苷具有心脏保护作用,已用于心血管系统等方面的研究[3-4]。本研究选用Wistar大鼠作为研究对象,用人参三醇皂苷预处理后,进行心肌缺血再灌注损伤模型的建立,观察人参三醇皂苷对心肌缺血再灌注大鼠心肌的保护作用。
1 材料与方法
1.1 动物来源
选用健康SPF级Wistar大鼠120只,雌雄各半,体质量为(220±20)g,由中南大学湘雅医学院实验动物中心提供,动物合格证号为:SCXK(湘)2015-0412。大鼠于温度为(25±2) ℃、相对湿度为30%~60%条件的动物房中饲养。适应性至少喂养1周后进行正式试验。本实验严格按照3R原则进行,且遵守医院动物伦理委员会规则。
1.2 试剂与设备
人参三醇皂苷(PTS),由中南大学天然药物化学教研室提供;生脉注射液,四川川大华西药业股份有限公司,批号17081613;PCR试剂盒,购于美国Sigma-Aldrich公司;ELISA试剂盒,如肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)等购于深圳达科有限公司;肌酸激酶同工酶(CK-MB)试剂盒购于南京生物工程研究所。JEM-1400EX透射电镜:日本电子株式会社;DG3022 A酶标仪:北京倍肯医疗;7020型全自动生化分析仪:日本日立公司。
1.3 动物分组
大鼠按随机原则分成6组,每组20只。具体分组如下:假手术组(生理盐水2 mL/kg体质量)、模型组(生理盐水2 mL/kg体质量)、PTS低剂量组(人参三醇皂苷25 mg/kg)、PTS中剂量组(人参三醇皂苷45 mg/kg)、PTS高剂量组(人参三醇皂苷90 mg/kg)、阳性药组(生脉注射液450 mg/kg)。各组大鼠于心肌缺血再灌注损伤前,即造模前,连续7 d腹腔注射给药。
1.4 大鼠心肌缺血/再灌注动物模型的建立
各组大鼠连续腹腔给药7 d,于末次给药1 h后进行造模手术。将大鼠麻醉后固定四肢,将其绑定到心电图仪上,记录正常心电图。将大鼠胸部去毛后,碘伏消毒,用手术刀沿胸左侧3~4肋间打开胸腔,剪开心包,挤出心脏,从冠状动脉左前降支穿线结扎,送回心脏,关闭胸腔,记录心电图变化,结扎成功的标志为:ST段下降或抬高0.1 mV。结扎缺血30 min后,开胸松解结扎线实现心肌再灌注,记录心电图变化情况。荷包缝合,再灌注24 h后取材料测定各项指标。假手术组仅进行冠脉穿线不进行结扎,其余各组均进行穿线结扎。
1.5 观察指标
1.5.1心电图ST段的变化:各组大鼠按照实验分组给药后,进行造模手术。将大鼠麻醉后固定在温控手术台上,于四肢皮下插入针型电极,监测心电,观察结扎缺血5、30 min时及松解缝合线实现再灌注后5、30、60 min时心电图的变化。
1.5.2血清指标的测定:大鼠再灌注24 h后经腹动脉取血5 mL,4 000 r/min离心15 min后,取上清液,检测血清中CK-MB、TNF-α和IL-6水平。
1.5.3心肌梗死面积的测定:大鼠取血后迅速取出大鼠心脏,用氯化钠注射液洗净后剪去右心室。用滤纸将水吸干后左心室称质量。沿心尖断面切厚度相等的4~5片,置于0.1%的氯化硝基四氮唑蓝溶液中,染色15 min,取出固定,用数码相机照相。ImagePro Plus 6.0图像软件评价分析心肌梗死面积比例(正常心肌组织为蓝色,梗死面积呈灰白色;心肌梗死面积比例=梗死区面积/左心总面积)。
1.5.4心肌组织病理学检查:心肌再灌注24 h后,在结扎线附近,取缺血中央区域部分心肌组织,置于4%甲醛溶液中固定,脱水,常规切片,进行HE染色。用中性树胶封片,于光镜下观察心肌组织病理学改变。
心肌再灌注24 h后,沿心肌纤维方向取一块梗死区域的心肌组织,置于4 ℃,4%戊二醛中固定。包埋剂包埋成块,超薄切片,双染色等,按常规透射电镜要求制备样品。用电子显微镜观察心肌细胞超微结构改变。
1.5.5PCR检测mRNA:采用总RNA提取试剂盒提取总RNA。提取后建立相应逆转录和扩增反应条件,预变性:94 ℃,2 min;变性:94 ℃,30 s;退火:49.3 ℃,30 s;延伸:72 ℃,2 min,循环33次,最后再72 ℃延伸5 min。引物序列:Bcl-2,上游引物5’-GCGCAGATCCACCATTGCTAT-3’,下游引物5’-GCTCCGTTGCAGCCTACT TCCG-3’;Bax,上游引物5’-GTCTCTTCTACTCATCGTGC-3’,下游引物5’-AGG CGTCTATCAACTGAAAG-3’;β-actin为内参,上游引物:5’-TGCTCGCCGG TATGTAGGCCTG-3’,下游引物:5’-TCCGTCGCCCTCATCCTGAGGTG-3’。
1.6 统计方法
采用SPSS18.0统计软件分析,采用t检验进行组间比较,以P<0.05,P<0.01为差异有统计学意义。
2 结果
2.1 心电图ST段的变化
心电监测结果见表1。模型组大鼠缺血5、30 min及再灌注5、30、60 min时,心电图ST段显著高于假手术组(P<0.01)。与模型组比较,阳性药组大鼠缺血5、30 min及再灌注5、30、60 min时,均能显著抑制ST段抬高(P<0.05、0.01);PTS高剂量组大鼠缺血及再灌注后各时间点,同样能显著抑制ST段抬高(P<0.05、0.01);PTS中剂量组大鼠缺血5、30 min及再灌注后30 min时,能显著抑制ST段抬高(P<0.05);而PTS低剂量组大鼠心电图ST段无明显变化。
2.2 血清CK-MB、IL-6、TNF-a水平
模型组大鼠血清CK-MB、IL-6、TNF-α水平较假手术组明显增加,差异显著(P< 0.05、0.01)。与模型组比较,阳性药组大鼠血清各炎症因子水平显著降低(P< 0.05、0.01);PTS高剂量组同样能显著抑制大鼠血清各炎症因子水平(P<0.05、0.01);PTS中剂量组能显著抑制大鼠血清CK-MB、TNF-α水平(P<0.05);PTS低剂量组大鼠血清水平变化不明显,见表2。

表1 各组大鼠心电图ST段变化
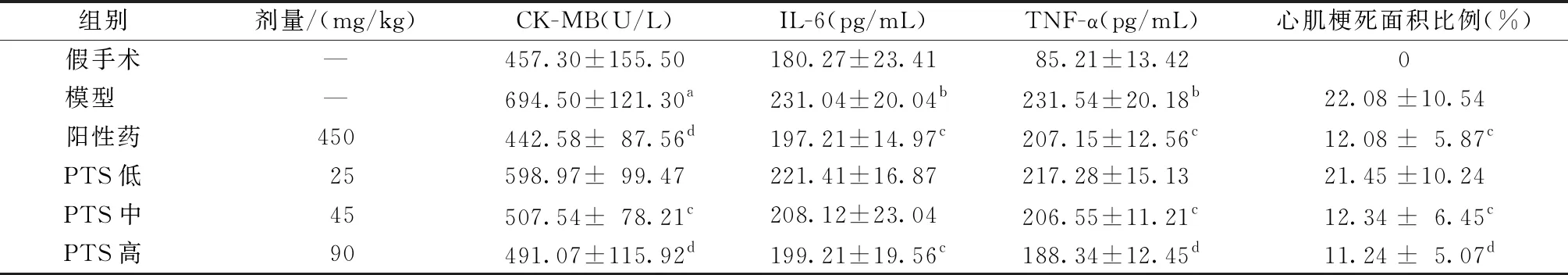
表2 各组大鼠血清生化指标及心肌梗死面积
2.3 心肌梗死面积比例
模型组大鼠心肌梗死面积比例达到21.97%。与模型组相比,阳性药组大鼠心肌梗死面积比例显著降低(P<0.05);PTS中剂量及高剂量组大鼠心肌梗死面积比例也显著降低(P<0.05、0.01);而PTS低剂量组心肌梗死面积比例无显著变化。
2.4 心肌病理形态
大鼠心肌组织进行石蜡切片、HE染色,结果见图1。假手术组心肌细胞结构形态完整,纤维排列规则,膜正常,组织间隙正常。模型组心肌间质出现明显水肿,有大量心肌细胞坏死,中性粒细胞大量浸润,胞浆红染,核消失,肌纤维被破坏。阳性药组与模型组比较,有局部少量血管扩张充血,心肌细胞排列较正常,炎性细胞浸润明显减少。PTS高剂量组和PTS中剂量组,与模型组比较,心肌间质水肿明显减轻,心肌细胞形态基本正常,炎性细胞浸润程度明显减少。而PTS低剂量组与模型组比较,仍明显可见心肌细胞小片坏死,炎性细胞浸润。
2.5 心肌细胞超微结构
大鼠电镜下心肌组织的变化见图2。假手术组心肌细胞结构完整,核仁清楚,细胞核呈长椭圆型,染色质分布均匀;胞质内肌节清晰;线粒体形态正常;未见炎性细胞浸润和胶原纤维沉积。模型组心肌细胞超微结构明显受损:肌膜破裂,肌丝排列紊乱,染色质出现凝聚成块,区域性胶原纤维沉积。阳性药组:心肌细胞结构基本完整,线粒体轻微肿胀。PTS高剂量组和PTS中剂量组,与模型组比较,心肌细胞受损明显减轻,线粒体基本完整,细胞核异常程度减少,核仁较清楚,肌丝排列较整齐。PTS低剂量组与模型组比较没有明显改善,心肌细胞受损,细胞核染色块凝聚,血管内皮细胞肿胀等。
2.6 Bcl-2和Bax基因的表达
与假手术组相比,模型组Bcl-2和Bax mRNA水平明显升高(P<0.05)。与模型组比较,阳性药组、PTS高剂量组和PTS中剂量组大鼠Bcl-2 mRNA水平明显升高(P<0.05),Bax mRNA水平明显降低(P<0.05)。PTS低剂量组与模型组比较差异不明显,结果见图3。

图1 大鼠心肌病理形态变化 (×200)

图2 大鼠心肌细胞超微结构的变化 (×5000)

图3 Bcl-2和Bax mRNA水平变化
3 讨论
近年来,冠状动脉粥样硬化性心脏病发病率逐年增高,心肌梗死(MI)成为人类健康的第一杀手[5]。心肌梗死是冠状动脉的血流急剧减少,而导致大量心肌坏死。治疗最关键方法是尽快恢复血流再灌注,但有研究认为缺血再灌注的二次损伤比心肌梗死还要严重,可导致严重的心律失常[6]。因此怎样预防心肌缺血再灌注损伤变得尤为重要。
本研究参考相关文献,选择大鼠心肌缺血30 min,再灌注24 h时间点进行造模[7]。结果表明,大鼠缺血5、30 min及再灌注后5、30、60 min时,模型组比假手术组心电图ST段明显抬高(P<0.01)。心电图ST段改变与心肌缺血再灌注损伤紧密相关。经HE染色及透射电镜下观察模型组的心脏组织结构发现确有心肌缺血坏死等改变,且血清各炎症因子水平显著升高,说明造模成功。经PTS中剂量及高剂量组预处理的大鼠心肌细胞受损明显减轻,细胞核异常程度减少,未见明显炎症细胞浸润,且心肌梗死面积显著低于模型组大鼠。而PTS低剂量组,可能是因为药物浓度过小原因,心肌受损情况没有较大改善。这说明,PTS对心肌缺血再灌注损伤有保护作用,作用强弱与剂量相关。
MIRI是一个复杂的病理生理过程,涉及心肌细胞凋亡、炎症反应、冠状血管内皮损伤、中性粒细胞浸润等方面[8-9]。陈涛等[10]报道炎症反应与MIRI关系密切,发生MIRI时,血管内皮细胞将释放大量炎症因子,如IL-6、TNF-a等;而炎症因子会进一步促进细胞因子级联反应,诱导细胞间粘附分子的表达,加重心肌损伤。宋维鹏等报道[11]在心脏衰竭患者血清IL-6、TNF-a水平明显升高,且随着患者病情的恶化,二者水平进一步增加。血清心肌酶谱,尤其是CK-MB浓度是临床上对心肌炎以及心肌梗死等心肌损伤性疾病的主要判定指标。本实验结果表明,一定剂量的PTS能降低大鼠血清CK-MB、IL-6及TNF-α水平,提示,PTS对心肌缺血再灌注损伤的保护作用可能是通过降低心肌组织的炎性反应而实现的。
细胞凋亡是MIRI发病机制的重要环节之一,凋亡的程度决定了MIRI损伤的严重程度。细胞凋亡基因可分为二类,第一类为前凋亡蛋白,有诱导细胞凋亡的作用,如Bax等;第二类为抗凋亡蛋白,有抗凋亡和保护细胞生存作用,通过与前凋亡蛋白结合而发生作用,如Bcl-2等,当Bcl-2与Bax结合后,可抑制Bax诱导凋亡作用[12-13]。正常生理情况下,Bcl-2与Bax水平处于动态平衡中,当机体受到外部影响,Bcl-2与Bax平衡状态被打破,Bax大量分泌,而体内Bcl-2不能完全结合Bax,导致细胞凋亡。本实验结果表明,PTS高剂量组和PTS中剂量组大鼠Bcl-2 mRNA水平明显升高(P< 0.05),而Bax mRNA水平明显降低(P< 0.05)。这提示:PTS能调控心肌凋亡和抗凋亡关键酶,从而抑制心肌凋亡,减轻心肌缺血再灌注损伤。
综上所述,本研究表明PTS预处理能减轻心肌细胞损伤,缩小心肌梗死面积,有效保护心肌缺血再灌注损伤大鼠的心肌细胞,其作用机制可能与降低大鼠血清CK-MB、IL-6及TNF-α水平,及调节凋亡和抗凋亡关键酶Bcl-2和Bax的表达相关。
