滋阴化痰方调控肿瘤细胞来源外泌体对HUVECs管样分化的影响*
2021-01-21李晶晶季青刘煊李琦岳小强
李晶晶,季青,刘煊,李琦,岳小强
1.中国人民解放军第二军医大学长征医院,上海200003;2.上海中医药大学附属曙光医院,上海200003
胃癌是我国常见恶性肿瘤,虽然手术、放疗、化疗等技术不断进步,靶向药物也不断涌现,但目前对于胃癌的整体疗效仍不理想。近年来,中医药在胃癌综合防治中的作用与地位越来越受到重视。滋阴化痰方(Ziyin Huatan Recipe,ZYHT)是上海长征医院中医科基于“胃癌痰证理论”所创制的针对晚期胃癌的有效方剂。前期研究证实其对胃癌血管新生有明显的抑制作用[1],但其确切机制尚不明确。外泌体是由多种细胞(包括肿瘤细胞)通过胞吐方式分泌至微环境中的一种直径在30~100 nm,具有双层膜结构的囊状结构[2],几乎所有的细胞都可以分泌外泌体,有些微生物亦可以产生[3-5]。近年来发现在细胞之间的通讯中发挥重要调节作用[6],可直接转运促血管新生相关蛋白至内皮细胞,也可通过转运microRNA和lncRNA,进而影响促血管新生因子的表达[7]。外泌体不仅本身参与肿瘤免疫、肿瘤侵袭及转移等过程,并且肿瘤外泌体携带的内容物可能作为肿瘤标志物用于肿瘤的早期诊断与治疗[8]。现代研究者认为,外泌体研究虽属微观分子学,但其整体表达的特点与中医整体观念有相似性[9]。目前更有学者将外泌体引入中医的研究领域,为中医和外泌体的结合带来新的进展与突破[10]。本研究拟观察ZYHT是否通过调控胃癌细胞来源的外泌体来影响人脐静脉内皮细胞管样分化,继而影响肿瘤的血管新生。
1 材料
1.1 细胞HUVECs、SGC-7901、MGC-803均购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药品与试剂ZYHT中所需药物百合(批号:18041006)、白花蛇舌草(批号:18082704)、制半夏(批号:19052209)均为吴江上海蔡同德中药饮片公司提供。DMEM培养基(美国Hyclone公司,批号:AE29431636);FBS(美国 GIBCO 公司,批号:42G9081K);0.25%胰蛋白酶-0.02%EDTA(上海碧云天科技有限公司,批号:090619191011);PKH67细胞膜标记荧光染色剂(美国Sigma公司,批号:MKCH2943);Matrigel基质胶(美国BD公司,批号:9189007);BCA蛋白质定量试剂盒(上海碧云天科技有限公司,批号:010719190723);表面标志物TSG101、CD81多克隆抗体(美国Proteintech公司,批号:14497-1-AP、66866-1-Ig);GAPDH多克隆抗体(美国Cell signaling公司,批号:14971633)。细胞培养上清外泌体快速抽提试剂盒HieffTM(上海翊圣生物科技有限公司,批号:H8914770)。
1.3 仪器倒置相差显微镜(日本奥林巴斯公司,型号:CKX53);CO2培养箱(美国Thermo公司,型号:CCL-170B-8);多功能酶标仪(美国Biotek Instruments公司,型号:8218141);透射电镜(美国FEI公司,型号:Tecnai G2 Spirit Biotwin);纳米颗粒跟踪分析仪NanoSight(英国Malvern公司,型号:Zeta View);共聚焦荧光显微镜[奥林巴斯(中国)有限公司,型号:IX73]。
2 方法
2.1 ZYHT制备将百合30 g,白花蛇舌草30 g和制半夏15 g,加8倍水煎2次,每次2 h,将煎液滤过,减压浓缩成膏。加入2倍乙醇搅拌,静置48 h,过滤并回收乙醇,浓缩成膏,并干燥粉碎[11]。由上海长征医院药材科统一制备,质控稳定。ZYHT配制:用培养基配制1 g·L-1母液。CCK-8法检测ZYHT的IC10值,根据IC10值确定ZYHT的给药浓度[1]。此次实验确定高剂量ZYHT(ZYHT-H)和低剂量ZYHT(ZYHT-L)为研究对象。
2.2 外泌体的分离纯化取对数生长期的第4代MGC-803细胞,分别加入2种不同剂量的ZYHT,用去除外泌体的完全培养基培养48 h后,收集上清培养液,0.22μm 滤膜过滤,离心半径11.5 cm,3 000 g离心10 min,小心收集上清并转移至新的离心管,于冰上放置待用;加入一定比例的外泌体抽提试剂,涡旋振荡混匀1 min,放置4℃静置2 h或过夜;取出装有混合液的离心管于4℃,离心半径8.4 cm,10 000 g离心60 min,弃上清,收集沉淀,取适量PBS均匀吹打离心沉淀物,使其充分混匀,并转移至新的离心管中;将含有外泌体的离心管于4℃,离心半径8.4 cm,12 000 g离心2 min,弃沉淀,保留上清;将获取的MGC-803-Exos于80℃保存备用,避免反复冻融。SGC-7901-Exos操作同前。
2.3 外泌体的鉴定
2.3.1 透射电镜观察MGC-803-Exos形态取10μL的MGC-803-Exos滴于透射电镜专用的载样铜网上,常温静置2 min,滤纸吸去浮液,用1%(W/V)磷钨酸溶液染色5 min后,滤纸吸去多余染色液,晾干,透射电镜观察MGC-803-Exos的形态。
2.3.2 W estern blot法检测MGC-803-Exos膜表面标志性蛋白取MGC-803-Exos 100μg,加入100μL的RIPA裂解液,吹打使裂解液和MGC-803-Exos充分混合,冰上裂解30min,在4℃下,离心半径8.4 cm,12 000 g离心30 min,吸取上清液置于1.5 mL EP管中,-80℃冻存。BCA法检测蛋白浓度后,加入5×Loading Buffer,99℃变性10 min。按每孔20μL上样至10%SDS-PAGE胶,80 V电泳30min,120 V电泳1 h,采用湿法转膜,200mA转膜1 h 30 min,5%BSA封闭液室温封闭2 h,5%BSA封闭液以1∶1 000的比例稀释一抗GAPDH、TSG101和CD81,4℃孵育一抗过夜。TBST漂洗10 min,洗涤3次,加入二抗室温孵育2 h,加入显影液,上机曝光。
2.3.3 MGC-803-Exos粒径分析取浓度为100 mg·L-1的100μL的MGC-803-Exos重悬于1.5 mL PBS内,经纳米颗粒跟踪分析仪NanoSight进行检测。SGC-7901-Exos操作同前。
2.4 外泌体与HUVECs共培养观察
2.4.1 外泌体染色取浓度为100 mg·L-1的MGC-803-Exos加入300μL的DiluentC溶液混匀,配制成MGC-803-Exos工作液,以确保完全分散。在新的离心管中加入1μL的PKH6与250μL的Diluent C溶液混匀,配制成PKH67染色液。SGC-7901-Exo工作液和PKH67染色液轻柔混匀4 min后,加入等体积0.5%BSA结合多余染料,室温孵育20min。加入比例外泌体提取试剂4℃避光静置2 h。4℃,10 000 g,离心60 min,PBS重悬染色后的MGC-803-Exos。将含有外泌体的离心管于4℃,离心半径8.4 cm,12 000 g离心2 min,弃沉淀,保留上清,用0.22 nm滤器过滤,4℃避光保存备用。
2.4.2 MGC-803-Exos与HUVECs共培养取第5代HUVECs重悬于无血清培养基中,以5×104·mL-1浓度加入24孔板中,每孔100μL(5 000个),置于37℃、5%CO2培养箱中,待细胞贴壁后加入上述PKH67荧光标记的MGC-803-Exos,孵育24 h后去培养基,将细胞用TBST洗3遍,每次3 min;用4%多聚甲醛固定爬片15 min(可4℃固定过夜),PBS洗3次,每次3 min;每孔加入0.5%Tritonx-100 250μL,室温通透20 min(细胞膜打孔);用TBST洗3遍,每次3~5 min,吸水纸吸干;每孔加入DAPI200μL,避光孵育5min,用TBST洗3遍,每次3 min;染膜:膜探针(红色),1∶100稀释,每孔200μL,染5~20 min,用TBST洗3遍,每次3 min。共聚焦荧光显微镜下观察ADSC-Exos是否进入细胞,镜下PKH67荧光标记的MGC-803-Exos呈绿色荧光。SGC-7901-Exos操作同前。
2.4.3 外泌体影响进HUVECs管样结构形成实验
将Matrigel基质胶置于96孔板中,37℃孵育30 min使其凝固。用无血清培养基重悬第5代HUVECs后接种至96孔板中,每孔2×104个细胞。实验分为4组分别加入浓度为100 mg·L-1的MGC-803-Exos、300 mg·L-1的MGC-803-Exos、500 mg·L-1的MGC-803-Exos以及等量PBS(对照组)。每组3个复孔。于37℃处理48 h后,倒置相差显微镜下观察管状结构形成情况,计算每孔分支结构总长度。SGC-7901-Exos操作同前。
2.5 统计学方法采用SPSS 19.0统计软件进行分析,计量资料以均数±标准差表示,多组比较时,先行正态性检验,若不符合正态分布,则采用非参数检验KruskalWallis检验法;若符合正态分布,则采用单因素方差分析(one way ANOVA),多个实验组与对照组进行比较采用Dunnett′s test检验。检验水准为α=0.05,以P<0.05为差异有统计学意义。
3 结果
3.1 外泌体鉴定透射电镜观察示,MGC-803-Exos和SGC-7901-Exos为大小均匀、形态一致的圆形或椭圆形膜性囊泡,边缘清晰。纳米颗粒跟踪分析仪NanoSight检测显示,MGC-803-Exos粒径范围为37.9~203.5 nm,SGC-7901-Exos粒径范围57.4~147.5 nm 符合外泌体粒径范围30~200 nm(见图1、图2)。Western blot检测显示,TSG101和CD81为其标志蛋白,内参蛋白为GAPDH(见图3)。

图1 MGC-803-Exos的电镜形态和粒径大小

图2 SGC-7901-Exos的电镜形态和粒径大小

图3 外泌体的标志蛋白CD81、TSH101
3.2 外泌体与HUVECs共培养为了进一步验证外泌体能否被HUVECs摄取,我们对外泌体进行染色标记,与HUVECs共培养24 h后,发现在共聚焦显微镜下被PKH67荧光标记的外泌体呈云雾状或斑片状绿色荧光,聚集在细胞核周围。说明外泌体可以被HUVECs摄取(见图4)。

图4 血管内皮细胞摄取外泌体
3.3 ZYHT调控肿瘤细胞来源外泌体抑制HUVECs管样结构形成将外泌体与HUVECs共培养,观察ZYHT能否调控外泌体影响HUVECs的管样分化能力。倒置相差显微镜观察结果显示,当外泌体浓度为100 mg·L-1时,不论是MGC-803-EXOs或SGC-7901-EXOs对HUVECs成管能力无明显影响。但当外泌体浓度为300 mg·L-1和500 mg·L-1时,ZYHT调控外泌体影响HUVECs的管样分化能力与对照组相比表现出明显差异(见图5、图6)。

图5 ZYHT调控MGC-803-Exos对HUVECs体外成管能力的影响

图6 ZYHT调控SGC-7901-Exos对HUVECs体外成管能力的影响
3.4 不同处理方式对MGC细胞的比较运用重复测量方差分析的方法发现在MGC-803细胞实验中不同的处理之间存在着显著的差异(F =212.257,P<0.001),不同处理方法与不同浓度之间的交互作用显著(F=49.539,P<0.001),而不同浓度之间不存在显著的差异(见表1和表2)。由表1可知,HUVECs的分支长度,在MGC-803-Exos组是随着浓度的增加而增加;在ZYHT-L-MGC-803-Exos组和ZYHT-H-MGC-803-Exos组是随浓度的增加而减少。由表2可知,外泌体浓度为100mg·L-1,MGC-803-Exos组的HUVECs分支长度最长;外泌体浓度为300 mg·L-1和500 mg·L-1,ZYHT-H-MGC-803-Exos组的HUVECs分支长度最短。由此得出ZYHT调控MGC-803-Exos抑制HUVECs管样分化能力的影响是随着外泌体浓度的增加及ZYHT剂量的增加而增强(见图7)。
表1 不同浓度在同一实验处理的比较 (±s)

表1 不同浓度在同一实验处理的比较 (±s)
注:*表示P<0.05;**表示P<0.01;***表示P<0.001
处理方法(I)浓度(ρ/mg·L-1)(J)浓度(ρ/mg·L-1)平均差异(I-J )***MGC-803-Exos 100 300-1 107.33 500-3 674.33 300 100 1 107.33***500-2 567.00 500 100 3 674.33 300 2 567.00 ZYHT-L-MGC-803-Exos 100 300 1 359.00*500 2 273.67*300 100-1 359.00*500 914.67*500 100-2 273.67*300-914.67*ZYHT-H-MGC-803-Exos 100 300 2 473.67**500 3140.67**300 100-2473.67**500 667.00 500 100-3140.67**300-667.00
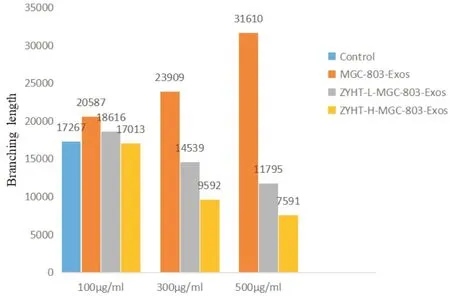
图7 不同浓度在同一实验处理的比较
3.5 不同处理方式对SGC-7901细胞的比较在SGC-7901细胞实验中,不同的处理之间也存在着显著的差异(F=408.572,P<0.001),不同浓度之间存在显著差异(F=53.374,P<0.01),且不同处理方法与不同浓度之间的交互作用显著(F=407.535,P<0.001)(见表3和表4)。由表3可知,HUVECs的分支长度,在SGC-7901-Exos组是随着浓度的增加而增加;在ZYHT-L-SGC-7901-Exos组和ZYHT-H-SGC-7901-Exo是随浓度的增加而减少。由表4 可知,外泌体浓度为100 mg·L-1的情况下,SGC-7901-Exos组的HUVECs分支长度最长;外泌体浓度为300 mg·L-1和500 mg·L-1,ZYHT-H-SGC-7901-Exos组的HUVECs分支长度最短。由此得出ZYHT调控SGC-7901-Exos抑制HUVECs管样分化能力的影响是随着外泌体浓度的增加及ZYHT剂量的增加而增强(见图8)。
表2 不同处理在同一浓度的比较(±s)

表2 不同处理在同一浓度的比较(±s)
注:*表示P<0.05;**表示P<0.01;***表示P<0.001
浓度(ρ/mg·L-1)(I)处理方法(J)处理方法平均差异(I-J )100 Control MGC-803-Exos-1106.67 ZYHT-L-MGC-803-Exos-449.67 ZYHT-H-MGC-803-Exos 84.67 MGC-803-Exos Control 1106.67 ZYHT-L-MGC-803-Exos 657.00 ZYHT-H-MGC-803-Exos 1191.33**ZYHT-L-MGC-803-Exos Control 449.67 MGC-803-Exos-657.00 ZYHT-H-MGC-803-Exos 534.33 ZYHT-H-MGC-803-Exos Control-84.67 MGC-803-Exos-1191.33*ZYHT-L-MGC-803-Exos-534.33 300 Control MGC-803-Exos-2214.00*ZYHT-L-MGC-803-Exos 909.33 ZYHT-H-MGC-803-Exos 2558.33*MGC-803-Exos Control 2214.00*ZYHT-L-MGC-803-Exos 3123.33***ZYHT-H-MGC-803-Exos 4772.33***ZYHT-L-MGC-803-Exos Control-909.33 MGC-803-Exos-3123.33***ZYHT-H-MGC-803-Exos 1649.00***ZYHT-H-MGC-803-Exos Control-2558.33*MGC-803-Exos-4772.33***ZYHT-L-MGC-803-Exos-1649.00***500 Control MGC-803-Exos-4781.00 ZYHT-L-MGC-803-Exos 1824.00*ZYHT-H-MGC-803-Exos 3225.33*MGC-803-Exos Control 4781.00 ZYHT-L-MGC-803-Exos 6605.00 ZYHT-H-MGC-803-Exos 8006.33*ZYHT-L-MGC-803-Exos Control-1824.00*MGC-803-Exos-6605.00*ZYHT-H-MGC-803-Exos 1401.33*ZYHT-H-MGC-803-Exos Control-3225.33*MGC-803-Exos-8006.33*ZYHT-L-MGC-803-Exos-1401.33*

表3 不同浓度在同一实验处理的比较

表4 不同处理在同一浓度的比较

图8 不同处理在同一浓度的比较
4 讨论
近年来随着对肿瘤微环境研究的不断深入,外泌体开始受到越来越多的关注。外泌体在肿瘤的自噬、化疗抵抗、转移等生物学进程中发挥重要的调控作用[12]。众所周知,在肿瘤发生的早期就伴随着新血管的生长,而更多研究表明肿瘤的血管新生与其产生的外泌体密切相关。外泌体作为肿瘤与各种正常细胞之间的通讯系统,可以将自身携带的与血管新生相关蛋白、microRNA和lncRNA传递给参与血管生成的受体细胞的分子和遗传物质,并促进内皮细胞和其他正常细胞表型和功能的重新编程[13]。研究发现恶性黑色素瘤细胞来源的外泌体内含有miRNA-9,其可以通过激活JAK-STAT通路来促进血管内皮细胞的管腔形成[14]。Umezu等[15]发现来源于人类白血病肿瘤细胞的外泌体传递的miRNA被HUVECs摄取后,可增加肿瘤细胞迁移能力和促进血管管腔的形成。Yuk-Kit等[16]研究发现人鼻咽癌 C666-1 细胞分泌的外泌体被HUVECs胞吞后,改变了HUVECs相应的蛋白质,促进血管生成,表明外泌体可能通过改变内皮细胞蛋白质的表达水平来促进血管生成。还有研究证明,外泌体通过体内和体外靶向转录因子c-MYB,将miR-130a从胃癌细胞导入到血管细胞,可以促进血管生成和肿瘤生长[17]。LIU等[18]报道,CD97高表达的胃癌组织来源的外泌体可发挥促血管生成作用而使胃癌细胞增殖能力提高20%。由此可见,外泌体可以通过多种途径促进肿瘤血管的生成,加速肿瘤生长。外泌体作为肿瘤血管生成的潜在生物标志物,有望成为抗肿瘤血管生成治疗的靶点。
中医药对恶性肿瘤的防治有独特的作用,通过抑制血管新生、调节免疫微环境等干预肿瘤的侵袭和转移[19],特别是针对肿瘤的复发,中医药具有一定的优势[20]。由于外泌体参与肿瘤的发生发展和侵袭与转移等诸多生理活动,而中医药防治肿瘤具有多环节、多途径、多靶点的特点,因此,中医药的作用机制可能通过干预外泌体介入肿瘤诊疗的各个环节[21]。中医研究着眼于脏腑功能的整体变化,而细胞和组织分子亦是一个动态演变的过程,外泌体产生异常的蛋白质、分子等靶基因,提示人体内部微环境的动态变化,从而出现不同的症状和体征。因此将外泌体与中医药相结合,未来可从新的微观角度揭示中医辨证论治肿瘤的机制[22-25]。ZYHT是课题组所在学科基于中医“从痰论治胃癌”的理论所创制的针对晚期胃癌的基础方,该方以百合为君,用之益胃扶正、化痰祛邪;制半夏为臣,降气和胃、燥湿化痰;佐以白花蛇舌草清热解毒利湿。前期临床观察发现,其联合化疗可明显改善胃癌患者生活质量,延长其生存期。本研究显示ZYHT可抑制胃癌细胞的侵袭和迁移,其机制与抗胃癌血管新生有关。本研究将ZYHT作用于肿瘤细胞,结果显示随着ZYHT药物剂量的增加,其调控外泌体抑制HUVECs的管样分化的作用增强,并且这种作用是随着外泌体浓度的增加而增强,提示调控肿瘤细胞外泌体分泌的确是ZYHT抗血管生成的内在分子机制之一。可见未来可以外泌体为切入点,更全面地研究中医药防治肿瘤的机制。
