益气化痰方调节高血压大鼠脑血管适应性功能及炎症小体的研究
2021-01-21袁冬梅张涨谭炜莫霄云林琳张清伟何贵新
袁冬梅, 张涨, 谭炜, 莫霄云, 林琳, 张清伟, 何贵新
(1.广西中医药大学,广西南宁 530001;2.广西中医药大学第一附属医院心血管二区,广西南宁 530023)
大脑是人体静息状态下耗氧量最大的器官,生理状态下“功能性充血”是脑循环关键适应性调节功能的重要方面。当某一脑区的需氧量上升,内皮细胞会释放一系列血管活性因子,协同作用引起血管舒张[1],使局部大脑血流(CBF)增加,是功能性充血的基础。高血压状态时,“功能性充血”会发生改变[2]。Kazama 等[3]在正常血压小鼠中发现,血管紧张素Ⅱ(AngⅡ)能明显抑制刺激诱导的感觉皮层CBF 上升幅度,说明短时间的血压升高就能改变“功能性充血”。Faraco等[4]的研究表明,内皮素1(ET-1)同样具有改变静息CBF 和“功能性充血”的效应。一氧化氮合酶(eNOS)表达减少以及一氧化氮(NO)含量降低也是高血压导致脑循环调节功能障碍的机制之一[5]。
我们的前期研究[6-7]发现,益气化痰方能显著改善自发高血压大鼠动脉内皮依赖性舒张功能,具有调节自发性高血压大鼠脑血管适应性功能的作用,而动脉局部的炎症反应是内皮功能障碍的重要基础。因此,我们推测益气化痰法可能具有改善脑循环关键调节功能的作用。本研究拟从“功能性充血”入手,评价益气化痰方是否能改善ET-1、AngⅡ造成的高血压大鼠模型的脑循环调节功能,并从炎症小体的激活方面探讨其可能的作用机制,现将研究结果报道如下。
1 材料与方法
1.1动物24 只SPF 级6 ~8 周龄雄性SD 大鼠,体质量200 ~250 g,购自广东省实验动物中心,动物质量合格证号:SYXK 桂2019-0001。本实验遵循广西中医药大学实验中心实验动物使用管理规定,并通过广西中医药大学伦理委员会批准。于广西中医药大学SPF级实验室完成实验,室内温度20 ~25 ℃,湿度60%~70%,喂食SPF 级大鼠饲料,喂饮无菌水。
1.2药物、试剂与仪器益气化痰方由黄芪30 g、茯苓15 g、法半夏10 g、天麻10 g、川芎15 g、炙甘草6 g 组成。上述药材均购自广西中医药大学第一附属医院中药房,按处方称取药材,加8 倍水,煎煮2 次,每次1 h,合并提取液,滤过备用。替米沙坦(德国勃林格殷格翰公司)。BQ123、ET-1、AngⅡ、乙酰胆碱(美国Sigma Aldrich 公司);蛋白酶抑制剂(瑞士Roche 公司);Nod 样受体热蛋白结构域相关蛋白3(NLRP3)抗体、白细胞介素(IL)-1β抗体(美国Cell Signaling Technology 公司);GAPDH抗体、辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG(美国Bioword 公司)。小动物呼吸机(美国Kent Scientific 公司);激光多普勒血流仪(瑞士Perimed AB 公司);Tanon-4100全自动数码凝胶图像分析系统(上海天能公司)。
1.3给药方法在手术开始前1 周,益气化痰方组(简称“QPR 组”)和血管紧张素受体拮抗剂(ARB)组的动物分别对应预先灌胃益气化痰方(给药量相当于饮片3.87 g·kg-1·d-1)和替米沙坦(给药浓度为0.3 mg·kg-1·d-1[8]),确保实验时能达到稳定的血药浓度。其余动物灌胃相同容量的磷酸盐缓冲液(PBS),设为PBS组。
1.4一般手术流程所有的操作都经过广西中医药大学实验动物伦理委员会讨论并通过。实验动物用体积分数5%异氟烷诱导麻醉,气管插管后,接小动物呼吸机人工通气,并将异氟烷减少至1.5% ~1.7%,维持麻醉至手术结束。加热板将肛温维持在37.5 ℃左右。分别穿刺股动脉、股静脉并留置套管,用以取血样、监测动脉血压、输注药物。所有大鼠静脉推注0.15 mL肝素(500 IU/mL)以防止鞘管内血液凝固堵塞。
1.5静息CBF和功能性充血反应大鼠经麻醉后固定,暴露颞骨并钻一个直径为1.5 mm 的孔,小心去除硬脑膜,暴露出大脑皮层表面。将激光多普勒血流仪探头对准大脑皮层表面并固定,经颞窗持续灌流林格氏液(0.2 mL/h),当平均动脉压(MAP)稳定时,测量基线CBF值。然后分别经静脉泵入ET-1(50 pmol·kg-1·min-1)、AngⅡ(0.25 μg·kg-1·min-1)制作2 种高血压模型,ET-1、AngⅡ均溶解于林格氏液中;单独泵入林格氏液(0.2 mL/h)的大鼠作为空白对照组。30 min 后,当MAP 达到稳态时,通过触须刺激(3 ~5 Hz,60 s)诱发功能性充血,再次测量CBF 值。用于观察BQ123 拮抗作用的大鼠,在静脉泵入ET-1 的同时,其颞窗灌流液应更换为含有BQ123(1 μmol/L)的林格氏液。
为了检测脑血管内皮依赖性的充血反应,将乙酰胆碱(10 μmol/L)经颞窗局部灌流至大脑皮层表面,记录CBF 的变化。乙酰胆碱可通过激活eNOS 释放NO 作用于血管平滑肌使血管扩张,被滴注到颞窗后,CBF上升,3 ~5 min达到稳态。通过对比药物刺激前后CBF 的变化幅度,分别检测脑血管内皮依赖性的充血反应。CBF的变化以相对于基线水平的升高百分比表示,根据如下公式计算:CBF 升高百分比(%)=(CBF最大值- CBF基线)/CBF基线×100%。
1.6蛋白免疫印迹(Western Blot)法检测主动脉炎症小体的表达末次给药后禁食24 h 后处死大鼠,迅速开胸,分离主动脉、剪下后放置在滤纸上吸干,放入EP 管中,于-80 ℃保存,用于后续的Western Blot 检测。将主动脉组织在PBS 中清洗,继而在含有1%蛋白酶抑制剂的RIPA 缓冲液中研磨(全程置于冰上),以12 000 r/min 4 ℃离心20 min后,将上清液转移至新的EP 管中,二喹啉甲酸(BCA)法测定蛋白质浓度。加入上样缓冲液,将等量的蛋白质溶液上样到预制的12%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)胶上,垂直电泳,再湿法电转至聚偏氟乙烯(PVDF)膜上。以含50 g/L 脱脂牛奶的TBST(Tris-buffered saline containing 0.1% Tween 20)溶液室温封闭2 h。分别在含有下列一抗的溶液中4 ℃孵育过夜:NLRP3 抗体(1∶500 稀释)、IL-1β 抗体(1∶500 稀释),GAPDH 抗体(1∶10 000 稀释)做为内参。分别用含有下列二抗的溶液室温下孵育1 h:辣根过氧化物酶标记山羊抗小鼠IgG(1∶2 000 稀释)或辣根过氧化物酶标记山羊抗兔IgG(1∶5 000 稀释)。最后将配制好的DAB 工作液滴加到印记膜上,孵育1 ~5 min 显色,用全自动数码凝胶图像分析系统成像。用ImageJ 软件进行条带灰度分析,所有的目标蛋白定量均用GAPDH 进行均一化。数据结果以PBS 组作为基准,其余2 组的目的蛋白表达量与其进行对比来表示。
1.7统计方法采用SPSS 13.0统计软件进行数据分析。所有数据以均数±标准差(±s)表示,如果符合正态分布,2 组间比较采用t 检验,否则即采用Mann-Whitney U 检验,多组间比较采用单因素方差分析(one-way ANOVA)检验。以P <0.05 为差异有统计学意义。
2 结果
2.1预先给药对大鼠静息CBF的影响为了观察预先给予益气化痰方、替米沙坦以及BQ123 对大鼠静息CBF 的影响,在固定好激光多普勒探头后,经颞窗持续灌流林格氏液(0.2 mL/h),BQ123 组的大鼠则灌流含BQ123 的林格氏液(1 μmol/L),当MAP稳定时,测量基线CBF值。
图1结果显示:预先给予益气化痰方灌胃、替米沙坦灌胃以及灌注BQ123的大鼠静息CBF分别为(128.0±7.7)p.u.、(126.7±9.7)p.u.、(127.0±8.1)p.u.,与灌胃PBS 的大鼠静息CBF(124.4 ± 9.1)p.u.比较,差异无统计学意义(P>0.05)。说明预先给药对于大鼠的静息CBF无明显影响。
2.2益气化痰方减轻AngⅡ对大鼠大脑皮层功能性充血的影响采用重复挠拨大鼠颞窗对侧的触须测量大脑皮层功能性充血。图2结果显示:泵入AngⅡ的大鼠大脑皮层CBF 上升幅度较泵入林格氏液的大鼠明显降低(P<0.05)。AngⅡ+QPR 组、AngⅡ+ARB 组的CBF 上升幅度高于单纯泵入AngⅡ组,差异有统计学意义(P<0.05)。说明益气化痰方和替米沙坦均能明显减轻AngⅡ对大鼠脑循环充血反应的影响。
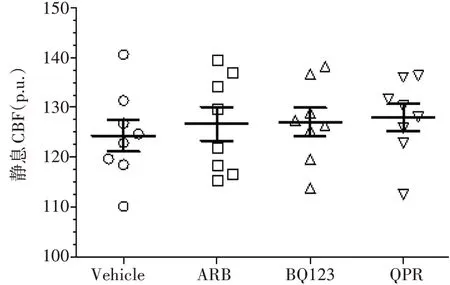
图1 预先给药对大鼠静息基线大脑血流(CBF)的影响(±s,每组8只)Figure 1 Effects of various pretreatment on rat baseline CBF(±s,8 rats in each group)
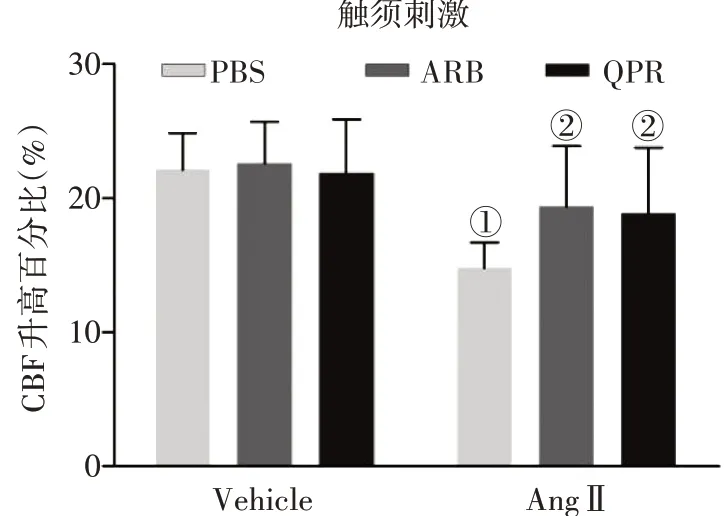
图2 益气化痰方(QPR)减轻AngⅡ对大鼠大脑皮层功能性充血的影响(±s,每组8只)Figure 2 QPR reduces the effects of AngⅡon functional hyperemia in rat cerebral cortex(±s,8 rats in each group)
2.3益气化痰方减轻ET-1对大鼠大脑皮层功能性充血的影响仍采用重复挠拨大鼠颞窗对侧的触须测量大脑皮层功能性充血。图3结果显示:泵入ET-1 的大鼠大脑皮层CBF 上升幅度较泵入林格氏液的大鼠明显降低(P<0.05)。ET-1 + QPR 组、ET-1 + BQ123 组的CBF 上升幅度高于单纯泵入ET-1 组,差异有统计学意义(P<0.05)。说明益气化痰方和BQ123 均能明显减轻ET-1 对大鼠大脑皮层充血反应的影响。
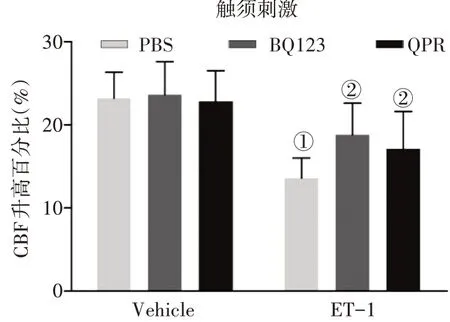
图3 益气化痰方(QPR)减轻ET-1对大鼠大脑皮层功能性充血的影响(±s,每组8只)Figure 3 QPR reduces the effects of ET-1 on functional hyperemia in rat cerebral cortex(±s,8 rats in each group)
2.4各组大鼠脑血管内皮依赖性充血反应情况的比较将乙酰胆碱(10 μmol/L)经颞窗局部灌流至大脑皮层表面,记录CBF 的变化,检测脑血管内皮依赖性的充血反应。预先给予益气化痰方、替米沙坦和BQ123均不影响PBS组的CBF上升幅度。
图4 结果显示:泵入Ang Ⅱ的大鼠大脑皮层CBF 上升幅度较泵入林格氏液的大鼠明显降低(P<0.05)。AngⅡ+ QPR 组、AngⅡ+ ARB 组的CBF 上升幅度高于单纯泵入AngⅡ组,差异有统计学意义(P<0.05)。泵入ET-1的大鼠的CBF上升幅度较泵入林格氏液的大鼠明显降低(P<0.05)。ET-1+QPR 组、ET-1+BQ123 组的CBF 上升幅度高于单纯泵入ET-1 组,差异有统计学意义(P<0.05 )。
说明益气化痰方均能明显减轻AngⅡ和ET-1对大鼠脑血管内皮依赖性充血反应的影响。
2.5各组大鼠主动脉NLRP3和IL-1β的表达水平比较NLRP3 是炎症小体的重要组成部分,炎症小体通过激活Caspase-1 进而切割IL-1β 前体,生成剪切型IL-1β,即为成熟的促炎因子IL-1β。通过检测各组大鼠主动脉组织中的NLRP3 和剪切型IL-1β 蛋白的表达,图5 结果显示:与PBS 组比较,灌服替米沙坦和益气化痰方大鼠主动脉的NLRP3 和剪切型IL-1β 蛋白的表达水平均明显下调,差异有统计学意义(P<0.05)。说明预先灌服益气化痰方和替米沙坦均能抑制大鼠主动脉组织中NLRP3和剪切型IL-1β的表达。
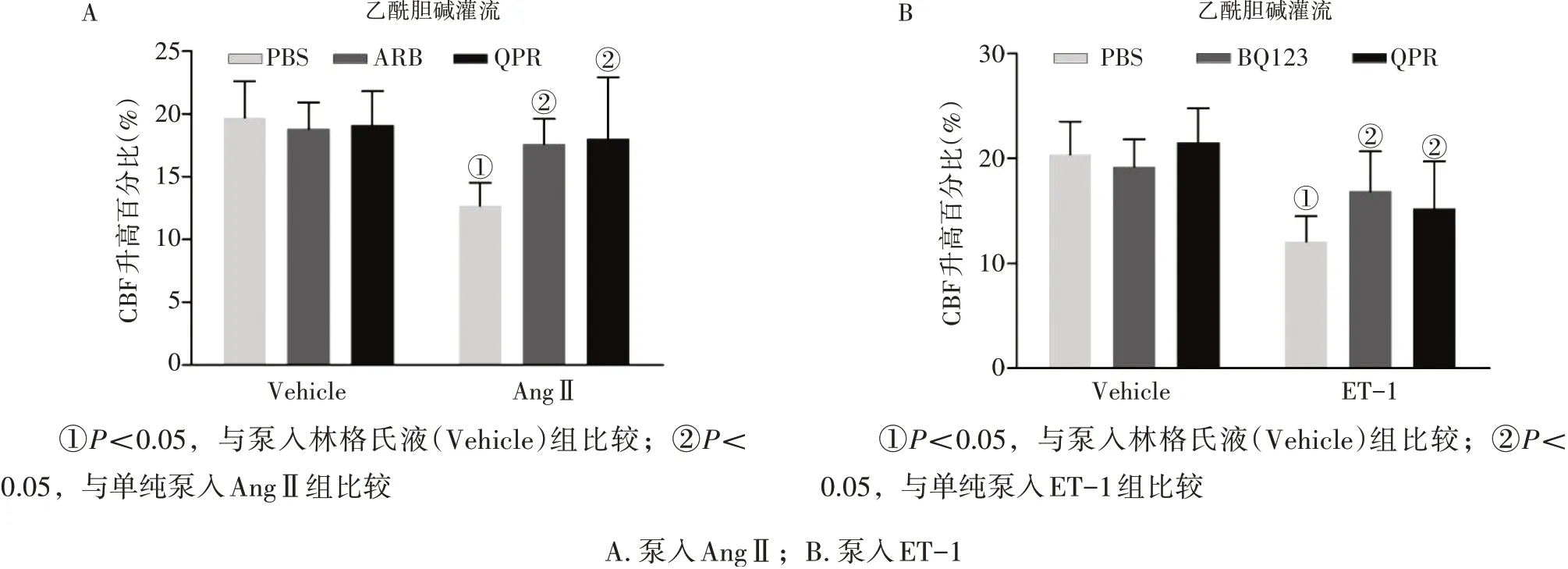
图4 各组大鼠脑血管内皮依赖性充血反应情况比较(±s,每组8只)Figure 4 Comparison of endothelial dependent hyperemia response in cerebral vessels of various groups(±s,8 rats in each group)
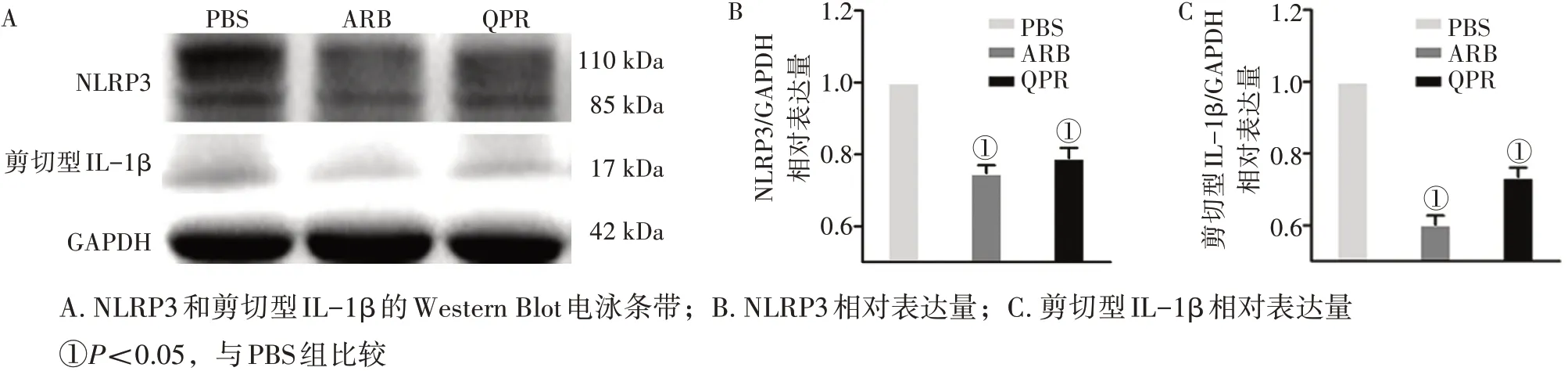
图5 各组大鼠主动脉NLRP3和IL-1β的表达水平比较(±s,每组8只)Figure 5 Comparison of the expression levels of NLRP3 and IL-1β in aorta tissue of various groups(±s,8 rats in each group)
3 讨论
本研究主要观察了益气化痰方对高血压大鼠模型的脑血管适应性调节功能的影响。分别泵入Ang Ⅱ和ET-1 造成2 种高血压模型后,通过重复挠拨大鼠颞窗对侧的触须,以及经颞窗局部灌流乙酰胆碱溶液,检测大脑皮层的充血反应。结果显示,泵入AngⅡ或ET-1 后,大鼠大脑皮层的CBF 上升幅度明显减小,预先1 周给予益气化痰方能显著减轻Ang Ⅱ和ET-1 对大鼠大脑皮层充血反应的影响。
功能性充血反应是脑循环关键适应性功能的重要方面。脑组织的血液供应并不是均等的,不同脑区的能量需求不同,血液供应也有差别。当某一脑区的神经元功能活跃时,需氧量上升,此时局部CBF 就会增加,这就是“功能性充血”。神经元活动增加时,脑动脉内皮细胞通过释放血管舒张因子(如NO)和收缩因子(如内皮素)对血管张力产生影响[9-10]。内皮细胞产生的血管活性物质参与调节静息状态的血管张力,也参与协调脑实质小动脉和脑膜下动脉之间的血管舒缩反应,使局部CBF增加。
高血压时,功能性充血也会发生改变。在长期高血压的患者中,通过刺激某一脑区的活动而诱发的CBF 增加,其上升幅度明显低于正常血压患者[11-12]。经静脉全身给予AngⅡ造成血压升高,此时,刺激胡须诱导的感觉皮层CBF 上升幅度受到明显抑制[3],说明AngⅡ导致“功能性充血”的改变发生在血管重构之前。ET-1 也同样具有改变静息CBF 和“功能性充血”的效应[4]。
预先灌胃益气化痰方能显著改善AngⅡ和ET-1对大鼠大脑皮层功能性充血反应的影响,其升高幅度与替米沙坦和BQ123类似。替米沙坦和BQ123分别是AngⅡ受体和ET-1 受体的特异性拮抗剂,既往的研究发现,替米沙坦[8]和BQ123[4]能拮抗AngⅡ和ET-1 对功能性充血反应的影响,说明益气化痰方也具有拮抗Ang Ⅱ或ET-1 对脑血管调节功能影响的作用。
炎性小体(inflammasome)是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物。炎症小体能够识别病原相关分子模式(PAMPs)或者宿主来源的危险信号分子(DAMPs),招募和激活促炎症蛋白酶Caspase-1。活化Caspase-1 切割IL-1β 和IL-18的前体,产生成熟的炎症因子。
直到最近,研究者才发现NLRP3 炎症小体在高血压中的重要作用。在“两肾一夹”高血压模型中,敲除NLRP3 或ASC 能阻止血压升高、降低肾素水平[13]。在ATP 诱导的高血压模型中,Caspase-1 抑制剂WEHD 也可降低血压、减少水钠潴留,降低炎症因子IL-1β 水平[14]。超氧离子清除实验表明,炎症小体的激活与氧化应激反应有关[15],激活的炎症小体能通过IL-1β 触发固有免疫反应导致细胞凋亡,最终引起内皮功能不全[16]。这些结果说明,炎症小体激活可能是高血压的发展过程中动脉内皮功能损害的重要机制,炎症小体可作为高血压治疗的新靶点。本研究通过分析大鼠主动脉组织中NLRP3 和剪切型IL-1β 的表达情况,发现预先灌服益气化痰方能抑制NLRP3 和剪切型IL-1β的表达,提示益气化痰方可能是通过影响炎症小体的激活,进而减轻动脉壁的炎症反应,最终改善动脉的内皮依赖性舒张功能。
中医学认为眩晕的病位在“脑”。痰浊在眩晕的发病过程中起关键作用。临床上单纯以痰浊为病因的患者少见,气虚与痰浊常互为因果,形成恶性循环,老年患者气虚痰浊并见者多见。我们既往的研究[18]发现气虚痰浊型患者的脑血管调节功能较差,据此我们认为,气虚痰浊是高血压导致脑循环功能障碍的关键病机,病变的主要脏腑为脑。益气化痰方是以气虚痰浊证为证候基础配伍组方的,由黄芪、茯苓、法半夏、天麻、川芎组成。方中:重用黄芪补脾益气,脾胃健则清阳升,痰湿自去,为君药;茯苓、半夏健脾祛湿,取“小半夏加茯苓汤”之意,并可加强黄芪补气之力,为臣药;天麻祛风定眩,川芎引药上行,共为佐使药。诸药共用,不仅中焦痰湿得化,还可使药力上行,直达脑部,共奏健脾益气、化痰定眩之功。本研究通过实验证实,益气化痰方具有改善高血压大鼠模型的脑循环调节功能的作用,可与其理论基础相互印证。
综上所述,本研究从大脑皮层的功能性充血入手,评价了益气化痰方对改善高血压大鼠模型脑循环调节功能的影响。研究结果提示,益气化痰方能部分改善高血压大鼠的脑循环适应性调节功能,其作用机制与阻断炎症小体激活有关。
