达托霉素生物合成过程的调控机制研究进展
2021-01-21方教乐吕中原孙晨番刘一帆徐炜锋毛旭明李永泉
方教乐 ,吕中原 ,孙晨番 ,刘一帆 ,徐炜锋 ,毛旭明 ,李永泉
(1 浙江大学药物生物技术研究所,浙江 杭州 310058; 2 浙江省微生物生化与代谢工程重点实验室,浙江 杭州310058)

20 世纪70 年代青霉素的发现,以及之后不断研发出来的抗生素,成为对付病菌感染的有效武器;但抗生素的过度使用,导致了致病菌特别是革兰阳性菌产生耐药性,形势日益严峻。且现阶段新药研发越来越难,一旦感染“超级细菌”,或将无药可治,急需更新更有效的抗感染药物。

图1 达托霉素化学结构(a)和达托霉素的合成基因簇(b)Fig.1 Structural formula of daptomycin(a)and biosynthetic gene clusters of daptomycin(b)
达托霉素是继万古霉素之后发现的新型抗生素[图1(a)],其化学结构含多个非蛋白氨基酸[1-2],系通过非核糖体肽(NRPS)途径生物合成的一种环脂肽类药物。达托霉素最初由美国礼来公司从玫瑰孢链霉菌的发酵液中分离提取获得,在2003 年和2006 年分别被美国和欧盟批准为用于治疗由革兰阳性菌包括耐甲氧西林金黄色葡萄球菌(MRSA)引起皮肤结构感染和菌血症[3-4],目前达托霉素国际市场年销售已达20 亿美元。达托霉素存在一个特殊的EF-手性模块,与Ca2+结合后,插入到细菌的磷脂双分子层并寡聚化,在细胞膜上形成大孔隙引发钾离子外流,导致细胞死亡[5-6]。其特殊的结构与作用机制,减少了与其他抗生素产生交叉耐药的概率,因此在临床上具有较高的应用价值,是治疗多重耐药革兰阳性细菌引起的重症感染的高端微生物药物。
然而,达托霉素生产菌发酵水平一直比较低,生产成本高,同时发酵产物存在多种同系物杂质影响药品质量。Baltz 等[2]对达托霉素生物合成相关机制[图1(b)]进行了系统研究,对其合成途径及调控通路的认识也逐然清晰。本文较为全面地总结了国内外有关达托霉素合成过程的调控机制研究,包括调控蛋白的挖掘、级联调控途径、脂酰前体合成途径调控、GBL 信号途径与磷酸双组分系统协同调控机制等,揭示了次级代谢调控网络的复杂性,并阐述了通过调控途径重构达托霉素调控通路实现生产菌优质高产的策略。
1 链霉菌次级代谢调控因子的挖掘
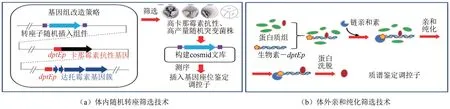
图2 体内随机转座与体外亲和纯化的调控元件筛选技术Fig.2 Workflow for identification of regulatory elements by random transposition and affinity purification
原核生物的转录调控因子大约有50 余种[7],分为初级代谢相关的转录因子和次级代谢相关的转录调控因子。链霉菌次级代谢调控网络是微生物药物合成过程的管理系统[8],由全局调控、多效调控、途径特异性调控等蛋白组成,全局调控和特异性调控蛋白往往已知,因此挖掘多效调控因子是解析调控网络的关键。
Luo 等[9]构建了卡那霉素抗性报告系统结合Himar1 转座子介导的基因组随机突变筛选调控蛋白技术,同时建立了利用启动子DNA与调控蛋白互作钓取多个调控蛋白的体外亲和纯化技术(图2);以达托霉素合成基因簇唯一启动子dptEp为诱饵,利用体外亲和纯化和转座突变技术,筛选和鉴定到 调 控 蛋 白 PhaR (MerR 家 族 )[9]、 AtrA[10]、DepR1(TetR家族)[11]和DepR2(ArsR)家族[12]。
TetR 家族转录调节因子是最常见的原核转录调控因子之一,其名来源于四环素抗性阻遏蛋白(Tet repressor,TetR),一般参与抗生素合成、转运以及环境应答等过程[13-16]。TetR 家族蛋白通常可与自身启动子结合,且结合位点具有高度序列相似性[15]。Yuan 等[11]研究发现敲除depR1完全不生产达托霉素,而depR1高表达菌株达托霉素产量高于野生型;depR1在玫瑰孢链霉菌形态发育过程中发挥重要作用,depR1敲除株出现孢子缺陷型,回补菌株孢子形态恢复正常,depR1高表达菌株形态发育较野生型提前。
大多数原核生物AsrR 蛋白家族调控因子的主要功能是感应环境中金属离子浓度和细菌致病 性[17-18]。 Mao 等[12]发现 DepR2 可以 与dptEp直接结合,并通过直接抑制达托霉素合成基因簇的转录从而负调控达托霉素的合成;depR2缺失突变株的达托霉素发酵水平显著增加,特别是发酵4 d 时,depR2缺失株的达托霉素发酵水平达到50.8 mg/L,比野生型高2.5 倍;depR2回补菌株发酵水平和野生型相近,同时该基因簇合成的3 种同系物A21978C1-3在depR2缺失株的发酵水平均远高于野生型[19]。
MerR 家族调控因子一般参与环境因子应答、重金属胁迫以及抗生素合成[20-22]。Luo 等[9]通过CRⅠSPR/Cas9 构建phaR缺失菌株,发现PhaR蛋白直接负调控达托霉素生物合成途径,缺失株中dptE的转录水平较野生型提升了2.68 倍。研究发现phaR也具有自身正调控功能,对形态发育的试验表明,phaR缺失菌株在平板上的菌丝形态发育较野生型及回补菌株有明显的延迟。由此可见,PhaR 是一个多效调控因子。
2 转录调控因子
链霉菌次级代谢的转录调控因子,主要参与调控簇内途径特异性调控基因或直接调控合成基因转录水平,进而调控生产菌的形态分化和药物的生物合成[7]。玫瑰孢链霉菌中达托霉素合成基因簇附近发现了编码3 个不同家族的转录调控因子dptR1、dptR2、dptR3,它们分别编码LuxR、DeoR、MarR 家族蛋白,并推测可能参与达托霉素生物合成的途径特异性调控[23]。
Jin 等[24]通过同源重组方式对dptR1进行了敲除,发现dptR1对达托霉素的合成没有太大影响。dptR2编码的调控蛋白属于DeoR 家族,大多数DeoR 家族调控形态发育和抗生素生物合成[25-27]。Wang 等[28]发现dptR2缺失突变株不产达托霉素,但未发现调控靶点。但是DptR2 可以直接正调控自身的转录;推测DptR2调控达托霉素合成的方式可能是通过影响葡萄糖的代谢过程,从而调控达托霉素合成的氨基酸前体供应。
dptR3是一个属于MarR 家族的多效调控基因,该家族调控因子大多数参与耐药性、应激反应、毒性以及芳香族化合物分解代谢,且其转录调控因子的结合位点一般都具有回文序列[29-31]。迄今为止,细菌和古细菌基因组中发现超过 12 000 种类似 MarR 家族的蛋白[28],但在链霉菌中只有少数被报道[32-33]。Zhang 等[34]研究发现dptR3不能与达托霉素合成基因簇上的启动子结合,缺失株达托霉素产量降低,并出现气生菌丝生长、孢子成熟延迟的表型;DptR3 直接正调控自身转录并间接正调控达托霉素的生物合成,同时直接负调控与其转录方向相反的上游基因dptR16(编码ABC 转运蛋白ATP 结合蛋白);进一步研究表明,DptR3 的主要靶基因dptR16对达托霉素的生物合成有积极的正效应。
放线菌中存在两类特有的转录调控因子,分别是 SARP 和 WhiB 家族[7],其中 WhiB 家族的调控因子与链霉菌形态分化与抗生素合成相关[35]。Huang 等[36]发现 WhiB 家族转录调控因子 WblA是一个多效调控因子,wblA缺失株孢子发育被阻断,同时达托霉素产量有51%的提升,且关键合成酶dptE及关键调控基因atrA、dptR2和dptR3的表达量均显著上升;但没有直接证据表明WblA 可直接调控上述基因表达,推测WblA可能通过参与其他细胞进程影响达托霉素生物合成相关通路。
3 GBL 信号级联调控通路
γ-丁酮内酯(γ-butyrolactone)[37]是一种链霉菌中普遍存在的信号分子,参与调控以抗生素为代表的次级代谢产物生物合成与细菌形态发育,可分为A 因子(A-factor)型、维基尼丁烯羟酸内酯(virginiae butanolide,ⅤB)型和ⅠM-2型等三类[38-40],统称为GBL 信号分子。灰色链霉菌的A 因子信号调控途径研究比较清晰,Ohnishi 等[41]发现其在链霉菌形态分化及次级代谢调控中均扮演着重要角色。菌体生长阶段,A因子浓度低,A 因子信号受体蛋白ArpA 结合于中心调控蛋白AdpA 的启动子区域,抑制其转录发生;当菌体达到一定密度,A 因子大量积累,与ArpA 蛋白结合并使后者从启动子区释放,解除对adpA基因的阻遏作用,AdpA 的大量翻译推动了次级代谢过程的启动。
玫瑰孢链霉菌中,A 因子信号通路参与调控达托霉素的合成和形态分化过程。敲除受体蛋白基因arpA,达托霉素产量比野生型提高了2.5倍,且菌丝发育提前;敲除adpA的突变株不再产生达托霉素及色素,且菌丝发育不全,不再产生孢子。Mao 等[10]通过转座子随机突变筛选得A 因子通路调控的下游受体蛋白AtrA,其受AdpA 激活转录并被自身蛋白反馈调控,且AtrA参与正调控下游达托霉素合成基因簇转录进程,对达托霉素合成有正调控作用。综合上述研究结果,Mao 等[10]提出了玫瑰孢链霉菌达托霉素生物合成的级联调控模式(图3)。
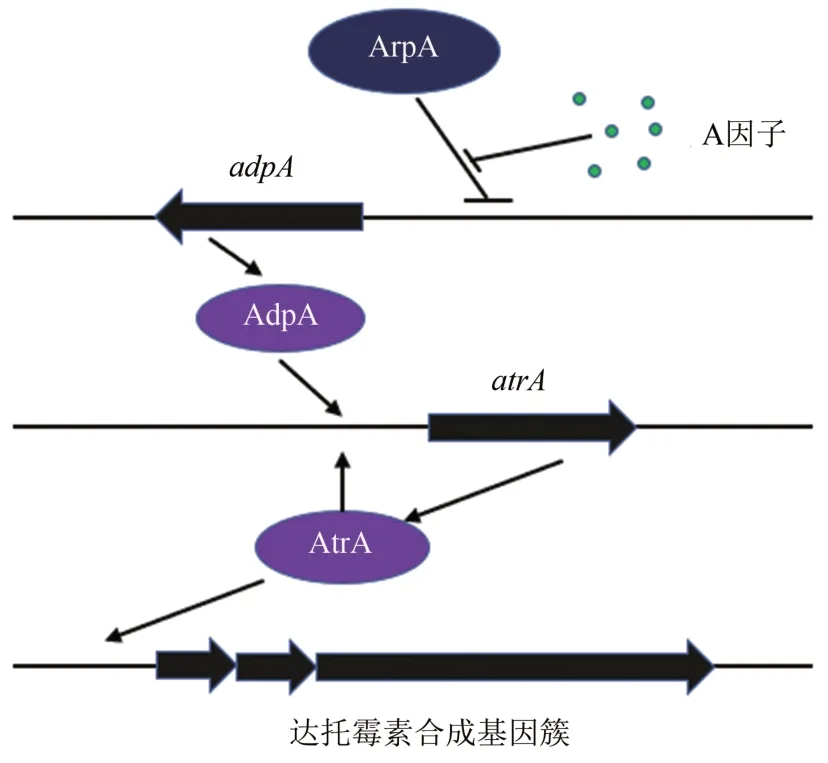
图3 达托霉素A因子级联调控通路Fig.3 The model of the regulation of A-factor regulatory cascade on daptomycin biosynthesis
4 磷酸双组分系统
链霉菌中,双组分系统是一类十分重要的全局调控系统[42],一般包括激酶和应答调控蛋白,前者接受各种环境信号后激活后者,后者将信号传递到下游受调控基因,比较典型的双组分系统有 PhoR-PhoP[43]、AbsA1-AbsA2[44]、AfsQ1-AfsQ2[45]、AfsK-AfsR[46]。玫瑰孢链霉菌中,磷酸双组分系统PhoR-PhoP 能够感应环境中磷酸盐浓度,通过胞内信号转导传递信号最终影响达托霉素合成[47]。Zheng 等[48]研究发现内磷酸双组分系统与A 因子信号途径存在交互调控(图4),PhoP 与AdpA 均能与atrA启动子区域进行结合,从而产生竞争效应。低磷酸盐浓度下,PhoRPhoP 被激活并发挥主要作用,从而提高下游受调控基因表达,进而提高达托霉素产量;高浓度下该系统则受到抑制。由此提出了A 因子级联调控通路与磷酸双组分系统交叉调控的模型。由于磷营养代谢关联了微生物发酵过程的碳源和氮源的营养代谢,因此通过应答磷酸双组分系统和A 因子级联调控通路,可进行针对性的发酵培养基与发酵条件优化,从而克服传统的发酵工艺优化的盲目性。
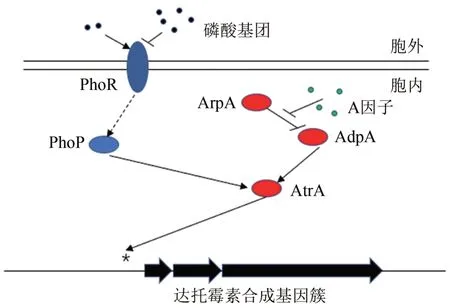
图4 GBL信号通路与磷酸双组分系统交叉调控模型Fig.4 Crosstalk of A-factor regulatory cascade and twocomponent system PhoRP
5 脂酰前体合成途径
达托霉素合成过程中脂酰基前体的结构多样性是产生同系物杂质的根源,达托霉素合成起始于一个脂酰基转移蛋白,而脂酰基侧链不同则导致非目标产物的产生[19]。达托霉素的同系物A21978C1-3合成前体均来自支链脂肪酸,其产量远超达托霉素[49],严重影响了目标产物的质量。
研究表明,bkdR是支链氨基酸转氨酶和支链α-酮酸脱氢酶复合体(BCDH complex)的合成基因簇bkdA1B1C1的簇内转录调控激活因子,其对自身有负调控作用,且加入达托霉素可以特异性消除BkdR 对自身启动子的结合,从而消除该反馈作用。Luo 等[50]研究发现,敲除bkdR不仅会消除同系物A21978C1-3,同时达托霉素也会消失,回补菌株产量部分回复,而高表达菌株则不会表现出高产;bkdR缺失株同时表现出气生菌丝发育提前与色素产生滞后现象,BkdR蛋白可响应氨基酸代谢、孢子形态发育以及菌丝的形态分化[51],说明bkdR是一个全局调控因子(图5)。因此,解析脂酰前体支链脂肪酸合成途径,可对同系物合成途径进行定向改造,有助于达托霉素的优质高产和后续纯化。

图5 BkdR对支链脂肪酸合成通路的调控模型Fig.5 Regulatory of BkdR on the production of branchedchain fatty acid
6 总结与应用
微生物药物的生物合成不仅受控于全局调控、多效调控、途径特异性调控等组成的复杂次级代谢调控网络[8],也受控于糖代谢、脂肪酸合成、氨基酸合成等初级代谢相关通路交互网络。在达托霉素的生物合成过程中,我们得以一窥微生物次级代谢调控网络的冰山一角,其中不仅有磷酸双组分与A 因子信号途径的交叉调控作用,也有其他多效调控因子的级联调控,还包括脂酰基前体相关合成途径的簇内调控,整个系统在微生物体内和谐有序运行。通过剖析复杂的次级代谢调控网络,可以明晰生产菌遗传改造的关键靶点,为药物高产改造策略提供切入点。同时,针对调控途径的关键蛋白对发酵环境的响应,可精准地进行发酵工艺优化,从而克服传统工艺研究的盲目性。
基于上述机制研究,浙江大学李永泉课题组通过组合敲除arpA、phaR、depR2和高表达depR1、重构A 因子级联调控通路ArpA-AdpAAtrA,获得的高产菌50 L 罐发酵水平达0.93 g/L;通过调控脂酰前体合成途径,敲除其基因簇bkdA1B1C1,消除了同系物杂质A21978C1-3合成;基于合成生物体系对环境应答构建了优质高产发酵工艺,结合流加补料癸酸,达托霉素10 t罐发酵水平达2.23 g/L,并在杭州中美华东制药有限公司实现了产业化,该公司是国内首家获批新药证书的支撑企业,填补了我国重症感染临床用药的空白,阻碍了国际原研美国Cubist制药公司进军我国临床用药市场。
7 展 望
抗生素的优质高产是一个系统性工程,不仅要考虑到菌种本身的遗传改造水平,也应关注环境因子的相关作用,以及发酵过程中的碳/氮源比例及成本。本文总结的一部分,不过是微生物来源的抗生素工业化优质高产过程中的一小部分工作,后续工作路阻且长。毕竟从实验室走进工厂,是梦想照进现实的过程,中间的每一步,都需缜密的思考及不懈的努力。
本文聚焦于达托霉素生物合成过程的调控机制研究,从多个层次的转录调控、级联调控通路、多信号途径的协同调控,探究达托霉素生物合成的关键调控节点。同时通过解析同系物杂质合成调控机制,消减旁路代谢产物以减少杂质合成,解除达托霉素合成的关键限制因素,为实现达托霉素高效生物合成提供理论依据。
纵观已有达托霉素相关调控研究报道,主要集中于基因转录水平的机制研究,着眼点在于次级代谢的信号通路的关键基因。但真正发挥调控作用的是调控通路,如玫瑰孢链霉菌初级代谢过程不到50 h,而其达托霉素的生物合成过程历时200 h 左右,正是调控通路支撑了如此漫长的次级代谢生物合成过程。在如此漫长的发酵过程中,不管是单个链霉菌还是整个种群,其生长形态及代谢水平均有着显著的差异,远非某一个基因或某一条调控通路的表达水平的改变所能解释。生命是动态而复杂的,而抗生素的合成只不过是细菌代谢过程中的一个重要的副产物。因此,我们不仅要关注基因转录水平,更需对关键蛋白全生命过程进行追踪分析,揭示其时序调控机制。
另外,以往的很多研究表明,很多关键基因的遗传改造往往牵一发而动全身,并且很多高产改造也往往得不到更佳的改造效果。这是因为细菌的生理代谢进程如同一个黑盒子,我们无法看到其中的关联性与复杂度,很容易顾此失彼。随着科技的不断发展,新的技术不断涌现,我们得以从更加微观的空间尺度及更加细密的时间尺度上一窥细胞中正在发生的生理进程,这有助于我们摆脱传统研究中盲人摸象的困境,从而更好地进行创新和改革。
因此,对调控通路中关键调控蛋白的鲁棒性需要进一步探究,包括调控蛋白的修饰与降解机制,以及从动力学角度对级联调控通路进行解剖。从基因转录水平转向蛋白水平,是放线菌次级代谢调控领域研究全新的角度,这样才能更加深入理解达托霉素生物合成过程的调控网络复杂性。在前期的研究基础之上,借助大数据的挖掘,构建一个囊括整个次级代谢通路的调控网络,实时跟踪每个节点蛋白的表达水平,从而最终形成一个从基因转录到次级代谢生物合成的动态蛋白组学图谱网络,由点及面,深入直观地体现放线菌中复杂而动态的生理代谢进程,通过计算机技术进行辅助模拟设计,挖掘隐藏的关键节点,探索最佳组合策略,从而为优质高产改造提供更为精准的工具。
