新型吡啶氮唑氮芥化合物与线粒体的作用及其抗肿瘤活性
2021-01-20曹守莹
曹守莹
(蚌埠医学院 公共基础学院,安徽 蚌埠 233030)
0 引言
线粒体是真核细胞中的主要细胞器之一,细胞内多种代谢活动均与线粒体相关,如糖代谢、脂代谢以及生物氧化过程。真核细胞中的能源物质ATP的生成也主要在线粒体里进行,ATP产生后可以为各种生命活动提供大部分的能量[1]。作为半自主细胞器,线粒体具有自身特有的蛋白质合成机制和自主复制的线粒体DNA。研究表明,线粒体DNA属于共价闭合环状分子,与真核生物基因组DNA相比,线粒体DNA具有更高的遗传突变率,原因在于其为无组蛋白保护的裸露DNA且线粒体中缺乏DNA损伤修复体系[2]。近30年来的研究证实,有多达上百种人类疾病的发生发展与线粒体突变密切相关,从而使得对线粒体的研究受到越来越多的科研人员的重视,兴起的线粒体生物医学研究热潮一直持续到现在[3]。
线粒体作为细胞能量代谢的中心,参与多种生物反应过程与细胞凋亡,如生物氧化过程中呼吸链过度产生及释放氧自由基 (reactive oxygen species, ROS),线粒体膜的通透性发生改变(如通透性转运孔异常开放),线粒体跨膜电位水平变化,Ca2+外流,细胞色素C(Cytochrome C)释放到胞浆等[4]。随着对线粒体功能研究的深入,发现多种抗肿瘤药物的作用靶点位于线粒体的膜结构或线粒体中的组成呼吸链酶复合物上,药物主要通过影响细胞线粒体呼吸链相关酶的活性,继而改变细胞膜的通透性来发生作用[5]。
在众多靶向线粒体抗肿瘤药物中,氮芥和氮唑类化合物得到了人们的广泛关注。氮芥是一类含有β-氯乙胺结构的化合物,具有抗瘤谱广、疗效显著、合成简便及成本低廉等诸多优点,在多种恶性肿瘤的临床治疗中扮演着重要角色[6]。氮唑类化合物的合成和应用也是目前化学药物合成领域的一个热点,其中1,2,3-三唑是1,2,4-三唑的生物电子等排体,常存在于临床常用的一些抗感染药物中[7]。
本研究设计并合成了一种新型吡啶氮唑氮芥化合物N,N'-(1,1'-(吡啶-2,6-二取代双(亚甲基))双(1H-1,2,3-三唑-4,1-二基))双(亚甲基)双(2-氯-N-(2-氯乙基)乙胺),采用1H NMR和13C NMR现代波谱手段确证了新化合物的结构,应用MTT试剂盒检测了该新型吡啶氮唑氮芥化合物对癌细胞系A549的抑制活性,探究了该化合物的抗肿瘤作用机制。
1 实验材料与方法
1.1 试剂与仪器
1)主要试剂: RPMI-1640基础培养基;南美胎牛血清;青霉素-链霉素溶液(100X);胰酶细胞消化液(0.25%胰酶);MTT细胞增殖及细胞毒性检测试剂盒;Annexin V-FITC/PI凋亡检测试剂盒;JC-1线粒体膜电位检测试剂盒;活性氧检测试剂盒(DCFH-DA);磷酸缓冲盐溶液PBS;兔抗Bax抗体;兔抗Bcl-2抗体;兔抗GAPDH抗体;SDS-PAGE 凝胶配制试剂盒。
2)主要仪器设备:细胞培养箱(HERA cell150i,Thermo);倒置荧光显微镜(Axiovert 40,德国Zeiss公司);流式细胞仪(FACS Calibur,Becton Dickinson and Company);酶标仪(Epoch2,BioTek);Western电泳仪(PowerPac系列,Bio-Rad);转膜仪(Trans-Blot Turbo,Bio-Rad)。
1.2 细胞培养
将人肺上皮细胞永久细胞株(A549)(购自中国科学院细胞库)在RPMI-1640培养基(含10%胎牛血清、1%青霉素和链霉素)、37 ℃、CO2含量为5%的培养箱中培养。每3 d传代1次,每次按照1∶3的比例胰酶消化、传代[8]。
1.3 实验方法
1.3.1氮唑氮芥类化合物的合成
1)中间体2,6-二叠氮甲基吡啶的合成。室温搅拌下向2,6-二氯甲基吡啶(1.76 g,10 mmol)和丙酮水溶液(20 mL,1∶1,V丙酮∶V水)混合物中加入过量的叠氮化钠(1.43 g,22 mmol),加热,使混合反应物升温至50 ℃,过夜反应。反应液减压蒸馏去除溶剂,将残留物用30 mL乙酸乙酯萃取3次,合并有机相,用无水硫酸钠干燥,减压蒸馏得到无色液体。需注意的是,减压去除溶剂时叠氮化合物绝不能蒸干。
2)中间体N,N-二(2-氯乙基)-2-丙炔-1-胺的合成。在15 mL丙酮、二(2-氯乙基)胺(1.95 g,10 mmol)和碳酸钾(1.6 g,11.5 mmol)的混合溶液里,室温搅拌下加入3-溴-1-丙炔(1.9 mL,25 mmol)。反应1 h后,加入四丁基碘化铵(5.0 mg),继续升温至40 ℃,反应10~12 h。旋蒸去除溶剂,再加入30 mL水,用氯仿萃取3次。有机层用Na2SO4干燥,减压蒸馏去氯仿得到黄色液体粗品。
3)目标化合物N,N'-(1,1'-(吡啶-2,6-二取代双(亚甲基))双(1H-1,2,3-三唑-4,1-二基))双(亚甲基)双(2-氯-N-(2-氯乙基)乙胺)的合成。在N,N-二(2-氯乙基)-2-丙炔-1-胺(1.8 g,10 mmol)和t-BuOH/H2O的混合液(15 mL,1∶1,V∶V)中,加入2,6-二叠氮甲基吡啶(0.76 g,4 mmol),再加入抗坏血酸钠(0.2 equiv)和五水硫酸铜(0.1 equiv)。将反应物溶液加热到50 ℃并进行搅拌。TLC检测原料点消失后,减压去除溶剂,残余物倒入水中,然后用30 mL乙酸乙酯萃取3次,合并有机相,用无水硫酸钠干燥,减压蒸馏得到粗品。残余物经硅胶柱色谱(展开剂为V氯仿∶V甲醇,5∶1)分离,得到目标产物棕色液体,收率为46%。1H NMR (CDCl3,300 MHz) δ:7.74(s,1H,triazole 5-H),7.61~7.56(t,1H,J=15 Hz,Py 4-H),7.41~7.43(d,2H,J=9.0 Hz,Py 3-H,5-H),5.58(s,4H,Py CH2N),3.75(s,4H,CH2N),2.93~2.97(t,8H,J=12 Hz,NCH2);13C NMR(CDCl3,75 MHz) δ:158.2(pyridine 2-C),137.5(thienyl 4-C),121.0(thienyl 3-C),60.1(pyridine-CH2),56.3(NCH2),42.1(CH2Cl)ppm。
1.3.2 MTT法检测细胞存活率
取对数生长期的A549细胞(即细胞生长至培养瓶/皿底为70%~80%),使用血球计数板计数,然后使用细胞培养液将细胞浓度调整为1×105个/mL,按照100 μL/孔的量将细胞接种于96孔细胞培养板中,将96孔细胞培养板放在CO2含量为5%的细胞培养箱中培养。次日,用微量移液器吸去每孔中的上清,1×PBS清洗细胞3次,向孔板中分别加入浓度为0,0.5,1.0,2.0,4.0 μg/mL的新型吡啶氮唑氮芥化合物溶液100 μL,继续培养24 h。然后,向每孔中均加入浓度为5 mg/mL 的MTT 试剂10 μL,放置于CO2含量为5%的细胞培养箱中继续避光培养4 h。离心10 min(1 000 r/min),弃上清,按照100 μL/孔的量向96孔板中加入DMSO,置于水平摇床中震荡10 min,最后在酶标仪上使用490 nm波长测各孔的吸光度。每个浓度组均设6个复孔。根据试剂盒说明书上的公式计算细胞相对存活率。
1.3.3流式细胞术检测AnnexinV-FITC/PI双染后的细胞凋亡情况
取处于对数生长期的A549细胞,使用血球计数板进行细胞计数,并用细胞培养液将细胞浓度调整到1×105个/mL,按照2 mL/孔的量将细胞接种于6孔板,并置于CO2含量为5%的细胞培养箱中。待细胞贴壁长至70%~80%时,弃去上清,1×PBS洗细胞3次,分别向各孔中加入2 mL浓度为0,3.25 μg/mL的新型吡啶氮唑氮芥化合物溶液。置于37 ℃,CO2含量为5%的细胞培养箱中孵育24 h,使用0.25%的胰酶消化细胞、800 g离心5 min后进行细胞收集。根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行后续双染等实验操作,染色后的细胞使用300目滤网过滤后,进行流式细胞仪上机检测,观察不同组细胞的凋亡情况及变化趋势。每个实验组均设置3个复孔。
1.3.4使用流式细胞仪检测细胞内活性氧ROS的水平
A549细胞的培养以及6孔板种板、各个实验组的设置、新型吡啶氮唑氮芥化合物的浓度设置等与1.3.3相同。对照组及染毒组的细胞均用1×PBS缓冲液进行漂洗,800 g离心5 min后收集细胞,将细胞重悬于稀释好的DCFH-DA(RPMI-1640无血清培养液稀释至10 μmol/L)中,置于37 ℃细胞培养箱中避光孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触[9]。使用RPMI-1640培养液(不加血清)洗涤细胞并离心,重复3次,1×PBS缓冲液重悬细胞并用300目滤网过滤后,进行流式细胞仪上机检测,每个实验组均设置3个复孔。
1.3.5使用流式细胞仪检测线粒体膜电位
A549细胞的培养以及6孔板种板、各个实验组的设置、新型吡啶氮唑氮芥化合物的浓度设置等与1.3.3相同。1×PBS洗涤细胞3次后离心5 min(1 000 r/min),收集各实验组细胞。根据线粒体膜电位检测试剂盒(JC-1)说明书配置JC-1工作液。将细胞重悬于0.5 mL 细胞培养液中,然后加入0.5 mL JC-1工作液,置于细胞培养箱中,37 ℃下孵育20 min。细胞经JC-1 染色缓冲液(1×)洗涤并重悬后,用300目滤网过滤,并进行流式细胞仪上机检测,每个实验组均设置3个复孔。
1.3.6蛋白质印迹检测Bax和Bcl-2蛋白的表达
A549细胞的培养以及6孔板种板、各个实验组的设置、新型吡啶氮唑氮芥化合物的浓度设置等与1.3.3相同。待细胞贴壁生长至70%~80%,弃上清,1×PBS缓冲液洗3次,分别向6孔板各孔中加入2 mL浓度为0,3.25μg/mL的新型吡啶氮唑氮芥化合物。37 ℃下CO2含量为5%的细胞培养箱中继续培养24 h,使用0.25%的胰酶消化细胞,800 g离心5 min后进行细胞收集;RIPA+PMSF(100∶1)裂解细胞、提取蛋白、使用BCA法定量后调至各组蛋白浓度一致。经SDS聚丙烯酰胺凝胶电泳的一系列实验操作(电泳、转膜及封闭),将有相应蛋白条带的PVDF膜剪下,加入对应的稀释抗体后,置于4 ℃摇床上孵育过夜,其中兔抗Bax抗体及兔抗Bcl-2抗体的稀释比均为1∶500,内参兔抗GAPDH抗体的稀释比为1∶1 000;用1×TBST洗PVDF膜3次,每次10 min,加辣根过氧化物酶HRP标记的山羊抗兔二抗IgG(1∶5 000),室温孵育2 h;TBST洗3次,每次10 min, ECL化学发光法显色,使用Tanon MP蛋白成像系统成像,用Image J软件分析各组蛋白条带对应的灰度值。每个实验组均设置3个复孔。
1.4 实验数据统计分析
实验数据均采用SPSS20.0软件进行单因素方差分析(one-way ANOVA),统计结果以“均数±标准差”的形式表示。P<0.01为差异有显著统计学意义。
2 实验结果与数据分析
2.1 新型吡啶氮唑氮芥化合物对细胞存活率的影响
不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞存活率如图1所示。由图1可知,与对照组(0 μg/mL)相比,细胞存活率随着新型吡啶氮唑氮芥化合物染毒浓度增加均呈梯队下降的态势,并且这种态势具有时间-浓度依赖性。浓度为0.5,1.0,2.0,4.0 μg/mL的新型吡啶氮唑氮芥化合物染毒24 h后,细胞存活率分别为94.51%,81.57%,57.29%,46.34%。新型吡啶氮唑氮芥化合物对A549细胞的半数抑制浓度(IC50)为3.25 μg/mL,采取3.25 μg/mL进行后续实验。

图1 不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞存活率
2.2 新型吡啶氮唑氮芥化合物对A549细胞凋亡的影响
使用流式细胞仪上机检测不同组A549细胞的凋亡情况,不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞凋亡流式分析图如图2所示。由图2可知,新型吡啶氮唑氮芥化合物以0 μg/mL及3.25 μg/mL的浓度作用A549细胞24 h后,细胞凋亡率分别为4.1%,11.93%。与对照组相比,实验组的细胞凋亡率呈明显上升趋势,且早期凋亡率与晚期凋亡率均上升。细胞碎片比率也随之增加,从对照组的5.13%升高到实验组的14.7%。

(a) 0 μg/mL
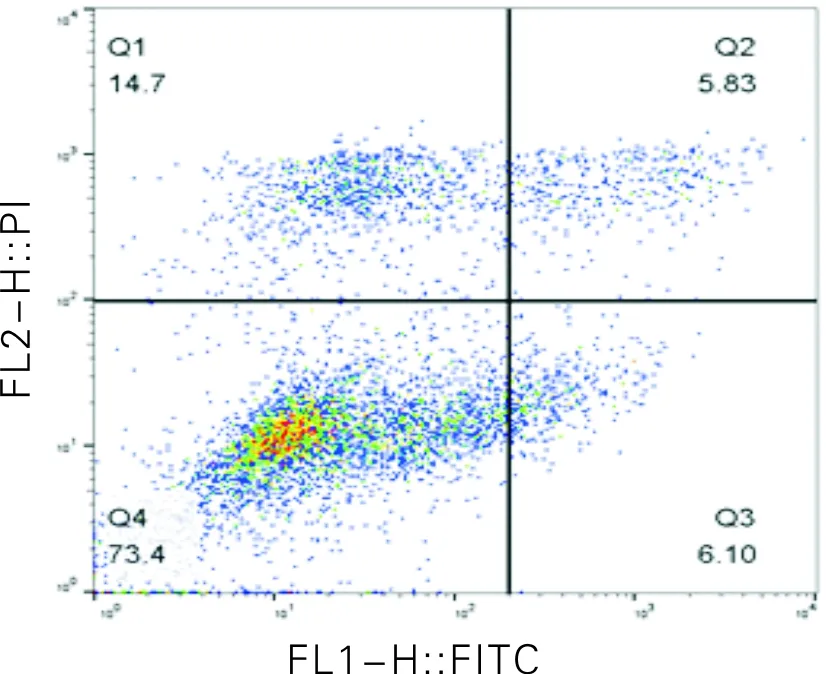
图2 不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞凋亡流式分析图
2.3 A549细胞内活性氧ROS水平检测结果
使用本身无荧光的DCFH-DA染料进行ROS水平检测。这种染料具有细胞膜渗透性,能够自由穿过细胞膜。染料进入细胞后首先被细胞内的酯酶水解生成2',7'-二氯二氢荧光素(DCFH),然后进一步被ROS氧化而生成具有强荧光的物质2',7'-二氯荧光素(DCF)。通过检测终产物DCF的吸光度水平来反映细胞内ROS水平的高低, DCF的荧光光谱和FITC非常相似,流式检测时用FITC的参数设置检测DCF。不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞内ROS水平如图3所示。由图3可知,与对照组相比,实验组的荧光强度明显高于对照组,表明细胞内ROS水平随着新型吡啶氮唑氮芥化合物染毒浓度的增加呈上升趋势,差异具有统计学意义(P<0.01)。
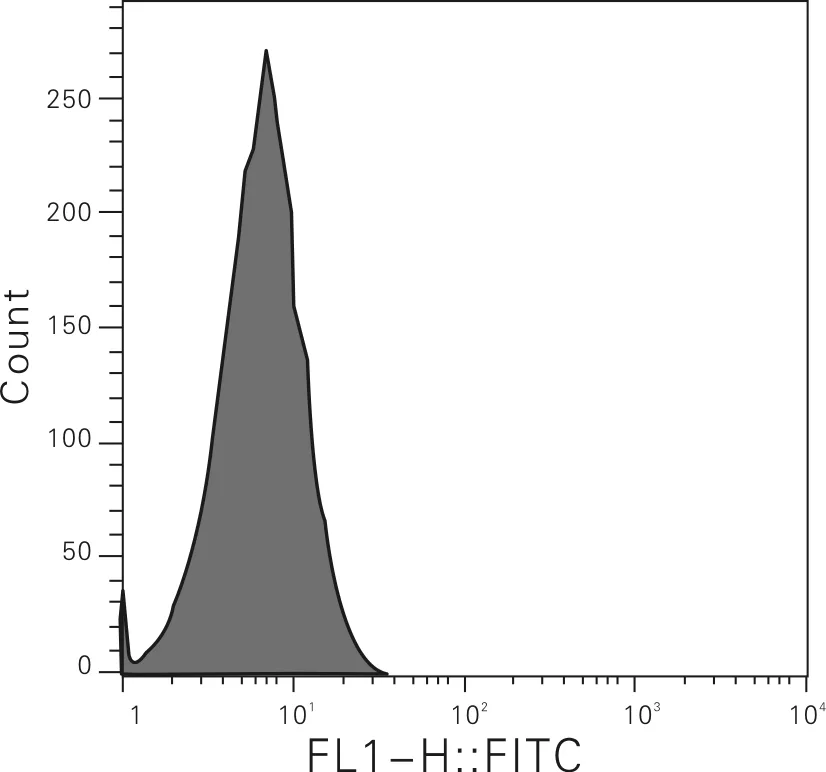
(a) 0 μg/mL

图3 不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后细胞内ROS水平
2.4 A549细胞内线粒体膜电位检测结果
使用JC-1荧光探针进行线粒体膜电位的检测。这种荧光探针能够选择性地进入到线粒体内,并且随着线粒体膜电位降低发生从橙色(JC-1聚合体)到绿色(JC-1单体)的可逆性变化,这一变化能够被流式细胞仪检测并分析。不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后线粒体膜电位水平变化如图4所示。由图4可知,与对照组相比,实验组的绿色荧光(JC-1单体)与橙色荧光(JC-1聚合体)强度的比值明显升高,表明A549细胞内线粒体膜电位水平随着新型吡啶氮唑氮芥化合物染毒浓度的增加呈下降趋势,差异具有统计学意义(P<0.01)。

(a) 0 μg/mL
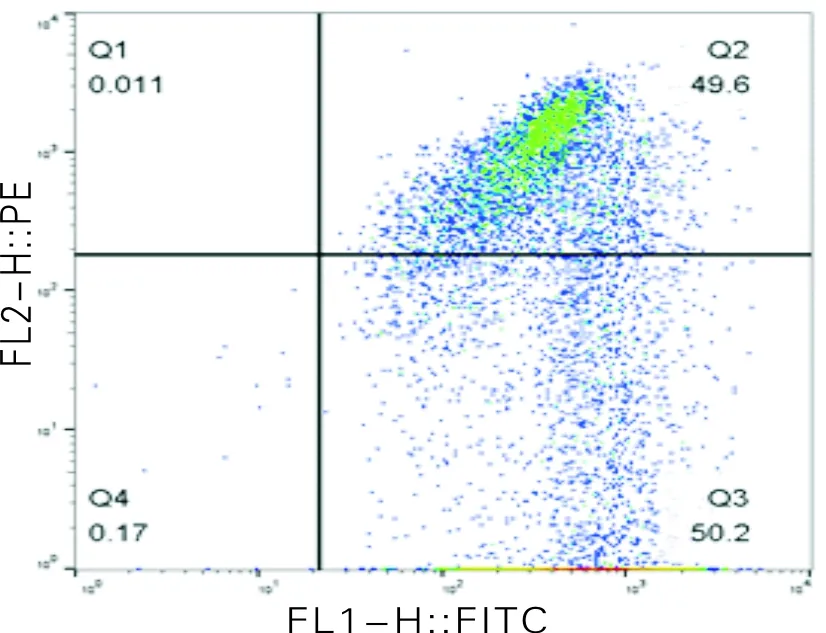
图4 不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后线粒体膜电位水平变化
2.5 蛋白质印迹检测技术检测Bcl-2及Bax蛋白的表达结果
使用蛋白质印迹检测技术(Western Blot)检测凋亡相关蛋白Bcl-2及Bax的表达,不同浓度新型吡啶氮唑氮芥化合物染毒A549细胞24 h后,WB检测Bcl-2及Bax蛋白表达结果如图5所示。

(a) 对照组 (b) 实验组
由图5可知,与对照组相比,凋亡抑制蛋白Bcl-2的表达量明显降低,而凋亡促进蛋白Bax的表达水平则明显升高,进一步在蛋白层面证明了此新型吡啶氮唑氮芥化合物具有诱导细胞凋亡的作用。
3 结论
1)施加新型吡啶氮唑氮芥化合物可导致A549细胞内活性氧ROS水平上调,线粒体膜电位降低,从而诱导细胞发生凋亡。
2)线粒体凋亡途径在新型吡啶氮唑氮芥化合物诱导细胞凋亡过程中起重要作用,新型吡啶氮唑氮芥化合物通过上调线粒体凋亡促进蛋白Bax的表达,降低Bcl-2蛋白表达,引起细胞发生凋亡。
