变化观念与平衡思想在高中化学教学中的渗透
2021-01-19曾赛钦
摘 要:变化观念与平衡思想是高中化学学科核心素养的重要构成内容。在教学过程中,教师加强对这一素养的培养,不仅能使学生更好地理解与掌握所学知识,还能为其灵活运用所学知识分析化学反应提供良好的指引。在教学活动中,教师应做好充分的准备,让学生通过自主学习,掌握化学变化观念与平衡思想的知识;有针对性地设计教学内容,指导学生高效掌握所学知识,从而培养学生的变化观念与平衡思想。
关键词:变化观念;平衡思想;高中化学
中图分类号:G427 文献标识码:A 文章编号:2095-9192(2021)33-0072-02
引 言
《普通高中化学课程标准(2017年版)》中关于变化观念与平衡思想的内容共涵盖四个层面。为将其更好地渗透在教学过程中,教师应联系对应的化学知识,通过对理论与例题的讲解,加强认识,加深理解,从而实现教学目标,促进学生学科核心素养不断发展。
一、注重反应规律剖析
“能认识物质是运动和变化的,知道化学变化需要一定的条件,并遵循一定规律”是变化观念与平衡思想中的一项内容。通过对这一内容的解读,教师应在教学中将理论与实际联系起来,为学生讲解发生在生活中的氧化还原反应,使其把握氧化还原反应的本质及条件[1]。同时,为进一步加深学生对氧化还原反应规律的理解,教师可以与学生一起分析如下问题。
在酸性溶液中,Co2O3可被还原成Co2+,其中I2、FeCl3、Cl2、Co2O3的氧化性依次增强。则在水溶液中,以下反应无法进行的是( )。
A.2I-+2Fe3+=I2+2Fe2+
B.FeI2+Cl2=I2+FeCl2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.6FeI2+3Cl2=4FeI3+2FeCl3
氧化性是物质得电子的能力。物质间要想发生氧化还原反应,需遵循氧化还原反应规律,即一种物质能够从另一种物质中获得电子,或者较另一种物质吸引电子的能力更强。A项中,氧化性强弱关系为2Fe3+>I2,还原性强弱关系为I->Fe2+,能够发生。Cl2氧化性强于Fe2+、I-,但如果Cl2较少,则其首先和还原性更强的I-发生反应,故B项反应能够发生。Co2O3可将Cl-氧化成Cl2,C项正确。D项中,因还原性I->Fe2+,因此,Cl2先氧化I-再氧化Fe2+,反应无法发生。
二、深化反应能量认识
高中化学教学中,为使学生掌握化学反应中的能量转化规律,教师应注重运用多媒体技术,使学生更好地把握化学反应能量变化的本质,如下题。
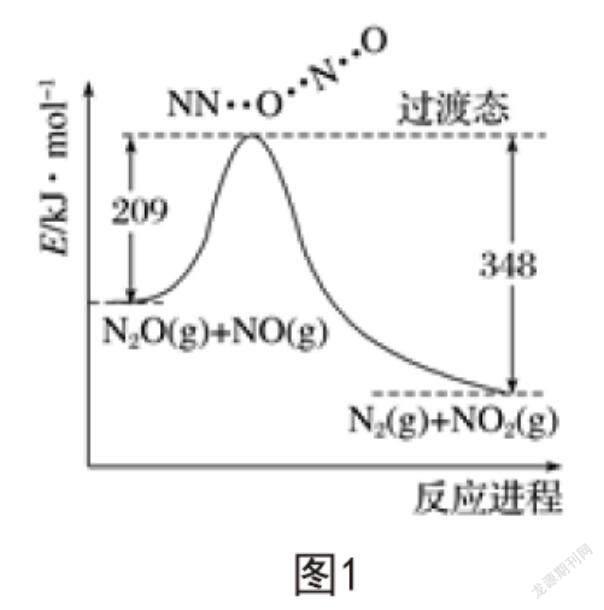
NO和N2O发生反应能够生成NO2和N2,反应过程中的能量变化如图1所示,则以下推断不正确的是( )。
A.每生成1mol的N2,转移电子4mol
B.反应物能量之和较生成物能量之和大
C.NO(g)+N2O(g)=N2(g)+NO2(g);∆H=-139kJ·mol-1
D.断键吸收能量之和比成键释放能量之和小
化学反应不仅有新物质生成,而且在反应过程中有能量变化。解题过程中,学生需要看懂能量变化图,理解纵横轴表示的含义。A项,根据题意可知,发生的反应为NO+N2O=N2+NO2,生成1mol N2转移2mol电子,错误。B项,由图1可知反应物能量之和大于生成物能量之和,反应放热,正确。C项,由图1可知,209kJ·mol-1-348kJ·mol-1=-139kJ·mol-1,正确;由反应放热的本质可知,D项表述正确。综上所述,只有A项错误。
三、讲解反应调控规律
变化观念和平衡思想要求学生“认识化学变化有一定限度,是可以调控的”。为使学生理解这一层面的内容,教师在教学中应结合具体教学内容在课堂上为学生做相关的演示实验,增强课堂趣味性的同时,深化学生对化学反应的认识:很多化学反应是可逆的,而且达到一定的限度后,一些物质的参数将不会发生变化,即达到了化学平衡。为考查学生对化学反应调控规律的理解程度,教师可要求学生结合自己的理解分析如下问题。
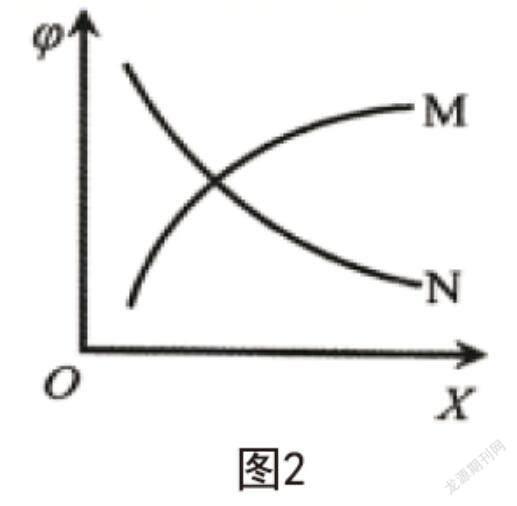
使用如下反应可制备H2:CH4(g)+H2O(g)⇌CO(g)+3H2(g);∆H>0。每次仅改变一种条件,且用X表示,测得CH4平衡时的转化率和X之间的关系如图2所示,则( )。
A.若X为温度,的变化为曲线N
B.若X为压强,的变化为曲线M
C.若X为n(H2O),则的变化曲线为N
D. X为投料n(CH4)与n(H2O)的比值时,的变化为曲线N
化学反应达到平衡后,相關物质的参数不再发生变化。但通过改变条件可对平衡进行调控,使其正向或逆向移动。由题干创设的情境可知,给出的化学反应为吸热反应,随着X温度的增加,平衡正向移动,值增加,对应曲线M;此化学反应为气体分子数增多的反应,增大压强X,反应逆向移动,的变化曲线为N;增加H2O的物质的量,平衡正向移动,会增加,对应曲线M;X为n(CH4)/n(H2O)时,相当于增加了CH4的量,平衡虽然正向移动,但的值是减小的,对应曲线N。综上所述,只有D项正确。
四、多角度分析化学反应
“能够多角度动态地分析化学反应,运用化学反应原理解决实际问题”是变化观念与平衡思想最后一个层面的内容,强调了提高学生分析与解决问题的能力。在教学过程中,教师要鼓励学生做好训练总结,掌握动态地分析化学反应的相关细节,尤其要结合不同化学反应的特点,灵活地运用勒夏特列原理进行分析。教师可以在课堂上组织学生围绕以下习题开展训练活动。
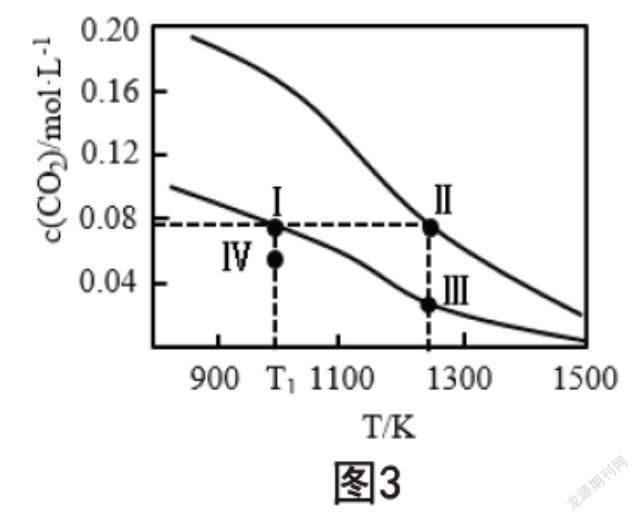
向两容积均为1L的恒容密闭容器中加入足量相同的碳粉,之后分别加入0.1mol和0.2mol的CO2,在不同温度条件下发生反应:CO2(g)+C(s)⇌2CO(g),平衡时,c(CO2)随温度的变化如图3所示,则以下判断正确的是( )。
A.反应的∆H<0
B.体系的总压强:p(Ⅰ)>p(Ⅲ)
C.平衡常数:K(Ⅰ) D.T1温度时,Ⅳ点所处的状态中v(正)>v(逆) 两条曲线均随着温度的增加呈下降趋势,表明反应达到平衡时,c(CO2)含量降低,转化率增加,由勒夏特列原理可知反应为吸热反应;Ⅰ点和Ⅲ点在同一曲线上,从Ⅰ点到Ⅲ点平衡正向移动,为气体分子数增多的反应,因此,体系的总压强满足p(Ⅰ) 结 语 综上所述,教师应认真剖析化学核心素养与教学内容之间的联系,做好授课准备,灵活运用多种教学方法,注重培养学生的变化观念与平衡思想,做好对化学反应规律、能量、化学反应限度、化学平衡知识的讲解,并配合相关习题的训练,使学生形成变化观念与平衡思想。 [参考文献] [1]韩琳慧.基于变化观念与平衡思想的“化学反应限度”教学设计[J].求知导刊,2021(11):67-68. 作者简介:曾赛钦(1979.11-),女,福建莆田人,本科学历,中学一级教师。
