SLE继发抗磷脂抗体综合征合并Libman-Sacks心内膜炎一例
2021-01-19卢丽娟黄勤
卢丽娟?黄勤
【摘要】临床部分SLE患者可继发抗磷脂抗体综合征(APS),但同时合并非细菌性心内膜炎的患者则较为罕见。该文报道1例SLE继发APS合并Libman-Sacks心内膜炎患者的诊治过程。该患者入院前有发热、关节痛、咽痛和皮疹,入院后UCG示二尖瓣前叶赘生物形成,查狼疮抗体、抗磷脂抗体、狼疮样抗凝物试验阳性,经抗感染治疗后病情未缓解,后患者突发头晕、口周麻木、构音不清、吞咽困难,查头颅MRI见一新发的延髓梗死灶。结合患者临床表现、体征及辅助检查,诊断为APS,Libman-Sacks心内膜炎,延髓梗死,SLE。予免疫抑制、免疫调节、低分子肝素抗凝等治疗后患者病情好转出院。该例的诊治提示,在UCG发现赘生物时,不仅要考虑感染性心内膜炎,同时需要考虑SLE继发APS可能,尤其是对于既往无明确心瓣膜病病史的年轻女性,早期诊断APS合并Libman-Sacks心內膜炎,并给予个体化抗凝治疗,可取得良好疗效。
【关键词】抗磷脂抗体综合征;系统性红斑狼疮;Libman-Sacks心内膜炎;抗凝治疗;
感染性心内膜炎;鉴别诊断
Antiphospholipid antibody syndrome secondary to SLE complicated with Libman-Sacks endocarditis: a case report Lu Lijuan, Huang Qin. Internal Medicine Training Base, Shenzhen Peoples Hospital, Shenzhen 518000, China
【Abstract】In clinical practice, partial patients with systemic lupus erythematosu (SLE) can develop secondary antiphospholipid antibody syndrome (APS), whereas simultaneous complication with non-bacterial endocarditis is rarely encountered. In this article, the diagnosis and treatment of one case of APS secondary to SLE complicated with Libman-Sacks endocarditis were reported. Prior to admission, the patient presented with fever, joint pain, sore throat and rash. UCG upon admission revealed the mass in the anterior leaflet of mitral valve. The patient was tested positive for lupus antibody, antiphospholipid antibody and lupus-like anticoagulant test. The symptoms were not alleviated after anti-infection therapy. Subsequently, the patient suffered from dizziness, numbness around the mouth, unclear articulation and dysphagia. Cranial MRI revealed a new medullary infarction lesion. Combined with clinical manifestations, physical signs and auxiliary examinations, the patient was diagnosed with APS, Libman-Sacks endocarditis, medullary infarction and SLE. After immunosuppression, immunomodulation and low-molecule heparin anticoagulation interventions, the patient was improved and discharged from hospital. The diagnosis and treatment of this case prompted that besides IE, the possibility of APS secondary to SLE should also be considered when UCG revealed a neoplasm, especially for young women who had no clear history of valvular heart diseases. Early diagnosis of APS complicated with Libman-Sacks endocarditis and individualized anticoagulation therapy can yield favorable clinical efficacy.
【Key words】Antiphospholipid antibody syndrome;Systemic lupus erythematosus;
Libman-Sacks endocarditis;Anticoagulation therapy;Infective endocarditis;
Differential diagnosis
抗磷脂抗体综合征(APS)是一种非炎症性自身免疫病,临床上以动脉、静脉血栓形成,病态妊娠(妊娠早期流产和中晚期死胎)和血小板减少等症状为表现,血清中存在抗磷脂抗体,上述症状可以单独或多个共同存在。多见于年轻人,男女发病率之比约为1∶9,女性发病的中位年龄为 30岁[1]。APS可出现在SLE的活动期,而SLE继发APS同时合并Libman-Sacks心内膜炎极为罕见。为提高临床医师对该病的认识水平,现将近年我院收治的一例SLE继发APS合并Libman-Sacks心内膜炎患者的诊治过程综合报告如下。
病例资料
一、病史及体格检查
患者女,26岁。因发热2 d、关节痛10 d、皮疹4 d于2019年8月5日收入我院风湿免疫科。10 d前患者无诱因下出现双膝关节肿胀,伴膝关节以下麻木、疼痛感,后逐渐出现双肘关节、指间关节等多关节肿痛,自感有低热,但未测体温,自行予止痛等对症处理后效果欠佳。2 d前患者出现发热,最高体温39.4℃,伴畏寒、咽痛等不适,并开始出现双下肢斑疹、淤斑,呈深紫色,伴明显瘙痒,为进一步诊治来我院求诊。起病以来,患者诉无寒战、头晕,无胸闷、心悸,无咳嗽、咳痰,无腹痛、腹泻,无皮疹,无口腔溃疡等不适,平素患者易出现光敏感,精神、饮食、睡眠差,二便正常,近期体质量无变化。否认风湿性心脏病、先天性心脏病、冠状动脉粥样硬化性心脏病(冠心病)史,有人工流产史2次,无静脉吸毒史不良嗜好,发病前也无侵入性操作史。家族中母亲有“风湿病”,具体不详,否认代谢性疾病、遗传性疾病史。
入院后体格检查:体温36.7℃,脉搏83次/分,呼吸20次/分,血压102/72 mm Hg (1 mm Hg = 0.133 kPa),四肢散在深紫色皮疹,以下肢为主,关节无红肿、压痛,无畸形,双膝关节未触及骨擦感。面部无皮疹。双肺呼吸音清,未闻及干湿性啰音。心律整齐,各瓣膜区未闻及杂音,腹平软,无压痛反跳痛,双下肢无水肿,无皮肤破溃。
二、实验室检查和辅助检查
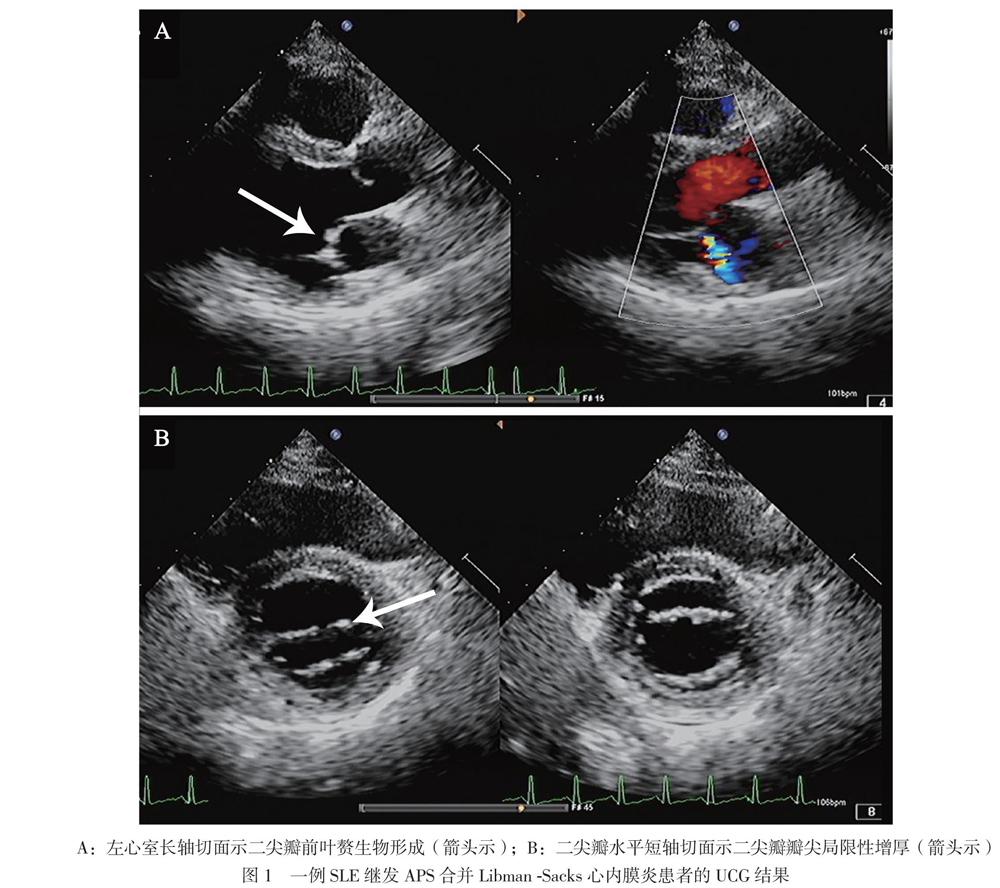
血常规示白细胞、红细胞、血红蛋白、血小板大致正常,ESR 115 mm/h,CRP 46.63 mg/L,D-二聚体7.04 mg/L,抗ds-DNA抗体阳性(++),抗核抗体 977 kU/L,抗β2糖蛋白Ⅰ抗体IgG 97.7 kU/L,抗心磷脂抗体IgM 2.3 MPLU/ml。CD4+/CD8+ T淋巴细胞3.00,狼疮样抗凝物(+)。Ig及补体正常。心电图:窦性心动过速,轻度ST段压低,T波低平(Ⅱ,Ⅲ,aVF,V1 ~ V6导联)。双下肢动静脉彩色多普勒超声示未见明确血栓征象。于2019年8月9日完善UCG检查,结果提示二尖瓣前叶赘生物形成?感染性心内膜炎不能完全除外,见图1A。完善抗“O”试验阴性,多次血培养均未见异常。
三、诊治过程
入院后患者未再出现发热,考虑感染性心内膜炎不能完全除外,于8月11日加用头孢曲松钠抗感染。于8月12日复查UCG,结果示二尖瓣瓣尖局限性增厚。结合患者病史,考虑Libman-Sacks心内膜炎可能,见图1。予以甲泼尼龙治疗,起始剂量为80 mg/d口服,逐渐减量,7 d后减至40 mg/d口服,并予低分子肝素抗凝,加用环磷酰胺0.4 g,每2周1次,同时予营养神经、抑酸护胃治疗。8月20日,患者出现发热,最高体温为38.3℃,下肢搔抓处皮肤破损分泌物病原学培养出嗜麦芽窄食单胞菌,考虑患者发热与此相关,根据药物敏感试验结果改用左氧氟沙星联合复方磺胺甲唑抗感染,之后体温降至正常。8月27日患者午休期间突发头晕、口周麻木、构音不清、吞咽困难,查头颅MRI见一新发的延髓梗死灶。结合患者临床表现、体征及辅助检查,主要诊断为:APS,Libman-Sacks心内膜炎,延髓梗死,SLE。继续予甲泼尼龙40 mg/d抑制免疫、羟氯喹调节免疫,加用环磷酰胺0.4 g (累积量为1.2 g)、低分子肝素抗凝,同时抗血小板聚集、营养神经、抑酸护胃治疗,定期监测国际标准化比值(INR),调整华法林剂量,复查血常规、肝肾功能未见明显异常,凝血酶原时间29.1 s,INR 2.80,无出血表现,患者病情好转,于9月30日出院。出院后门诊随访,一般情况可,至撰稿日无特殊不适。
讨论
本文患者入院前有发热、咽痛等不适,UCG示二尖瓣前叶赘生物形成,且查狼疮抗体、抗磷脂抗体、狼疮样抗凝物试验阳性,需明确其是因感染性心内膜炎(IE)还是由原发病导致的心脏瓣膜赘生物?
Libman-Sacks心内膜炎又称疣状心内膜炎,是由Libman和Sacks在1924年率先报道,主要见于SLE,在APS患者中更为常见,表现为瓣膜赘生物、瓣膜增厚,是一种发生在心内膜上的多发性非细菌性疣状赘生物,可侵犯心脏各瓣膜,以二尖瓣和主动脉瓣为多见[2-3]。其发病机制是由于自身Ig及补体沉积导致瓣膜增厚,且在瓣膜上形成纤维蛋白-血小板血栓[4]。Libman-Sacks心内膜炎典型的组织病理学改变是外层为渗出性纤维蛋白、细胞核碎屑和苏木素小体,中层由增生的毛细血管、纤维母细胞等组织组成,中央可见与薄壁血管相连的新生血管,该血管内可发现Ig与补体的沉积[5-6]。
感染性心内膜炎是指因细菌、真菌、病毒等微生物感染,通过血液流动直接侵犯心内膜而导致的心内膜炎症。心内膜损伤,内层胶原暴露,血小板、红细胞、白细胞和纤维蛋白积聚,从而为病原微生物的侵入创造了条件,反复发生的菌血症可使机体循环中产生抗体如凝集素,有利于病原体在损伤部位黏附而与上述的各种成分一起形成赘生物。赘生物成为微生物的庇护处,使其免受宿主防御机制的作用。感染的赘生物通过血小板-纤维素聚集而逐渐增大,从而使瓣膜破坏加重[7]。
Libman-Sacks心内膜炎极易与IE混淆而误诊[8]。其实两者在本质上有着明显的区别。本例患者起病较急,先以双下肢多发微血栓起病,伴有发热,2次查UCG可见二尖瓣赘生物形成。从临床表现看,患者发病前有发热、畏寒、咽痛等上呼吸道感染症状,IE不能完全除外,但仔细分析此患者的病历资料可见其与IE有着很大的区别:①患者既往体健,无明确风湿性心脏病、先天性心脏病、冠心病等损害心脏的病史,无静脉吸毒史不良嗜好,发病前也无侵入性操作史,如拔牙、妇科检查等。②反复几次血培养均未见异常,病程中以大量足疗程抗菌药物治疗情况下仍有反复发热,而头孢曲松钠可使98%的IE患者达细菌学治愈,如若抗菌药物治疗无效,则会出现瓣膜损害逐渐加重,从而诱发心力衰竭或血流动力学障碍等问题[9]。③IE的白细胞计数、CRP水平和血液培养均可见异常[10]。SLE活动时白细胞减少,IE则相反。过高的CRP水平表明是感染的原因,因为SLE患者不太可能对其产生强烈的反应,然而明确的鉴别诊断还需依靠血培养。本例患者的白细胞正常,CRP水平不高,血培养阴性。④本例患者风湿相关抗体阳性,UCG可见赘生物发生在瓣膜的交界处,不活动,边缘不毛糙。而IE赘生物呈毛绒样团状,随瓣膜的活动而活动[11]。⑤APS可无发热,本例患者治疗过程中仍有反复发热,考虑可能与双下肢皮肤感染相关,根据皮肤分泌物药物敏感试验改用敏感抗菌药物后患者体温即恢复正常,这验证了患者的发热与双下肢感染相关。本例的诊治提示,在UCG发现赘生物时,不仅要考虑IE,同时需要考虑SLE继发APS可能,尤其是既往无明确心瓣膜病病史的年轻女性。心脏瓣膜受累是原发性或继发性APS常见的心脏表现,国外报道32%的APS可侵犯心脏瓣膜,造成瓣膜损害,包括瓣膜增厚、狭窄、反流及赘生物。多达70%的APS患者有UCG诊断的瓣膜异常,并多见于二尖瓣和主动脉瓣[12]。本例患者可能是因 SLE继发APS导致无菌性心内膜赘生物和脑梗死。对于该病的治疗,长期抗凝是降低血栓事件的唯一手段,部分患者需要終生抗凝治疗[13]。
综上所述,对于非IE患者,需要考虑SLE继发APS的可能性。通过对SLE及APS的不断深入探索,期待发现更多的相关病例特点,从而提高临床诊疗水平。
参 考 文 献
[1] 中华医学会风湿病学分会. 抗磷脂综合征诊断和治疗指南. 中华风湿病学杂志, 2011, 6(15): 407-410.
[2] Galve E, Candell-Riera J, Pigrau C, Permanyer-Miralda G, Garcia-Del-Castillo H, Soler-Soler J. Prevalence, morphologic types, and evolution of cardiac valvular disease in systemic lupus erythematosus. N Engl J Med, 1988, 319(13):817-823.
[3] Doherty NE, Siegel RJ. Cardiovascular manifestations of systemic lupus erythematosus. Am Heart J, 1985, 110(6):1257-1265.
[4] 黄毅,陈昕,王晓冰,杨军. 超声心动图诊断Libman-Sacks心内膜炎1例. 中国临床医学影像杂志, 2020, 31(1):72.
[5] Nihoyannopoulos P, Gomez PM, Joshi J, Loizou S, Walport MJ, Oakley CM. Cardiac abnormalities in systemic lupus erythematosus. Association with raised anticardiolipin antibodies. Circulation, 1990, 82(2):369-375.
[6] 秦瑞芳,胡绍先.系统性红斑狼疮的心脏瓣膜病变. 内科急危重症杂志,2008,14(2):92-103.
[7] 接丽莉,杨跃辉.感染性心内膜炎的分类及其药物治疗现状.中国临床药理学杂志, 2018, 34(19):2355-2358.
[8] 时向民, 王玉堂, 王蔚然, 宁清秀.抗磷脂综合征合并疣状心内膜炎误诊为亚急性细菌性心内膜炎1例报告并文献复习. 中国误诊学杂志, 2006, 6(13):2465-2467.
[9] 李琪,高秀玲. 感染性心内膜炎抗菌药物的应用. 新医学, 2004, 45(3):140-141.
[10] Hamza MA, Allam L. Libman-Sacks endocarditis, and other echocardiographic findings in systemic lupus erythematosus: case report. Egypt Heart J, 2012, 64(3):171-172.
[11] Brenner B, Blumenfeld Z, Markiewicz W, Reisner SA. Cardiac involvement in patients with primary antiphospholipid syndrome. J Am Coll Cardiol, 1991, 18(4):931-936.
[12] Mohammadi Kebar Y, Avesta L, Habibzadeh A, Hemmati M. Libman-Sacks endocarditis in patients with systemic lupus erythematosus with secondary antiphospholipid syndrome. Caspian J Intern Med, 2019, 10(3):339-342.
[13] Espinosa G, Cervera R. Current treatment of antiphospholipid syndrome: lights and shadows. Nat Rev Rheumatol, 2015, 11(10):586-596.
(收稿日期:2020-07-17)
(本文編辑:林燕薇)
