彩色多普勒超声联合Fibroscan评分系统在慢性乙肝纤维化诊断中的应用研究
2021-01-19徐异彩伍彦辉刘翠平武云哲
徐异彩,伍彦辉,张 冉,刘翠平,武云哲
1.石家庄市人民医院,河北 石家庄 050011; 2.石家庄市第五医院,河北 石家庄 050021
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙肝病毒(hepatitis B virus,HBV)感染引起的肝脏疾病,可导致肝纤维化发生,并成为肝硬化、肝癌的发病基础[1]。研究表明,肝纤维化可得到控制甚至逆转[2,3]。但肝脏是一个沉默的器官,CHB肝纤维化早期可无特异性的症状和体征,一旦出现明显症状、体征,多数患者已有明确的肝硬化,甚至出现肝衰竭,逆转困难,所以肝纤维化的诊断对CHB预后评估和治疗决策等均有重要价值[4,5]。作为肝纤维化诊断的金标准,肝穿刺组织学检查存在有创性的不足,造成患者依从性低,难以重复检查,且因标本较小、肝组织标本取样误差,可能导致漏诊,故研究无创肝纤维化诊断技术显得尤为必要[6]。超声检查具有无创、经济、简便、可重复等优点,诊断失代偿肝硬化的价值被广泛认可,但对早期肝纤维化的诊断价值,不同研究的结果差异较大,且超声检测模式与参数均较多,不同研究者对不同模式、参数重视程度不同,因此有必要进行全面性的探讨[7,8]。鉴于此,本研究选取我院行超声引导下肝穿刺活检的CHB患者300例,探讨了彩色多普勒超声联合Fibroscan评分系统的诊断价值。
1 资料和方法
1.1 一般资料
选取2019年1月~2020年1月我院行超声引导下肝穿刺活检的慢性乙肝患者300例,其中235例有肝纤维化(观察组),65例无肝纤维化(对照组)。两组患者年龄24~78岁,组间性别、年龄、体质量指数、丙氨酸转移酶(Alanine transferase,ALT)、胆红素、Child-Pugh分级、合并症等资料均衡可比(P>0.05),见表1。本研究经我院伦理委员会审核通过,患者均对本研究知情,自愿签署知情同意书。
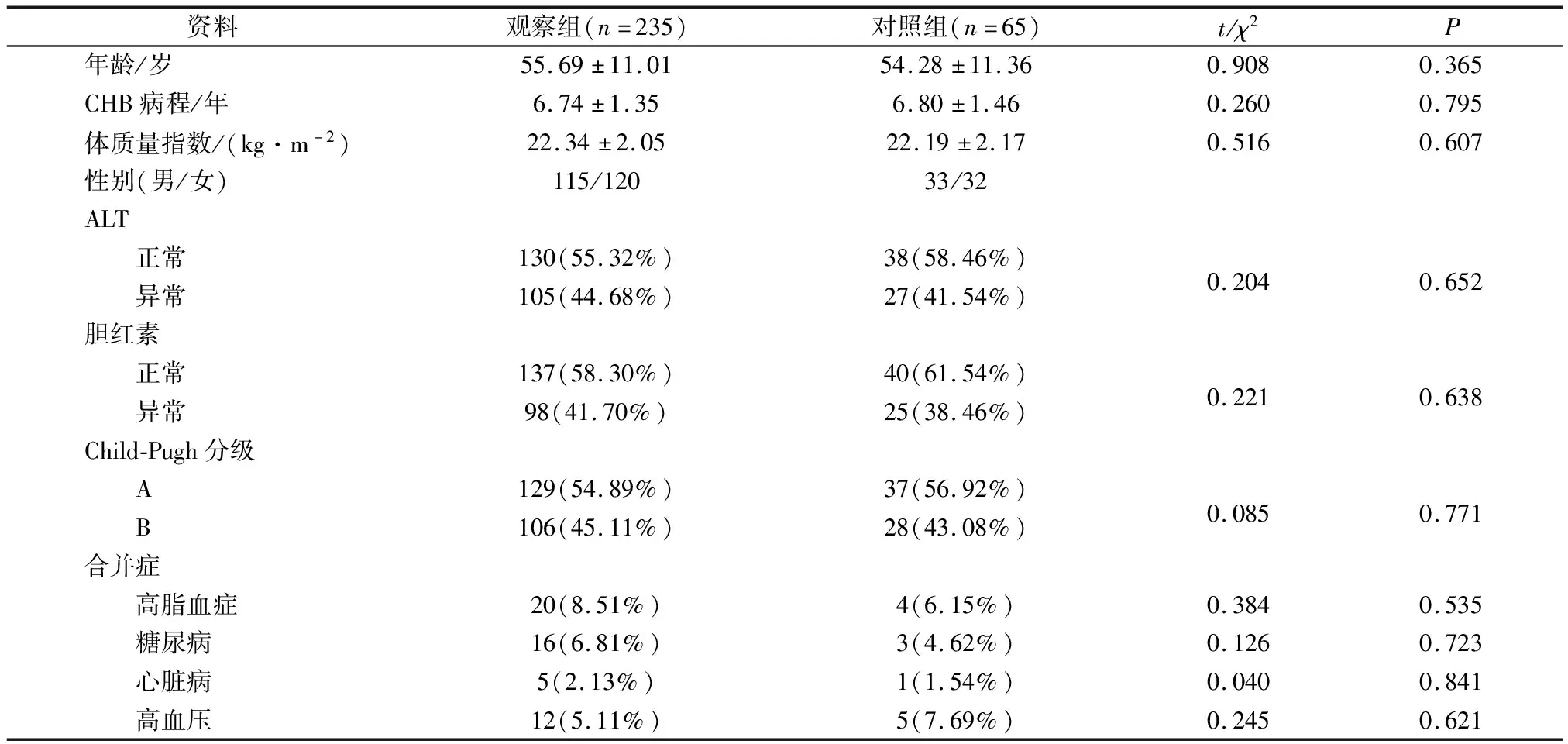
表1 两组临床资料对比
1.2 纳入和排除标准
(1)纳入标准:符合CHB诊断标准[9];肝纤维化的诊断参考《肝纤维化诊断及治疗共识(2019年)》[10];能耐受肝穿刺活检,并获得明确病理学诊断的患者。
(2)排除标准:合并腹水患者;体质量指数>30 kg/m2者;肋间隙狭窄患者;不能耐受肝穿刺活检者;药物性肝损害者;遗传代谢性肝病者;自身免疫性肝病者;合并肝癌等恶性肿瘤者;甲、丙、丁、戊型病毒性肝炎患者;酒精性肝病者;非酒精性脂肪肝者;慢性阻塞性肺疾病、结缔组织病者;血小板计数≤80×109/L者;肝穿刺活检前1月有输血、透析相关治疗史者。
1.3 方法
1.3.1肝穿刺活检
采用超声引导下肝穿刺活检。肝组织标本长度>1.0 cm,汇管区数量>5个,常规石蜡切片,行网状纤维和Masson染色。参照《肝纤维化诊断及治疗共识(2019年)》[10]标准,由病理学医师进行评估,将肝纤维化程度分为S0~S4期,分期越高,肝纤维程度越严重。
1.3.2彩色多普勒超声检查
在患者肝穿刺活检后一周内,采用GE LOGIQ E9彩色多普勒超声诊断仪进行检查。检查前空腹>8 h,患者取平卧位,用二维超声观察肝表面平整度、边缘形态、实质回声强度等,测量门静脉主干内径(main portal vein diameter,mPVD)、脾静脉内径(splenic vein diameter,SVD)。采用彩色多普勒超声对脾静脉进行测量处为距脾门约1.0 cm处,门静脉测量位置于肋间切面,选第一肝门处进行测量。采集血流信号时,取样容积略小于管腔内径,与血管夹角<60°,检测记录门静脉血流量(main Portal vein blood flow,mPBF)、门静脉主干平均血流速度(mean velocity of main portal vein,mPVm)、门静脉淤血指数(congestion index,CI)、脾静脉平均血流速度(mean velocity of splenic vein,sVm)、脾静脉血流量(splenic venous blood flow,sVBF)。
血流量的计算公式:π×(d/2)2×v×60;CI=π×(d/2)2/v(d为血管最大截面直径,v为血管最大截面的平均血流速度)。
1.3.3Fibroscan评分系统评估
采用FibroScan定向瞬时弹性成像系统(法国Echosens公司),探头频率≥3.5 MHz,型号均为成人中等型号。检测时,于患者右侧腋前线或腋中线的第7、8、9肋间隙检测区域,垂直皮肤放置涂有耦合剂的探头,并保证探头在肋间隙中间,远离肝脏的边缘,正对肝实质处。稍加压,压力指示条在绿色区域,进行连续按发射键检测,要求成功检测10次,以中位数为最终结果,以肝脏硬度值(liver stiffness measurement,LSM)表示。检测数据要求四分位差距与中位值比值<0.3,并且成功率必须≥60%(成功捕获回波次数/总发射次数),否则为检测失败,需重新操作。
1.4 观察指标
(1)比较两组彩色多普勒超声参数(sVm、sVBF、mPBF、SVD、mPVD、CI、mPVm)和LSM水平。
(2)分析各参数诊断CHB肝纤维化的截断值、敏感性、特异性。
(3)比较不同纤维化分期患者的彩色多普勒超声参数、LSM。
(4)分析各参数与CHB肝纤维化分期的相关性。
(5)分析各参数诊断不同肝纤维化分期的价值。
1.5 统计学方法
2 结果
2.1 比较两组患者的彩色多普勒超声参数和LSM
两组患者的sVm、sVBF、mPBF比较,组间差异无统计学意义(P>0.05);观察组SVD、mPVD、CI、LSM高于对照组,mPVm低于对照组(P<0.05)。见表2。
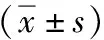
表2 两组彩色多普勒超声参数、LSM比较
2.2 分析各参数诊断CHB肝纤维化的价值
ROC分析显示,单一指标中LSM诊断CHB肝纤维化的AUC最大,为0.833,其截断值>8.73 kPa时,对应的敏感性为67.66%,特异性为89.23%(P<0.05);各参数联合诊断的AUC大于任一单一指标,为0.876,其敏感性为77.87%,特异性为86.15%(P<0.05)。见图1及表3。
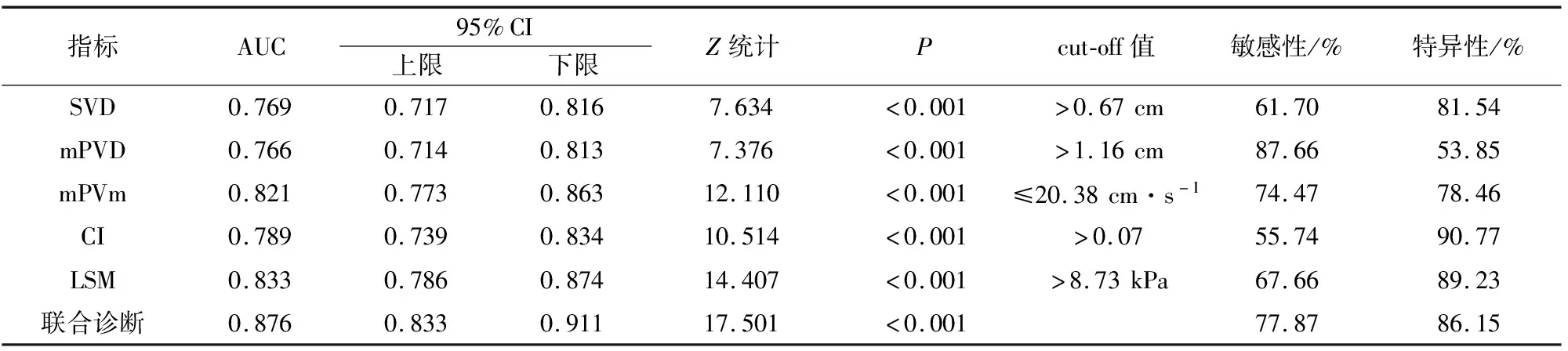
表3 各参数诊断CHB肝纤维化的ROC分析结果
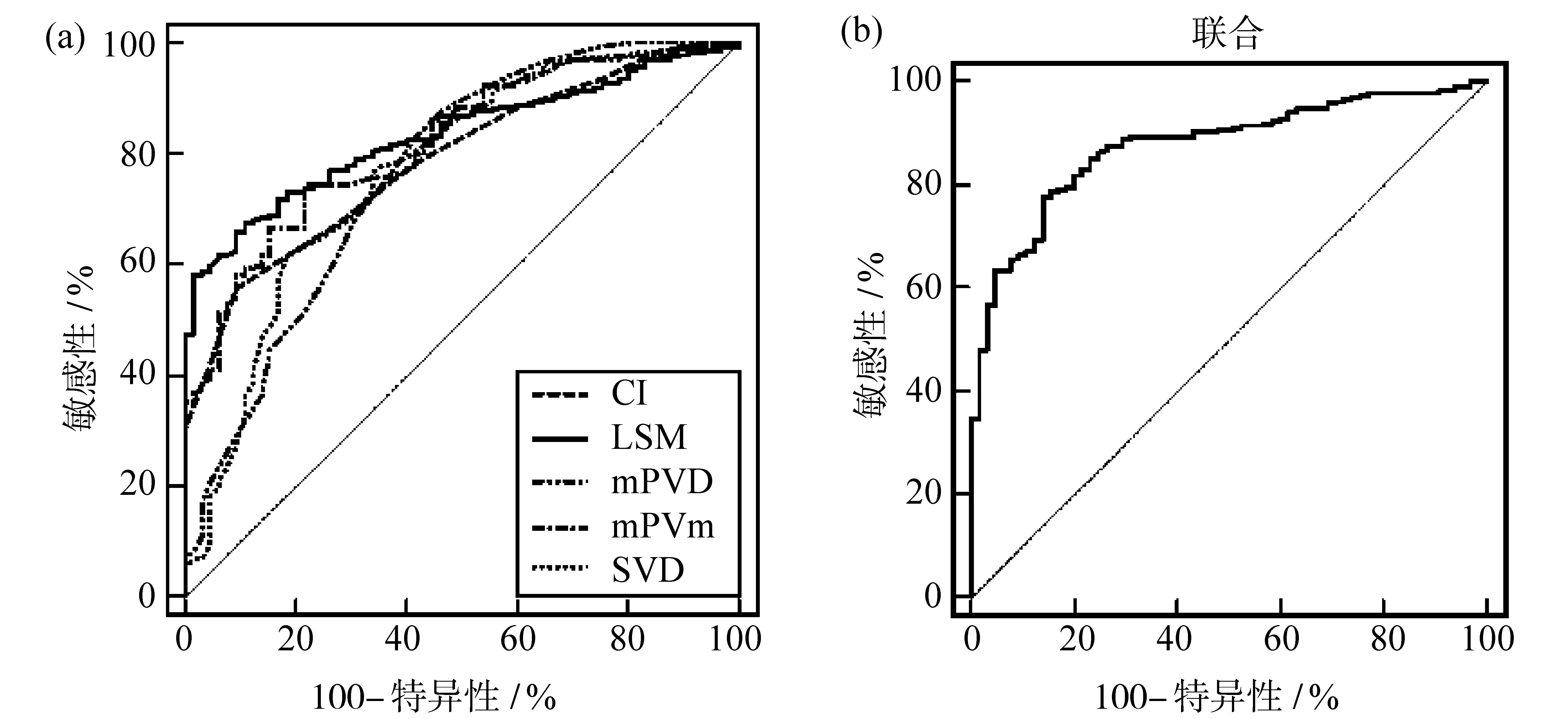
图1 各参数诊断CHB肝纤维化的ROC曲线
2.3 比较不同纤维化分期患者各参数
不同纤维化分期患者的sVm、sVBF、mPBF比较,差异无统计学意义(P>0.05);不同纤维化分期患者的SVD、mPVD、mPVm、CI、LSM比较,差异具有统计学意义(P<0.05);SVD、mPVD、CI、LSM数值随分期严重程度而增大,mPVm数值随分期严重程度减小(P<0.05)。见表4。
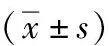
表4 不同纤维化分期患者彩色多普勒超声参数和LSM比较
2.4 分析各参数与CHB肝纤维化分期的相关性
Spearman分析显示,SVD、mPVD、CI、LSM与肝纤维化分期呈正相关,mPVm与肝纤维化分期呈负相关(P<0.05)。见表5。
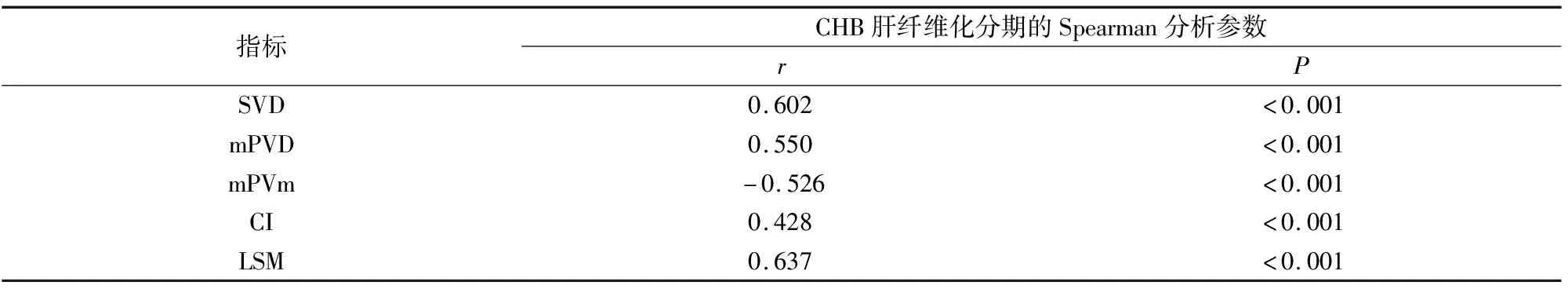
表5 各参数与CHB肝纤维化分期的相关性
2.5 分析各参数诊断不同肝纤维化分期的价值
诊断肝纤维化分期,LSM的AUC始终最大,其中诊断S1、S2、S3的AUC和截断值分别为0.821和>8.88 kPa、0.811和>10.38 kPa、0.831和>11.96 kPa。见图2及表6。

图2 各参数诊断肝纤维化分期的ROC曲线
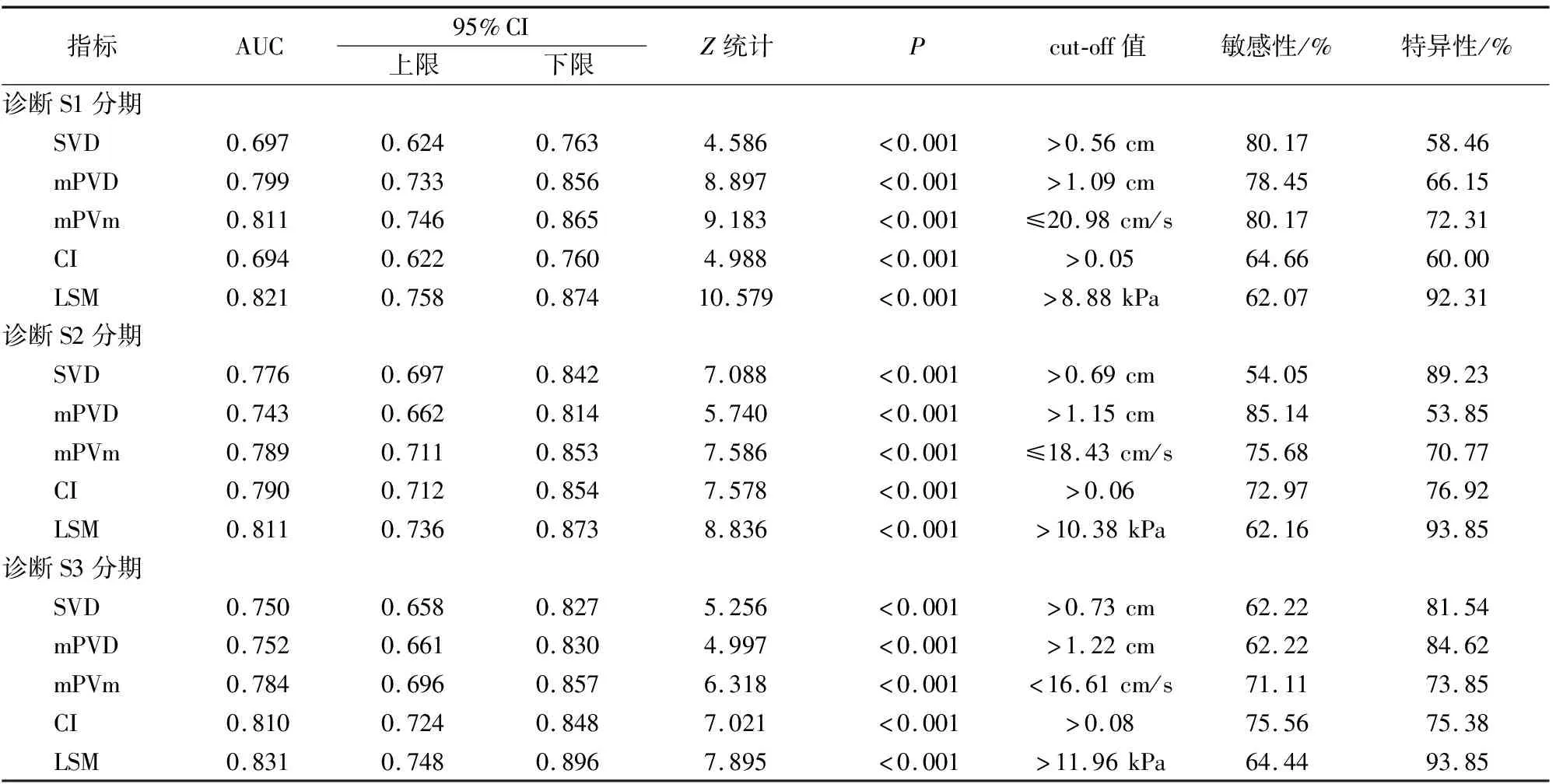
表6 ROC分析结果
2.6 LSM诊断CHB肝纤维化的流程图
由于LSM诊断各分期肝纤维化的AUC最高,故以LSM为例,绘制LSM诊断肝纤维化的流程图,见图3。
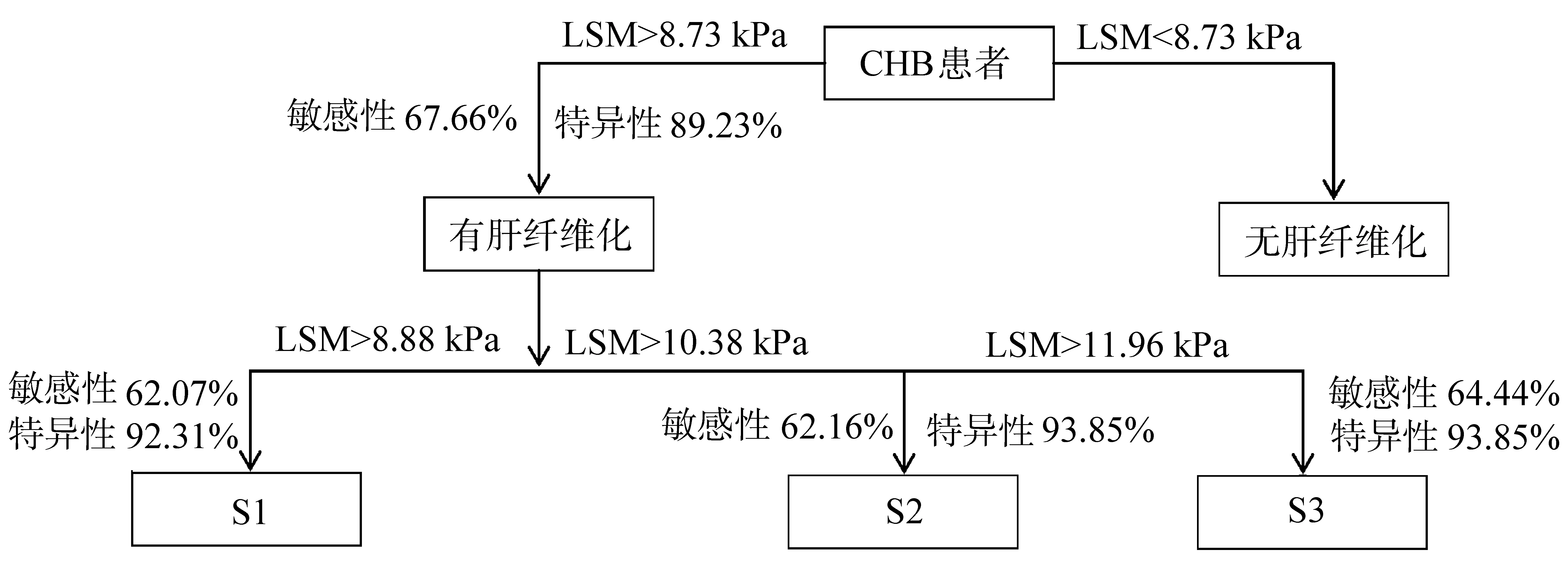
图3 LSM诊断CHB肝纤维化流程图
3 讨论
CHB肝纤维化是肝脏对各种自身、外界因素所致肝损伤异常修复的结果,表现为肝内细胞外基质沉积与增生,继续进展可出现肝硬化。对肝纤维化进行客观的诊断并准确地进行分期,对延缓疾病进展、改善患者预后意义重大[11]。
以往研究采用超声评估肝纤维化时,多通过二维超声观察肝实质回声、被膜、边缘形态、静脉清晰度等,数据量化困难,具有一定主观性,而较少采用彩色多普勒超声测定门静脉、脾静脉血流动力参数进行评估。本研究对此探讨,显示观察组SVD、mPVD高于对照组,且SVD、mPVD与肝纤维化分期呈正相关,提示CHB肝纤维患者门静脉、脾静脉内径逐渐增宽,并随肝纤维化程度加重呈递增趋势。CHB患者发生肝纤维化后,受肝窦毛细血管变化、肝细胞的坏死变性等因素影响,门静脉阻力逐渐增大,造成血管直径增宽。随着肝纤维化程度加重,汇管区压力逐渐增高,使肝动脉流向门静脉,造成压力增高,门静脉阻力亦因小叶周围产生的压力增加而增高,从而导致门静脉增宽[12,13]。肝纤维化程度递增、门静脉高压又可导致脾脏血流动力学改变及形态变化,出现回流受阻,从而造成脾肿大和脾静脉内径增宽[14]。ROC分析发现,SVD诊断CHB肝纤维化的AUC为0.769,mPVD诊断CHB肝纤维化的AUC为0.766,可为临床诊断CHB患者是否伴有肝纤维化提供量化的数据参考。进一步的ROC分析显示,SVD的截断值大于0.56 cm、0.69 cm、0.73 cm时,分别提示患者肝纤维化分期为S1、S2、S3的可能性较大,mPVD的截断值>1.09 cm、1.15 cm、1.22 cm时,分别提示患者肝纤维化分期为S1、S2、S3的可能性较大,从而为临床提供分期的参考信息。
此外,本研究显示观察组CI高于对照组,mPVm低于对照组,CI随S分期递增呈显著升高趋势,mPVm随S分期递增呈显著降低趋势,CI与肝纤维化分期呈正相关,mPVm与肝纤维化分期呈负相关,表明肝纤维化患者门静脉主干平均血流速度降低,门静脉淤血指数增大,且变化程度依赖于肝纤维化程度。肝脏由25%肝动脉供血和75%门静脉供血,下腔静脉压力、门静脉内压力的压力梯度差是其主要动力,肝纤维化时,汇管区及肝小叶内大量纤维组织增生,造成阻力增高,使门静脉压力差降低,流速减缓,亦可出现双向血流[15]。随着肝纤维化程度加重,门静脉的血液动力学改变,瘀血指数增加。以上生理病理变化使肝纤维化患者与无肝纤维化患者的CI、mPVm明显不同,因此两者可能有助于诊断肝纤维化。故本研究采用了ROC分析,结果显示mPVm诊断CHB肝纤维化的AUC为0.821,CI诊断CHB肝纤维化的AUC为0.789,其中mPVm的可靠性更高,可为临床选取合适指标诊断疾病提供参考。同时mPVm≤20.98 cm/s、18.43cm/s、16.61 cm/s,分别提示患者肝纤维化分期为S1、S2、S3的可能性较大,CI>0.05、0.06、0.08时,分别提示患者肝纤维化分期为S1、S2、S3的可能性较大,这不仅有利于诊断肝纤维化,还能区分肝纤维化的分期。本研究结果中,组间sVm、sVBF、mPBF比较未见明显差异,可能是门静脉的血流量由门静脉管腔横截面积与血流平均速度决定,门静脉管径增加的同时,平均血流速度下降,二者中和使门静脉的血流量无明显改变[16]。而脾静脉血流参数无明显改变可能与脾静脉循环血流动力学变化受较多因素影响有关,或者与本研究的病例数较小有关。
FibroScan技术以瞬时弹性成像为原理,在超声基础上,对肝脏某一部位的组织进行瞬时弹性测定,利用肝脏纤维化与肝脏硬度之间的相关性,通过FibroScan振动器产生弹性剪切波定量检测肝硬度,评估肝脏纤维化情况[17]。既往资料显示,FibroScan技术诊断肝纤维化及纤维化程度具有较高的效能[18],且与金标准肝组织活检相比,具有可重复、快捷、无创、方便等优势。在病毒性肝炎感染病程中,由肝脏慢性炎症病毒携带者到慢性病毒性肝炎,再到肝纤维化、肝硬化,所测得的LSM差异明显,并呈逐渐增加趋势[19]。本研究显示,观察组LSM高于对照组,且LSM数值与肝纤维化分期呈正相关,与既往报道[20]一致,提示LSM可用于诊断肝纤维化及区分肝纤维化分期。后续的ROC分析显示,LSM诊断肝纤维化的AUC为0.833,截断值>8.88 kPa、10.38 kPa、11.96 kPa时,鉴别不同分期肝纤维化的AUC亦都在0.8以上,呈现出较高的应用价值,当个体LSM大于以上截断值时,有足够的阳性证据诊断患病。Wu等[21]报道显示,LSM诊断肝纤维化的AUC为0.860;Ye等[22]发现,在校正了脂肪变性和炎症活动后,LSM诊断肝纤维化的AUC为0.861,均略高于本研究的0.833,再次佐证了LSM的价值。造成AUC差异的原因一方面可能与纳入病例肝纤维化程度不同有关,另一方面可能与样本量有关。
mPVD、SVD是二维超声指标,可反映静脉管径变化,mPBF、mPVm、CI、sVm、sVBF是彩色多普勒超声指标,可反映血流动力学信息,LSM是超声弹性成像指标,可反映肝组织的硬度,对以上指标进行检测能较全面评估肝纤维化情况。且本研究采用流程图进行分析,初步建立了诊断的流程模型,可为研究结果应用于个体提供参考,但不足之处在于仅分析了ROC中AUC最大的指标,且纳入研究的样本较小,仍需后续研究的进一步验证。
综上所述,采用彩色多普勒超声与FibroScan定向瞬时弹性成像系统检测SVD、mPVD、CI、mPVm、LSM等参数可诊断CHB肝纤维化,各参数均与肝纤维化程度密切相关,有望成为评估肝纤维化及严重程度的无创性检测方法。
