新型二维层状纳米材料的抗菌研究进展
2021-01-19郑云飞贾绮林张斐然
周 璇,郑云飞,贾绮林,张斐然
(北京大学口腔医院,北京 100081)
抗生素作为20世纪医学史上最伟大的发现之一,迄今为止已经挽救了无数人的生命。但是由于近年来人们对抗生素使用的认知不足,抗生素滥用情况严重,全球每年约70万人死于抗生素耐药。抗生素的耐药机制主要包括两方面:第一,通过抗生素靶标基因的突变来降低药物与靶标蛋白的亲和力;第二,通过外排泵的过表达、细菌质膜通透性的改变或者产生灭活抗生素的酶来降低细胞内抗生素的浓度[1]。针对抗生素耐药的现状,根据世界卫生组织(WHO)的报道,如果耐药菌无法得到很好的控制,预计到2050年由抗生素耐药导致的死亡人数将增加至每年1000万人[2]。上述事实表明新型抗菌药物的开发刻不容缓,而随着生物纳米技术的发展,二维层状纳米材料有望成为处理耐药菌的替代选择。
二维层状纳米材料是指在某一维度厚度为0.1~100 nm,而在另一维度上可以无限延伸的材料,主要包括石墨烯及其衍生物(GMs)、过渡金属硫化物(TMDs)、层状双氢氧化物(LDHs)及MXenes等[3]。二维层状纳米材料与其他零维或者块状材料相比,在抗菌应用上具有多项优势。首先,二维层状纳米材料具有超大的比表面积,可以作为抗菌药物的合适载体。其次,二维纳米材料具有出色的电子、光学及热学性能,使其可以通过物理或化学途径杀灭细菌,大大降低细菌耐药性的产生。本文通过对各类二维层状纳米材料抗菌活性及抗菌机制的阐述,旨在帮助促进具有高抗菌活性和出色生物安全性的新型二维层状纳米材料的进一步研发。
1 石墨烯及其衍生物的抗菌研究进展
石墨烯是由许多sp2杂化碳原子组成的具有六角形晶体结构的二维纳米片层,其单层厚度仅有0.335 nm[4]。在石墨烯及其衍生物的研究中,目前以氧化石墨烯(GO)和还原氧化石墨烯(rGO)作为抗菌材料居多。氧化石墨烯(GO)的sp2碳片层结构和含氧官能团(如羧基,羟基和环氧基)使其具有特别的物理化学性能,如优异的导热性、电子传递特性和光学特性,高比表面积、高催化活性等[5]。因此石墨烯材料在抗菌领域具有极好的应用前景。
Liu等[6]以大肠杆菌作为指示菌种,评估4种石墨基材料——石墨(Gt)、氧化石墨(GtO)、氧化石墨烯(GO)和还原氧化石墨烯(rGO)的抗菌性能。结果表明,在相同条件下,等浓度(40 μg/mL)的Gt,GtO,GO和rGO与大肠杆菌共孵育时,氧化石墨烯(GO)表现出最高的抗菌活性(69.3%),且石墨烯基材料的抗菌活性与其浓度呈正相关,随着GO或rGO浓度的增加,大肠杆菌的活力逐渐降低。扫描电镜图像显示,当细菌与GO或rGO直接接触后,细菌胞膜表面即产生膜应力,从而导致细菌胞膜结构破坏、细胞内容物泄漏。此外,在氧化应激实验中发现这4种材料均可以氧化谷胱甘肽,但未检测到活性氧(ROS)的产生,且电导率高的rGO和Gt比绝缘的GO和GtO具有更好的氧化能力。因此,作者提出石墨烯基材料的“三步”抗菌机制:首先细菌黏附于材料表面,然后通过石墨烯纳米片的锐利边缘刺破细胞膜,最后通过氧化应激反应破坏细菌的重要组分而导致细菌死亡。
石墨烯的抗菌活性源于其特有的理化特性,故其抗菌性受多种因素的影响,例如石墨烯基材料的横向尺寸、层数、表面化学性质等。目前已提出的抗菌机制主要包括物理杀菌和化学氧化应激杀菌。
Tu等[7]从分子动力学角度展示了石墨烯诱导的大肠杆菌细胞膜破裂的两种物理作用机制:(1)通过纳米片边缘直接的物理切割;(2)通过破坏性地提取脂质分子,即悬浮在细菌胞膜上方的石墨烯纳米片可以在几十到几百纳秒内插入到大肠杆菌的内外膜中,通过大量提取细菌胞膜中的磷脂成分而使细菌迅速裂解死亡。除了边缘切割及提取脂质分子作用外,石墨烯纳米片的平面在抗菌过程中也起着至关重要的作用。例如,巨大的石墨烯基纳米片通过包裹细菌使其与外界养分隔绝而达到灭菌效果。Liu等[8]研究了氧化石墨烯(GO)的横向尺寸对大肠杆菌抗菌活性的影响。结果发现,GO纳米片的抗菌能力与其横向尺寸大小呈正相关,横向尺寸较大的GO纳米片显示出更强的抗菌活性。较大尺寸的GO纳米片(40 μg/mL)与大肠杆菌孵育1 h即可导致89%的细菌死亡。作者还发现具有不同横向尺寸的GO纳米片对谷胱甘肽的氧化能力是相似的,这表明不同大小的GO纳米片的抗菌能力不是由其氧化能力的差异所决定。在原子力显微镜下观察到较大的GO纳米片更容易覆盖细胞,细菌被完全覆盖后即与外界环境隔离开来,导致其营养被剥夺从而无法增殖;而较小的GO纳米片无法有效地将细菌与环境隔离,因此抗菌活性较低。此外,石墨烯基材料的层数也影响其抗菌性能。Mangadlao等[9]使用Langmuir-Blodgett(LB)技术将GO纳米片逐层沉积于聚对苯二甲酸乙二酯(PET)基板上,观察到材料的抗菌活性随着层数的增加而增加,相较于二层和单层,三层GO纳米片表现出最高的抗菌活性(89%)。作者认为通过LB技术将包含边缘在内的整个GO纳米片固定于基板表面,消除了其刺穿和包裹细菌的可能性,因此该研究中的GO抗菌活性主要依赖于纳米片平面的杀菌特性。Dallavalle等[10]从分子动力学角度说明了较大的石墨烯纳米片平面可直接铺展于细胞膜表面,造成脂质分子被翻转从而对胞膜造成破坏。
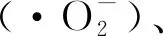
由于石墨烯材料具有高比表面积,在低能量激光照射后具有优异的光催化活性,不仅能够高效地将光能转换为热能,同时还能产生活性氧,达到光热和光动力协同杀菌的效果。且细菌无法通过对纳米小分子的摄取减少或者外排增加来抵抗石墨烯基材料的抗菌作用,因此光动力和光热抗菌治疗相对比于传统的抗生素疗法更不易产生耐药性。Tan等[16]研究了在低能量激光的照射下,还原型氧化石墨烯/银(rGO/Ag)复合纳米材料对大肠杆菌及多重耐药菌肺炎克雷伯氏菌的抗菌性能及其机制。结果显示,在未经激光照射的rGO/Ag复合纳米材料治疗的组中,大肠杆菌的生存率仅降低到约35%;而在激光照射后,大肠杆菌的生存率降低到约1.8%。当rGO/AgNPs溶液暴露于激光照射10 min后,溶液的温度迅速升高。在荧光核酸染料标记受损菌膜的实验中显示在引入rGO/Ag纳米复合材料的光热效应时,细菌胞膜受损更明显。特定浓度的rGO/Ag复合纳米材料可通过光热效应达到100%杀灭大肠杆菌和肺炎克雷伯氏菌的效果。最近,Romero等[17]研究了在波长为630 nm的LED光下GO的抗菌光动力和光热效应。作者通过DPBF检测证实了GO在光激发下产生大量单线态氧(1O2),同时在光热温度测量中证实了在65 mW/cm2的光照射约16 min时GO水溶液可达到55~60 ℃。在光热效应(PTT)/光动力效应(PDT)的双重作用下,高剂量光照后GO可达到完全消除大肠杆菌和金黄色葡萄球菌的效果。
综上所述,石墨烯及其衍生物的抗菌机制可以总结为以下5点[18]:(1)物理切割途径,即细菌与石墨烯基材料直接接触后,材料锋利的片层刺穿细菌胞膜,引起细胞内容物的流出,而杀死细菌;(2)氧化应激途径,即细胞膜与石墨烯基材料直接接触后,通过电荷的转移或ROS的产生,刺激自由基反应,从而破坏细菌的膜结构及重要的生物大分子而死亡;(3)破坏脂质分子途径,即石墨烯纳米片可在短时间内插入细菌胞膜中,抽取其中的磷脂成分,或者直接铺展于胞膜表面引发脂质分子翻转,最终导致细菌裂解死亡;(4)营养剥夺途径,即大面积的石墨烯基纳米片覆盖在细菌表面,通过“包裹”的方式使细菌与周围环境隔离,造成营养剥夺,从而抑制细菌生长;(5)光热/光动力效应,即当石墨烯基材料与光照结合时,利用其优异的光催化活性,在细菌局部产生活性氧自由基和释放热量,达到光动力学和光热灭菌效果。
尽管石墨烯基材料具有有效的抗菌活性,但仍有一些特性限制了其实际应用。例如,石墨烯在电解质溶液中会发生不可逆的聚集或者被氧化,从而限制了其在日常条件下的储存。此外,高浓度的石墨烯基材料在生物体中存在一定的毒性。Ag,Cu,Sn等无机纳米材料和一些有机聚合物等也存在抗菌效率较低或生物相容性较差等问题。如表1所示,目前已有大量研究通过合成多种石墨烯基纳米复合物以增强材料的抗菌活性并提升其生物相容性。由于石墨烯基材料具有巨大的比表面积,丰富的可修饰官能团和独特的2D结构,这些特性保证了其与多种材料有效结合。每种材料都有其局限性,但我们可以通过形成石墨烯纳米复合物来克服。最近,Jian等[19]制备出一种聚六亚甲基胍盐酸盐结合氧化石墨烯(MGO)的聚氨酯(TPU)多孔膜作为抗菌伤口敷料,其具有良好的生物相容性、优异的水蒸气透过率和持久的广谱抗菌性能。在体内实验中,作者将50 μL大肠杆菌和金黄色葡萄球菌混合滴加至皮肤伤口表面,建立小鼠感染伤口模型。在伤口愈合过程中,与无菌伤口空白组、无菌纱布覆盖的对照组、PHMG-TPU处理组及GO-TPU处理组相比,MGO-TPU复合多孔膜可为伤口提供相对无菌的环境,并在伤口愈合过程中促进上皮形成,从而显著加快感染伤口的愈合速度(见图1)。

表1 石墨烯基纳米复合物的抗菌研究[20-29]

图1 不同处理组小鼠感染伤口的照片[19]
2 过渡金属硫化物的抗菌研究进展
过渡金属硫化物(transition-metal dichalcogenides,TMDs)是一组化学式为MX2的层状化合物,其中M是周期表第4至10组(通常是Mo,W等)中的过渡金属元素,X是硫属元素(S,Se,或Te),TMDs在结构上类似于石墨烯。鉴于Mo是人体内某些酶中必不可少的微量元素,而S是蛋白质中常见的生物元素,因此MoS2是所有TMDs在生物医学应用中的最佳选择。MoS2在其结构上类似于“S·Mo·S”的三明治夹心结构,即中间一层Mo原子夹在两层S原子层之间,层与层之间通过范德华力结合[30](见图2)。MoS2具有3种形式的晶体结构,分别为1T,2H和3R,其中2H型在自然状态下最为稳定[31]。MoS2纳米片特有的层状结构因具有超高比表面积及大量活性位点,在光催化及其抗菌领域中具有广阔应用潜力。
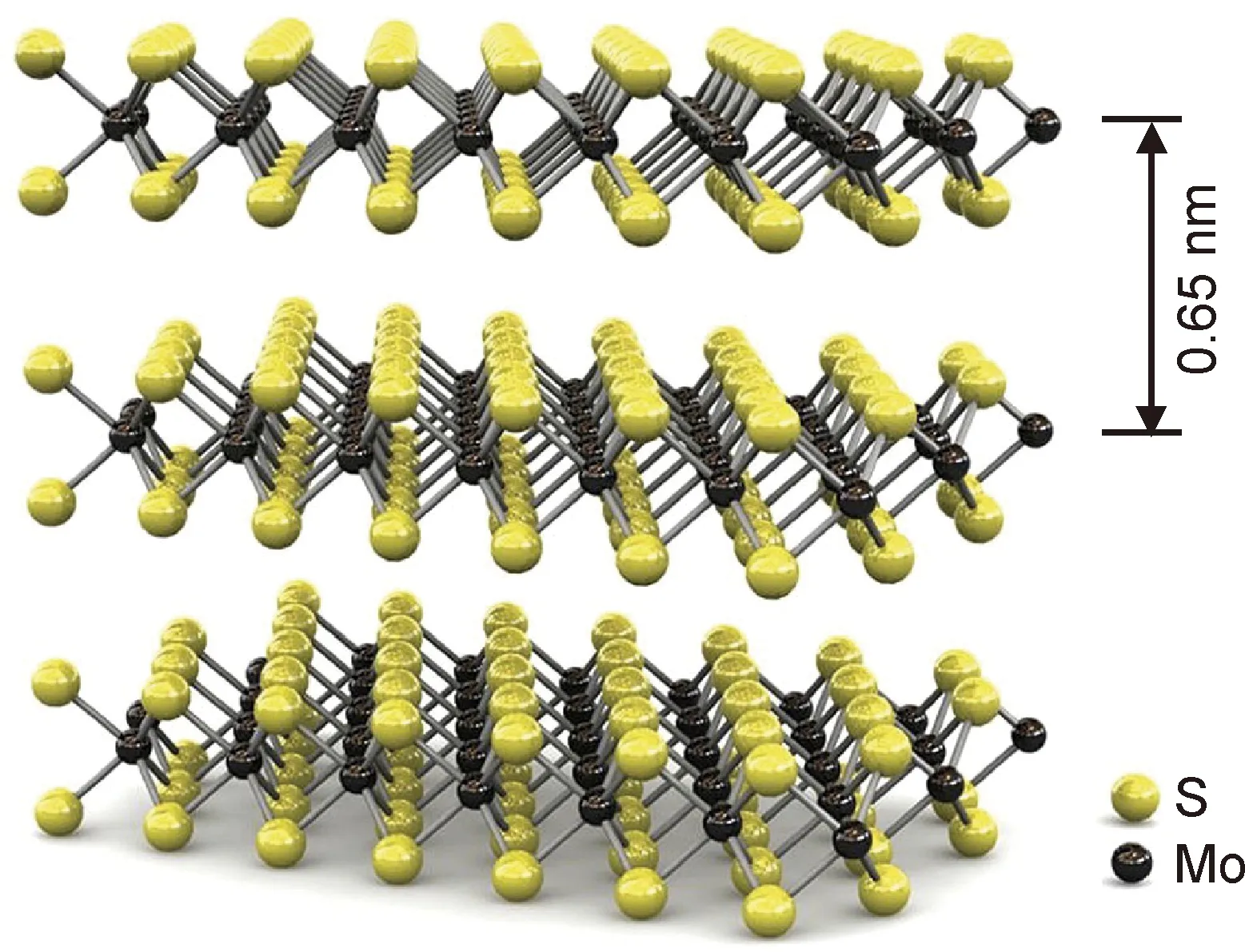
图2 MoS2纳米片的三维模式图[27]
2014年,Yang等[32]首次提出MoS2纳米片具有良好的抑菌性能。研究结果表明,通过化学剥落法获得的MoS2纳米片比其母体MoS2粉末具有明显更强的抗菌活性。为探究MoS2纳米片的抗菌机制,作者通过实验得出MoS2纳米片可以产生ROS,且其对细菌中谷胱甘肽的氧化水平与材料孵育时间和浓度呈正相关。研究认为,MoS2纳米片的抗菌作用是由两部分组成,一方面源于MoS2纳米片-细菌接触所引起的膜应力,另一方面源于ROS依赖及非依赖性途径引起的氧化应激。Wu等[33]也观察到MoS2纳米片可以通过氧化应激及膜损伤来产生抗菌效应。随着MoS2纳米片浓度的增加,大肠杆菌的存活率降低,乳酸脱氢酶的释放增加,且细胞内活性氧的浓度也急剧增加。代谢组学分析表明,高浓度的MoS2纳米片(100,1000 μg/mL)可显著影响大肠杆菌的代谢活性,包括甘氨酸、丝氨酸和苏氨酸代谢、蛋白质生物合成、尿素循环和丙酮酸代谢。Tang等[34]将垂直排列的MoS2纳米片涂覆于钛基底上。尽管其在黑暗条件下对大肠杆菌和金黄色葡萄球菌均具有明显的抗菌活性,但抗菌机制不同。金黄色葡萄球菌与各种MoS2涂层的样品一同孵育时会产生不同大小的抑菌圈,但大肠杆菌与其共同孵育时,未产生抑菌效果。这表明MoS2涂层对金黄色葡萄球菌具有离子释放杀伤作用,但释放的离子不会损伤大肠杆菌。因此实验中大肠杆菌仅可被MoS2纳米片所诱导产生的ROS杀死,而ROS和MoS2涂层所释放的离子两者均可以对金黄色葡萄球菌产生杀伤效应。此外,实验中将铁元素掺杂到MoS2纳米片中,可触发Fenton样反应以促进ROS的产生而增强涂层的抗菌活性。因此作者提出为提高MoS2在较低浓度下的杀菌效果,可以采用以下策略:(1)材料表面官能化;(2)装载抗菌药物;(3)充分利用其光催化活性的优势。
Pandit等[35]通过使用不同电荷的硫醇配体对MoS2纳米片进行表面官能化。其中在带正电荷配体的MoS2纳米片中,通过改变烷烃链的长度赋予配体不同的疏水性能。由此研究表面官能化的MoS2纳米片对革兰氏阳性耐甲氧西林金黄色葡萄球菌(MRSA)和革兰氏阴性铜绿假单胞菌的抗菌性能。结果表明,由于细菌表面带负电荷,带正电荷配体的MoS2纳米片可以有效地使细菌附着于材料表面,从而增强了氧化应激对细菌的影响。随后,当在带正电荷配体的MoS2纳米片上引入更长的烷烃链时,由于长烷烃链与细菌胞膜之间优异的疏水作用,使得细菌的胞膜快速去极化,从而导致细菌迅速死亡。此外,本次实验还表明表面官能化的MoS2纳米片比未修饰的MoS2纳米片产生更少的活性氧。因此作者认为未修饰的MoS2纳米片主要通过产生ROS起抗菌作用,而本次表面官能化的MoS2纳米片则通过不依赖ROS的氧化应激和细胞膜去极化两方面的协同机制发挥有效抗菌活性。Begum等[36]合成了蜂胶抗菌肽(AMP)和MoS2纳米片的组合抗菌剂,该组合物通过光热疗法(PTT)、光动力疗法(PDT)和抗菌肽的协同作用,达到100%灭活耐多药细菌(耐甲氧西林金黄色葡萄球菌、耐药性大肠杆菌、肺炎克雷伯菌)的效果。该实验表明,单独使用低能量激光照射MoS2纳米片时,通过产生光热和光动力效应仅可杀灭45%的耐多药细菌;单独使用蜂胶抗菌肽(AMP)时,通过靶向破坏细菌胞膜仅可杀灭20%的耐多药细菌;但在两者协同作用时,蜂胶抗菌肽(AMP)首先在耐多药菌胞膜表面形成小孔,随后在激光触发的PDT和PTT期间,小孔将有助于有效扩散热量和ROS,达到协同多峰杀菌效果。最近,Zhang等[37]设计了CuS@MoS2纳米复合物水凝胶,发现其在660 nm可见光和808 nm近红外光双激光照射下可以短时间内杀死99.3%的大肠杆菌和99.5%的金黄色葡萄球菌。CuS和MoS2在紫外到近红外区域都具有很强的吸收峰,从而在材料表面形成光激发和等离子体激元诱导的电子和空穴,累积的电子与O2结合形成1O2,空穴直接转化为·OH,两种活性氧通过氧化细胞内的蛋白和脂质来破坏细菌胞膜和细胞壁。同时,在光催化过程中,材料表面通过等离子体激元共振产生大量的热量,升高的温度既降低了细菌活性也提高了细菌胞膜的通透性,使ROS可以更容易渗透到细菌内发挥氧化应激作用,从而导致两种细菌在15 min内即被有效杀死。此外,为了评估CuS@MoS2纳米复合物水凝胶在双激光照射下的实际抗菌性能,作者建立了小鼠皮肤伤口感染模型。结果表明与无菌敷料处理组及单纯水凝胶处理组相比,CuS@MoS2水凝胶处理组显示出更佳的抗菌效果,小鼠伤口愈合速度明显加快。ROS的产生在此愈合过程中起着重要作用。
3 层状双氢氧化物的抗菌研究进展

LDHs化学惰性高,因此具有良好的生物相容性,可在生物医学领域进行广泛应用。例如,其中一种称为“水滑石”的LDHs,其成分为Mg6Al2(CO3)(OH)16· 4H2O,能够有效地抑制胃蛋白酶的活性,药效显著且持久,目前已作为抗酸药商品化使用了20多年[39]。
LDHs的层板具有可调控性,许多具有抗菌性能的金属元素可以调控进入LDHs的层板中。Carja等[40]将AgNPs负载于Zn LDHs上,发现与未负载的银纳米材料相比,Ag/Zn LDHs表现出更稳定的抗菌性能。这可能是由于带正电荷的LDHs基质可以将带负电荷的细菌吸附至材料表面,从而促进了细菌与银纳米颗粒更好的相互作用。Moaty等[41]合成了Zn-Fe LDHs,并观察到其对革兰氏阴性菌、革兰氏阳性菌、超级细菌和真菌均具有持久的广谱抗菌效应。作者提出它们对细菌的致死作用可能归因于材料中正电荷的存在,活性氧·OH的释放,以及金属Zn2+的释放杀伤作用。
由于LDHs具有生物相容性好、低毒性、层板间阴离子可交换性和生物降解性等特性,将抗菌药封装在LDHs片层中,可实现药物的持续缓慢释放,从而避免了由于药物突然大量摄入而产生的毒性。Malafatti等[42]使用LDHs作为基质,将可生物吸收的聚乳酸支架与抗生素磺胺嘧啶银结合起来,以获得药物缓释抗菌系统。结果表明此抗菌系统可有效地从聚乳酸支架中输送磺胺嘧啶银抗生素。由于LDHs的嵌入,磺胺嘧啶银从支架中释放缓慢,对大肠杆菌和金黄色葡萄球菌具有明显的抑制作用。同时该材料也表现出与细胞极好的生物相容性。
另外,某些抗菌剂在暴露于光源或热源时即会失去生物活性。但是,将它们插入LDHs中后,可显著提高抗菌剂的化学稳定性/光稳定性。Tang等[43]将DL-扁桃酸通过阴离子交换反应嵌入到Zn-Al LDHs中,DL-扁桃酸(MA)是一种α-羟基酸,具有抗光老化,色素沉着和抗菌等用途,但对光、热和碱非常不稳定,很容易分解为无生物活性的化合物。实验数据表明,相对于纯MA,ZnAl-MA LDHs系统具有较好的热稳定和光稳定性,并通过药物的缓释,达到一定的抑菌效果。
此外,LDHs可与抗生素结合构建药物纳米平台,以对抗传统的抗生素耐药菌。因此LDHs是一种具有广阔应用前景的药物载体。Komarala等[44]建立了头孢噻肟负载的LDH-胡芦巴(CLF)纳米复合物,药物动力学结果表明,药物在纳米复合物中呈持续释放模式,72 h内的药物释放量约为80%。抗菌结果表明,该纳米复合物对产广谱β-内酰胺酶的大肠杆菌(E.coliESBL)可达到98%的灭菌率。其可能机制在于LDH-CLF纳米复合物作为头孢噻肟的隐身载体,在进入细胞时才释放药物分子,阻止了细菌分泌的β-内酰胺酶对抗生素的降解,进而有效发挥抗生素的功效。
4 Mxenes抗菌研究进展
超薄二维纳米材料(ultrathin two-dimensional nanomaterials) MXenes属于一类新兴的纳米材料,其结构通式为Mn+1XnTx,其中M代表过渡金属元素(如Sc, Ti, V, Cr, Zr, Hf, Nb, Mo, Ta和W),X代表C或N元素,Tx代表表面的官能团(如—OH,—O或—F),n通常为1到3的整数。这种独特的结构是由原始的块状MAX相(Mn+1AXn),经过选择性地侵蚀反应掉最活跃的组分A(ⅢA或ⅣA元素) 而得到。在Ti3C2Tx的合成实验中使用氢氟酸(HF)水溶液作为蚀刻剂,从Ti3AlC2相中除去Al,同时在片层表面形成Tx端基,并通过进一步的超声分层而获得单层Ti3C2Tx。MXenes被侵蚀后具有片层状结构,其横向尺寸>100 nm,但厚度仅有一个或者几个原子厚[45]。由于MXenes二维材料具有比表面积高、离子电导率大、亲水性好等优势特征,在能量存储、传感、催化以及生物医学等领域展现出了巨大的潜力[46]。其中在生物应用上,MXenes因其出色的光热性能、多峰成像能力和良好的生物相容性,已被用于癌症治疗研究中[47]。然而,迄今为止仅有少数报道证明了MXenes的抗菌活性。
Rasool等[48]研究测试了Ti3C2Tx对大肠杆菌(E.coli)和枯草芽孢杆菌(B.subtilis)的抗菌性能。结果显示,与氧化石墨烯(GO)相比,Ti3C2Tx对革兰氏阴性大肠杆菌和革兰氏阳性枯草芽孢杆菌均显示出更高的抗菌效率。Ti3C2Tx对两种细菌均可达到98%以上的灭菌效果。Agnieszka等[49]观察到MXenes的抗菌活性可能受原子化学计量比的影响。实验结果表明,Ti3C2TxMXene可以抑制细菌的生长,这与以前的报道一致。但是Ti2CTxMXene则没有抑菌能力。在使用X射线光电子能谱检测时发现Ti3C2Tx和Ti2CTx二者的表面能态分布相似。因此作者认为,原子级的结构差异可能是影响具有不同化学计量比的MXene抑菌能力的主要因素。Arabi等[50]研究了在黑暗环境中,0.09,0.35,0.57 μm和4.40 μm 4种横向尺寸的MXene纳米片对大肠杆菌和枯草芽孢杆菌的抗菌性能。分析证实,MXene纳米片的抗菌活性与其横向尺寸大小成负相关,而与材料暴露时间呈正相关。较小的纳米片对两种细菌具有更高的抗菌活性,其可在不到3 h内显著破坏细菌,导致细胞中的DNA从胞质中释放出来。作者认为纳米片的锋利边缘与细菌胞膜表面之间的直接物理切割作用是MXene纳米片的关键抗菌机制。然而迄今为止,有关MXenes杀菌机理和其他抗菌特性的研究还较少,MXenes的抗菌潜力仍有待开发。
5 关于二维层状纳米材料的抗菌应用总结与展望
本文主要总结了石墨烯、过渡金属硫化物(TMDs)、层状双氢氧化物(LDHs)、及Mxenes这4类二维纳米材料的抗菌研究现状。具体而言,石墨烯及其衍生物是目前最常用的抗菌二维材料,材料本身即具有抗菌活性。其抗菌性能主要取决于以下3个因素:表面官能团、横向尺寸及其衍生物的种类。目前文献中介绍的石墨烯抗菌机制主要包括物理切割、氧化应激、磷脂抽取、营养剥夺及光动力和光热效应。过渡金属硫化物目前基本以研究MoS2纳米片为主。MoS2纳米材料本身也具有一定的抗菌活性,抗菌机制与石墨烯相似,目前大多数研究主要通过以下3个方面进一步提升其抗菌性能:表面官能化、装载抗菌药物及利用其高效光催化活性所触发的光热和光动力组合。关于层状双氢氧化物,少有研究表明其能直接抑制细菌生长,但是层状双氢氧化物特有的空间结构及其优异的生物相容性决定了它可以作为抗菌药物理想的载体,以实现抗菌药物的缓释、提高抗菌药的化学/光稳定性,同时使传统的抗生素对抗耐药菌成为一种可能。MXenes作为一种新型二维层状纳米材料,关于其抗菌性能的研究目前非常有限。尽管存在各种类型的MXenes,仅Ti3C2Tx已被证明具有抗菌活性,MXenes的杀菌机理仍知之甚少。
尽管本文重点介绍了4种类型的2D材料抗菌特性,但二维层状纳米材料是一个庞大的家族。其他一些2D材料例如六方氮化硼(BN),2D金属氧化物和2D高岭石等也成为新兴的潜在抗菌剂。随着新型材料的不断涌现,二维层状纳米材料的抗菌研究还在不断拓展。同时现有的2D材料作为抗菌剂也存在一些问题。例如在自然环境下,2D材料会不可逆地聚集或者被氧化,特征性的二维结构将遭到破坏,从而限制其在日常条件下的储存与应用。因此迫切需要开发合适的封闭剂以增强其稳定性并探索出2D材料的适当存储条件。与此同时,二维层状纳米材料的生物安全性也是一个不可忽视的问题。已有研究发现高浓度的石墨烯进入小鼠体内后会发生肺部病变[51]。尽管从现有研究中我们可以认识到石墨烯、过渡金属硫化物(TMDs)、层状双氢氧化物(LDHs)及Mxenes具有抗菌活性且几乎不存在耐药性,但是这些2D材料单独用于体内抗菌时浓度仍然相对较高,因此可以将2D材料与抗菌药物结合起来以达到协同抗菌的效果。目前已发现一些传统的抗生素非常适合与2D材料结合使用,如LDH-CLF纳米复合物可作为头孢噻肟的隐身载体克服细菌对头孢噻肟的耐药性,从而达到有效抗菌。抗生素与2D材料的结合将会在对抗耐药菌方面具有极大的应用潜力。其次,二维层状纳米材料具有引人注目的光学性能,在白光和近红外光下可产生的光动力和光热杀菌效应。基于2D材料处理动物感染伤口模型的现有数据表明,2D材料具有治疗局部皮肤感染的强大潜力。由于光源和材料仅暴露于伤口中细菌聚集的部位,因此不会对体内正常菌群产生影响,且可以在伤口局部有效控制感染,促进皮肤伤口愈合。此外,利用2D材料的光催化抗菌特性,可制成抗菌涂层,实现简易的原位消毒,有望在将来应用于无菌医疗设备中。但是目前将二维纳米抗菌材料应用于实际临床中仍需要大量实验的支持,将其作为新一代有效抗菌剂需要多学科专家学者的共同研究与协作。
