芝麻素通过Wnt/β-catenin通路调控大鼠骨髓间充质干细胞成骨细胞分化预防骨质疏松的作用研究
2021-01-19马忠平杨云张志峰叶楠杨毅峰
马忠平 杨云 张志峰 叶楠 杨毅峰
内蒙古医科大学第二附属医院关节外科,内蒙古 呼和浩特 010030
骨质疏松被定义为以骨骼强度降低、骨折风险增加为特征的一类骨骼疾病。骨质疏松通常伴有轻微症状或无症状,是临床病理性骨折的常见原因,也是影响人类健康的高危因素之一[1]。相关研究报道,世界范围内骨质疏松的发病率在超过50岁人群中为15%,在80岁以上的人群中为70%[2-3]。骨质疏松的发病率具有性别特异性:与男性相比,女性的发病率更高[4],2%~8%的男性和9%~38%的女性受到来自骨质疏松的不同程度的影响[5]。研究指出,美国近1 000万人患有骨质疏松,超过1 800万人骨量低[6]。而据国际骨质疏松基金会预测,至2050年将有超过50%的骨质疏松性骨折发生在东亚和东南亚[7]。且由于绝经后雌激素水平降低对骨量的影响,老年妇女中骨质疏松的发病率将快速且持续上升[8]。
骨髓是人体的主要造血器官,由骨髓造血干细胞、骨髓脂肪组织和基质细胞组成[9]。成骨细胞由骨髓间充质干细胞(BMSCs)分化而来,在骨形成中具有重要作用。研究指出,与正常人相比,骨质疏松患者成骨分化低于正常,由此可知成骨细胞分化水平与骨质疏松病理过程的发生、发展与演变密切相关[10]。Wnt/β-catenin是常见信号转导通路,参与控制条件多种生物现象[11-12]。成骨细胞分化已被证实受Wnt/β-catenin途径的调节[13-15]。研究指出,成骨细胞的分化过程中同时受到一系列蛋白调节,如碱性磷酸酶(alkaline phosphatase, ALP)、成骨相关转录因子抗体(osterix,OSX)、SRY-box 9(SOX9)、Runt相关转录因子2(recombinant runt related transcription factor 2,RUNX2)、骨钙素(osteocalcin,OCN)[12]。目前未见研究报道并探讨成骨细胞分化过程中Wnt/β-catenin信号通路与相关调节蛋白的相互关系。
芝麻油常用于膳食中的营养补充[16-17]。芝麻素是一种从花椒植物中分离而来的木脂素,是芝麻油中的一种常见成分(约含0.25%)。天然芝麻素为右旋体,芝麻素亦可人工化学合成。Orawan等[18]证实芝麻素可以通过激活p38-ERK(extracellular signal-regulated kinases)/MAPK(mitogen-activated protein kinase)细胞信号传导通路来促进人类胎儿成骨细胞增殖以及人类脂肪来源干细胞的成骨分化。由此可知,芝麻素与成骨细胞分化密切相关,在骨质疏松的预防和治疗中可能发挥重要作用,然而,芝麻油作用于BMSCs进而影响骨形成的具体机制尚不十分清楚,其对骨质疏松的作用影响也鲜有研究。
本研究应用芝麻素干预大鼠股骨分离的BMSCs,在沉默Wnt/β-catenin或不沉默Wnt/β-catenin的情况下检测BMSCs的成骨分化,进而分析芝麻素对骨质疏松的作用。
1 材料和方法
1.1 芝麻素制备
芝麻素(S9314;Sigma-Aldrich LLC.,USA)使用二甲基亚砜(DMSO;Sigma)溶解为14.22 mmol/L的溶液,并储存于-20℃。
1.2 Wnt/β-catenin信号通路阻断剂制备
FH535(Sigma)溶解于浓度为10 mmol/L的二甲基亚砜(sigma)中,保存在-2℃。
1.3 细胞培养
SD大鼠(4周龄)购自内蒙古医科大学第二附属医院医学实验动物中心。所有动物实验均按照“实验动物护理原则指南”(NIP出版物85-23,1996年修订)进行,并经内蒙古医科大学实验动物伦理委员会批准(项目编号为2017032,日期为2017年7月15日)。
由大鼠股骨分离BMSCs,将大鼠股骨与周围软组织分离并取出。使用a-Minimum Essential培养基(a-MEM;Thermo Fisher Scientific,Ltd,上海,中国)洗涤骨髓。将骨髓切片,用含有10%胎牛血清(FBS;Thermo)、100 U/mL青霉素和10 mg/mL链霉素(Sigma)的α-MEM培养。去除未贴壁的细胞,贴壁的BMSCs用于培养和扩增以及进一步的实验。当细胞培养汇合率接近90%时,贴壁的BMSCs传代。之后将2~4代BMSCs用于研究实验。
1.4 骨髓间充质干细胞的成骨分化
BMSCs种植于6孔细胞培养板,细胞密度为1×104个/孔(康宁公司,上海,中国)。经含10%胎牛血清、50 μmol/L抗坏血酸(Sigma)、0.1 μmol/L DMSO和10 mmol/Lb-甘油磷酸酯(Sigma)的α-MEM诱导骨髓间充质干细胞向成骨细胞分化7 d。
1.5 CCK-8检测细胞增殖/毒性以及ALP表达
BMSCs种植于96细胞培养板,细胞密度为3×103细胞/孔。24 h后,用芝麻素(0、1或10 μmol/L)处理骨髓间充质干细胞3 d,以0.1%二甲基亚砜作为阴性对照(NC)。使用Caspase-8比色分析试剂盒(Abcam PLC.,上海,中国)进行细胞毒性测定。在450 nm处测量光密度(OD)值。
BMSCs由NBT-BCIP®溶液(Sigma)染色,用于检测成骨细胞BMSCs中的碱性磷酸酶(ALP)。
1.6 免疫组织化检测Osterix(OSX)表达
BMSCs成骨分化后,以1×105细胞/孔的密度接种于带盖玻片的6孔细胞培养板中。24 h后,应用芝麻素(0 μmol/L、1 μmol/L或10 μmol/L)处理细胞3 d。之后细胞经4%多聚甲醛(碧云天生物科技有限公司,上海,中国)在25 ℃下固定30 min。用预冷的磷酸盐缓冲液(PBS)(碧云天)洗涤细胞, 25 ℃下振荡10 min,之后使用3%的H2O2/甲醇(博士德生物技术有限公司,武汉,中国)于25 ℃下孵育20 min,后使用山羊血清(索莱宝科技有限公司,北京,中国)在25℃下阻断30 min。然后与兔抗SP7/osterix(OSX)抗体(1∶100)(ab22552,abcam)在4 ℃的湿盒中孵育过夜。使用预冷的PBS洗涤细胞,后与山羊抗兔辣根过氧化物酶(HRP)偶联的二抗(1∶100)(7071,Cell Signal Technology,Inc.,上海,中国)于25 ℃孵育30 min。经二氨基联苯胺(DAB)(ZSGB-BIO,北京,中国)和苏木精(碧云天)染色后,使用树脂(索莱宝)密封载玻片并使用显微镜(BX43;Olympus Optical Co.,Ltd.,Tokyo,Japan)观察。
1.7 免疫荧光检测SRY-box9(SOX9)表达
BMSCs成骨分化后,将1×105个细胞/孔接种于6孔细胞培养板上,盖盖玻片。24 h后使用芝麻素(0、1或10 μmol/L)处理细胞3 d。细胞经4%多聚甲醛于25 ℃固定30 min。之后将细胞悬浮于PBS中并用30 mmol/L甘氨酸(Sigma)于25 ℃下淬火5 min,后经0.5%Triton-X(索莱宝)于25 ℃下渗透5 min,使用5%脱脂牛奶和2%牛血清白蛋白(BSA)(Gen-View Scientific Inc.,USA)在25 ℃下封闭1 h。应用Sox9兔单克隆抗体(1∶100;#82630,Cell signal Technology,Inc.)于25℃的湿盒中孵育细胞24 h。后使用预冷PBS洗涤细胞,并与Fluor®594山羊抗兔(1∶500;ZSGB-BIO)在25 ℃黑暗中孵育1 h。细胞经4’6-二胺基-2-苯基吲哚二盐酸盐(DAPI;Sigma)染色,由共聚焦激光扫描显微镜(FV1000,OLYMPUS)观察。使用Image-Pro Plus软件(Media Cybernetics,Rockville,MD,USA)分析结果。
1.8 Western blot检测RUNX2、OCN以及Wnt/β-catenin通路相关抗原表达
成骨细胞分化后,将1×105细胞/孔接种于6孔细胞培养板中培养24 h,后在有或无FH535(1 μmol/L)的情况下用芝麻素(0、1或10 μmol/L)处理3 d。收集细胞并使用皮尔斯TM细胞裂解液于4 ℃下裂解20 min后提取蛋白质。用10%的分离凝胶和5%的浓缩凝胶进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移蛋白质到聚偏二氟乙烯(PVDF)膜(Merch Milliporal Corporation)上。使用5%的脱脂牛奶在25 ℃下封闭2 h,后与小鼠抗RUNX2抗体(1∶5000;ab76956,abcam),小鼠抗骨钙素(OCN)抗体(1∶3000;ab13420,abcam),小鼠抗b-actin抗体(1∶5000;abcam)孵育;ab8226,abcam),兔抗低密度脂蛋白受体相关蛋白5(LRP5)抗体(1∶1000;ab38311,abcam),小鼠抗糖原合成酶激酶-3b(gsk-3b)抗体(1∶2000;ab93926,abcam),兔抗b-连环蛋白抗体(1∶5000;ab32572,abcam)分别孵育24 h。加入山羊抗兔或山羊抗鼠二抗(1∶3000;Jackson Immuno Research Laboratory,Inc.,USA),并在25 ℃下孵育1 h。使用电化学发光(ECL)分析。
1.9 统计学分析
定量资料以均值±标准差表示。应用GraphPad“PRISM”软件(版本5.0;GraphPad Software,Inc.,La Jolla,CA,USA)分析数据。单因素方差分析(ANOVA)或t检验用于分析多组或两组间的统计学差异。P<0.05表示差异有统计学意义。
2 结果
2.1 芝麻素对细胞增殖无影响且无细胞毒性
BMSCs成骨分化后用芝麻素(1 μmol/L或10 μmol/L)处理骨髓间充质干细胞,以0.1%二甲基亚砜处理后作为正常对照(NC)组。图1 A显示NC组、芝麻素(1 μmol/L)组和芝麻素(10 μmol/L)组之间的OD值,无显著差异(F=0.0683,P=0.9343)。以上结果表明芝麻素对BMSCs无有细胞增殖及毒性作用。
2.2 芝麻素通过Wnt/β-catenin通路促进BMSCs成骨分化
图1B显示了芝麻素在没有FH535(1 μmol/L)沉默的情况下对RUNX2(F=113.7,P<0.0001)和OCN(F=89.29,P<0.0001)的显著促进作用。高浓度芝麻素可显著增强RUNX2和OCN的表达(P<0.05)。FH535沉默后,芝麻素对RUNX2和OCN的促进作用均减弱。虽然其表达增加,但与NC组相比差异无统计学意义(P>0.05)。
图1C显示在没有FH535(1 μmol/L)沉默的情况下,芝麻素(1 μmol/L或10 μmol/L)对Wnt/β-catenin通路有显著的促进作用,表现为β-catenin(F=128.60,P<0.0001)和LRP5(F=191.3,P<0.0001)的显著增加以及gsk-3b的显著减少(F=69.54,P<0.0001)。较高浓度的芝麻素可进一步促进Wnt/β-catenin通路活性(P<0.05)。FH535(1 μmol/L)沉默后,Wnt/β-catenin活性受到抑制,芝麻素的干预对β-catenin、LRP5或gsk-3b的表达水平的影响无显著性。
图2显示了芝麻素对ALP(图2 A)(F=23.81,P<0.0001)、OSX(图2B)(F=73.65,P<0.0001)和SOX9(图2C)(F=139.1,P<0.0001)的显著促进作用。随着芝麻素浓度的升高,对BMSCs成骨分化的促进作用显著增强(P<0.05)。

图1 A:各浓度芝麻素处理骨髓间充质干细胞后所得的CCK8吸光度;B:阻断通路与未阻断通路状态下,各浓度芝麻素处理骨髓间充质干细胞后RUNX2和OCN的WB表达;C:阻断通路与未阻断通路状态下,骨髓间充质干细胞中Wnt/β-catenin通路相关蛋白的WB表达Fig.1 A: CCK8 absorbance of bone marrow mesenchymal stem cells treated with sesamin at various concentrations; B: Expression of RUNX2 and OCN after treatment of bone marrow mesenchymal stem cells with sesamin at different concentrations in the blocked and unblocked pathways; C: WB expression of Wnt/b-catenin pathway-related proteins in bone marrow mesenchymal stem cells under blocked and unblocked pathways.注:NC组:阴性对照组,0.1%二甲亚砜处理;1组:1 μmol/L芝麻素处理;10组:10 μmol/L芝麻素处理;与NC组比较,*P<0.05;与NC组和1组比较,#P<0.05;与NC+FH535组比较,**P>0.05。
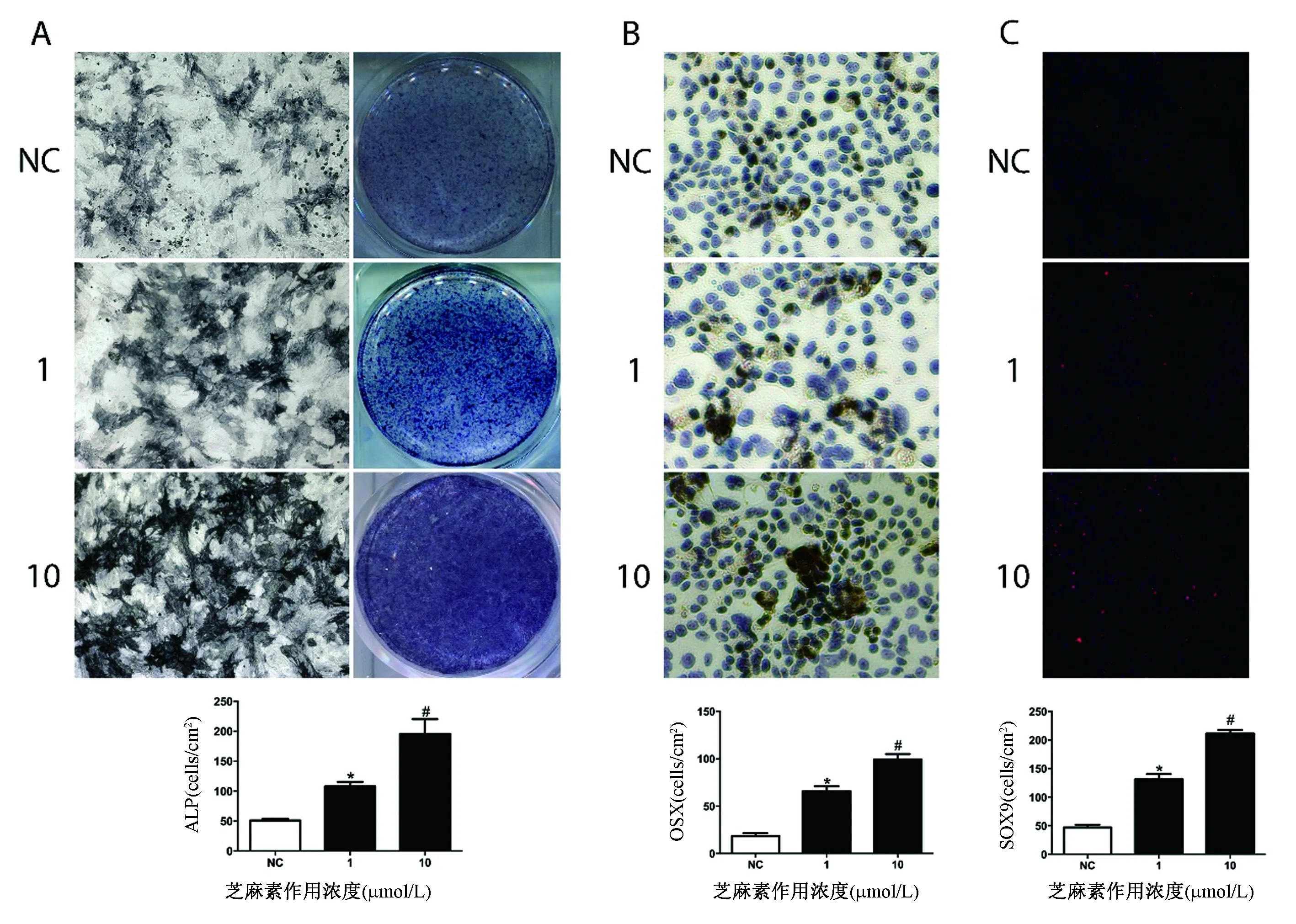
图2 A:各浓度芝麻素处理骨髓间充质干细胞后ALP的染色表达;B:各浓度芝麻素处理骨髓间充质干细胞后OSX的免疫组化表达;C:各浓度芝麻素处理骨髓间充质干细胞后SOX9的免疫荧光表达Fig.2 A: ALP staining and expression in bone marrow mesenchymal stem cells treated with sesamin at various concentrations; B: Immunohistochemical expression of OSX in bone marrow mesenchymal stem cells treated with sesamin at different concentrations; C: Immunofluorescence expression of SOX9 after treatment in bone marrow mesenchymal stem cells.注:NC组:阴性对照,0.1%二甲亚砜处理;1组:1 μmol/L芝麻素处理;10组:10 μmol/L芝麻素处理;与NC组比较,*P<0.05;与NC组和1组比较,#P<0.05。
以上结果表明,本实验条件下,芝麻素激活Wnt/β-catenin信号通路,并促进BMSCs向成骨细胞分化。
3 讨论
本研究应用不同浓度的芝麻素(1 μmol/L或10 μmol/L)干预由SD大鼠股骨分离而来的骨髓间充质干细胞,共3 d。结果表明,芝麻素处理后细胞ALP、OSX、SOX9、RUNX2和OCN的表达均显著增强。此外,10 μmol/L的芝麻素对上述蛋白表达的促进作用高于1 μmol/L的芝麻素。通过Western blotting检测Wnt/β-catenin通路表达,结果显示芝麻素对β-catenin和LRP5水平的上调,但对GSK-3b水平的下调,呈浓度依赖性。为证实Wnt/β-catenin在芝麻素促进BMSCs成骨分化中的关键作用,研究使用FH535(1 μmol/L)沉默Wnt/β-catenin,后测定相关蛋白的表达。Western blotting结果显示,沉默Wnt/β-catenin通路后芝麻素干预组与非沉默空白对照组相比,RUNX2和OCN的表达无显著差异。以上结果表明芝麻素通过调节Wnt/β-catenin途径促进BMSCs的成骨分化。
一些生物标志物已被证实在骨质疏松的发展中发挥重要作用。ALP[19]、OSX[20]、SOX9[21]、RUNX2[22-23]和OCN[23]已被证实与骨质疏松有关。与健康人相比,骨质疏松患者的ALP、OSX、SOX9、RUNX2和OCN通常较低。此外,RUNX2在调节成骨细胞和软骨细胞分化中起关键作用[24-25]。因此,ALP、OSX、SOX9、RUNX2和OCN可作为骨质疏松或成骨分化的生物标志物。先前的研究已经证明Wnt/β-catenin途径在骨质疏松的发病和进展中具有关键作用,也被认为是治疗骨质疏松的靶点[26-30]。本研究中,芝麻素处理提高了ALP、OSX、SOX9、RUNX2和OCN水平,并激活了BMSCs中的Wnt/β-catenin信号通路。以上结果表明芝麻素具有促进成骨细胞分化的能力,并具有通过调节Wnt/β-catenin途径对骨质疏松具有治疗和预防作用,故而芝麻素可能是治疗骨质疏松的新靶点。
综上,本研究初步证实芝麻素具有调节Wnt/β-catenin通路促进BMSCs向成骨细胞分化的潜能,显示了其对骨质疏松的潜在治疗和预防作用。
