人脐血间质干细胞条件培养基在受损成骨细胞中的作用与机制
2021-01-19蔡梓红何可人娄爱菊叶文斌叶苗漫宋李治黄闯曾裕威魏建国王簕
蔡梓红 何可人 娄爱菊 叶文斌 叶苗漫 宋李治 黄闯 曾裕威 魏建国* 王簕*
1.广州医科大学,广东 广州 510089 2.广州市荔湾中心医院,广东 广州 510140 3.广州医科大学附属第三医院3D打印中心,广东 广州 510150 4.广州医科大学附属第三医院骨科,广东 广州 510150
骨质疏松症(osteoporosis,OP)是一种由多病因引起的破骨细胞和成骨细胞(osteoblast,OB)失衡,以单位体积内骨量减少的代谢性骨疾病,严重影响患者生活质量[1]。目前研究发现,OP患者体内氧化还原反应失衡,机体中AOPP水平越高则单位体积内骨量越低[2]。晚期氧化蛋白(advanced oxidation protein products,AOPPs)作为氧化应激(oxidative stress,OS)的终产物之一,可以促进活性氧(reactive oxygen species,ROS)的生成[3]。因此推测OS可能与OP发生发展有密切联系,AOPPs是OP进展的重要危险因素之一。
新近研究认为,HUMSCs可在组织损伤时分泌外泌体,促进组织再生,调控炎症,抵抗OS作用[4]。单纯移植干细胞由于其在体内存活率较低[5],不能持续发挥其对OS的调控效应。因此,近来应用干细胞条件培养基进行治疗组织损伤已成为研究热点[6]。
AOPPs可导致OB凋亡,线粒体(mitochondrion)是细胞发挥正常功能,保持活性的重要结构。OS导致的细胞内ROS过量积累,可引发线粒体结构受损,最终导致细胞凋亡[7]。有报道称,干细胞来源的线粒体可以向损伤组织转移,从而起到组织保护作用[8]。因此推测,干细胞可以通过保护线粒体,继而为OB提供保护作用。本研究拟通过AOPPs刺激OB,观察靶细胞内线粒体的活性变化,探讨线粒体在OS中的作用以及HUMSCs培养基是否能为氧化损伤后的OB提供保护作用。
1 材料和方法
1.1 主要材料
人血清白蛋白(human serum albumin,HSA)、噻唑蓝(MTT)、Annexin V-FITC/Propidium lodide(PI)细胞凋亡试剂盒购自sigma公司;胎牛血清购买自Hyclone公司;DMEM低糖培养基、干细胞培养基购自Gibco公司;Mito Tracker deep Red购自Thermo Fisher Scientific公司;Caspase-3单克隆抗体购买自Santa Cruz公司。
1.2 晚期氧化蛋白的体外制备
将20 mg/mL HSA无毒溶液与40 mmol/L次氯酸(HOCL)同体积混合培养,然后室温下放置30 min,制得HSA与HOCL摩尔浓度比1∶140的AOPP。为了除去游离的HOCL,将上述制得的AOPPs在PBS无内毒素溶液中透析24 h,后用0.22 μmol/L的微孔滤膜过滤除菌后4 ℃保存备用。PBS与20 mg/mL HSA溶液同体积混合作为对照。在酸性条件下,以氯胺T为标准,测定AOPP在340 nm的吸光度值。
1.3 HUMSCs提取和条件培养基的制备
脐带来自广州医科大学附属第三医院妇产科干细胞库,实验室已建立完善的相关细胞培养鉴定方案,并发表相关文章[9]。脐带取材后用PBS反复冲洗,洗净脐动脉、静脉内残留血液。剪碎至约1 cm×1 cm×1 cm组织块,置于无菌培养皿内,加入DMEM培养基直至完全覆盖组织块,1周后换液,观察细胞形态,弃除非贴壁组织块,以后每3 d换液,观察细胞形态。细胞长至80%细胞融合度时,0.25%胰蛋白酶消化,传代培养。取第2代HUMSCs,按一定比例接种于培养皿中,当达到80%细胞融合度时,更换为含有10%胎牛血清的DMEM培养基(Fetal bovine serum DMEM Medium,FM),继续孵育48 h以后,收集培养基上清液,离心(4 000 r/min,20 min),0.22 μmol/L过滤器过滤获得条件培养基(HUMSC Conditioned Medium,CM),4 ℃保存备用。
1.4 OB的培养与鉴定及实验分组
第2代人成骨细胞由南方医科大学创伤骨科赠予,南方医科大学有完善的成骨细胞检测方法流程,并发表相关文章[10]。实验分为4组,正常对照组(Control组);AOPP刺激组(AOPP组):无血清DMEM中加入终浓度为200 μg/mL的AOPP;常规培养基组(AOPP+FM组):在FM中加入最终浓度为200 μg/mL的AOPPs;条件培养基组(AOPP+CM组):在CM中加入最终浓度为200 μg/mL的AOPPs。各组作用时间均为1 h。
1.5 OB凋亡检测
收集上述分组细胞,用预冷的PBS液重悬细胞2次,加入适量1x结合缓冲液,轻吹打以重悬细胞,调整细胞浓度为1×109/L,取100 μL细胞悬液,加入5 μL Annexin V-FITC混匀,室内温度避光孵育15 min,加入5 μL PI轻轻混匀染色。按照Annexin V-FITC/PI双染色法凋亡试剂盒说明书操作,准备好样品后,上流式细胞仪进行凋亡率检测。
1.6 Mito Tracker deep Red标记线OB内线粒体
各组培养皿内滴加同等适量无血清DMEM培养基并覆盖盖玻片进行爬片培养,当细胞长至80%融合度,洗除培养基,加入37 ℃预热的Mito Tracker Red 染色工作液,孵育15 min后使用无菌PBS轻轻洗除表面残余物,染色结束置于荧光显微镜下观察,采用Image J v1.58软件对视野下线粒体红色标记的OB进行半定量计数。
1.7 OB线粒体活性定量检测
按上述分组进行干预,收集细胞,用PBS稀释至105个/mL,采用流式细胞仪进行检测。激发光波长为488 nm,发射光波长为520~545 nm。
1.8 Caspase-3凋亡蛋白表达检测
采用Western-Blot法。取各组细胞,PBS清洗,冰上裂解,离心后取蛋白上清液,用BCA试剂盒以定量检测蛋白浓度,取25 g蛋白样品进行SDS-PAGE电泳,将蛋白转移至硝酸纤维素膜上,脱脂牛奶(5%)封闭3 h,室温封闭1 h。加入1∶1000稀释的兔抗人Caspase-3抗体,4 ℃过夜,同1∶2000稀释后二抗反应,室温孵育1 h,ECL显色,暗室曝光观察。
1.9 统计学分析
2 结果
2.1 HUMSCs条件培养基细胞形态
按本研究设立方法提取和培养可获得具有活性的HUMSCs,细胞生长情况良好(图1),HUMSCs条件培养基获得后(图1),4 ℃保存备用。实验室已建立完善的相关细胞培养鉴定方法,并发表相关文章,有成骨分化图[11]。

图1 HUMSCs培养与条件培养基收集情况Fig.1 HUMSCs culture and collection of conditioned medium
2.2 各组OB凋亡检测结果
流式细胞仪分析显示,Control组中细胞凋亡率为2.5%,AOPP组为42.5%,AOPP+FM组为32.3%,AOPP+CM组为22.3%。其中,加入CM后,可以明显降低AOPP作用下引起的OB凋亡率,并且AOPP+CM组细胞凋亡率明显低于AOPP+FM组(P<0.05)(图2)。
2.3 Mito Tracker deep Red标记各组OB内活性线粒体实验结果
与对照组相比,给予AOPP刺激后,OB内活性线粒体染色数目明显减少;在此基础上,给予FM和CM后,可以降低AOPP作用,增加OB内活性线粒体染色数目。特别是应用CM后,OB内活性线粒体染色要多于FM作用组(图3)。
2.4 OB内线粒体活性定量分析实验结果
进一步对各种条件干预后OB内活性线粒体定量分析提示,对照组中OB活性线粒体为84.2%,AOPP组为29.5%,AOPP+FM组为64.9%,AOPP+CM组为77.4%。在AOPP+CM组中,OB内活性线粒体染色率明显高于AOPP+FM组(P<0.05)(图4)。
2.5 Caspase-3凋亡蛋白表达检测实验结果
Western-Blot分析不同条件作用下,OB内Caspase-3凋亡蛋白表达水平。可见经过AOPP诱导的氧化损伤后,OB内Caspase-3凋亡蛋白表达水平明显升高,在加入FM或CM后可降低Caspase-3凋亡蛋白表达水平,其中AOPP+CM组下降最明显(P<0.05)(图5)。

图2 各组OB凋亡检测结果A:各组OB细胞凋亡百分比流式细胞图;B:各组OB细胞凋亡百分比柱形图Fig.2 Detection results of OB apoptosis in each group A: The percentage of apoptosis of OB cells in each group with flow cytometry; B: The histogram of the percentage of apoptosis of OB cells in each group注:*表示AOPP+CM组凋亡率要明显低于AOPP+FM组(P<0.05)。
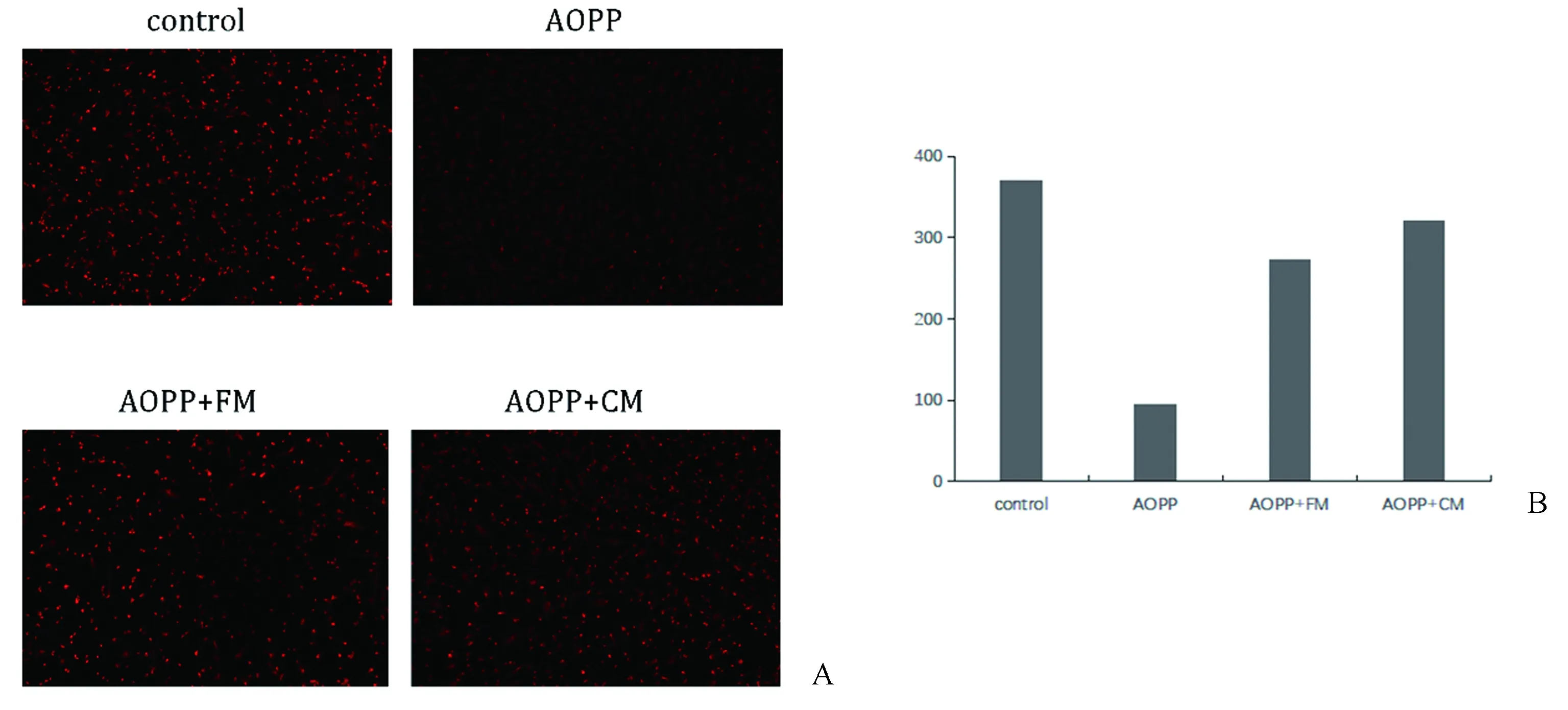
图3 Mito Tracker deep Red 标记线粒体半定量分析结果A:标记各组OB内活性线粒体实验结果,红色为活性线粒体;B:Image J细胞计数半定量分析柱状图Fig.3 The results of semi-quantitative analysis of mitochondria labeled with Mito Tracker deep RedA: The results showed that the active mitochondria in OB were marked in red; B: Histogram of image J cell count semi-quantitative analysis.

图4 OB内线粒体活性定量分析实验结果A:各组OB内线粒体活性定量分析百分比流式细胞图;B:各组OB内线粒体活性定量分析百分比柱形图Fig.4 Experimental results of quantitative analysis of mitochondrial activity in OBA: The percentage flow cytometry was used for quantitative analysis of mitochondrial activity in OB in each group; B: Column chart of quantitative analysis percentage of mitochondrial activity in OB in each group.注:*表示AOPP+CM组活性线粒体含量要明显高于AOPP+FM组(P<0.05)。

图5 Caspase-3凋亡蛋白表达检测实验结果A:Western-blot印迹图;B:Caspase-3凋亡蛋白定量分析百分比柱状图Fig.5 Experimental results of the expression of apoptotic protein Caspase-3 A: Imprint map of Western blotting; B: Caspase-3 Percentage histogram of apoptotic protein with quantitative analysis.注:*表示AOPP+CM组Caspase-3凋亡蛋白表达水平要明显水平低于AOPP+FM组(P<0.05)。
3 讨论
先前研究已经证实,OS是OP发生发展的重要因素之一,其表现主要为骨破坏的增加,影响老年人骨密度[2]。骨组织中ROS会随年龄增长而增多,通过对相关信号通路的调节,影响细胞核内基因的转录表达,引起骨重建过程中OB生成减少,骨细胞凋亡增加,破骨细胞活性增强等,介导OP的发生发展[12]。本研究证实AOPPs可诱导OB凋亡。
那么,如何才能降低AOPPs诱导下OB的凋亡率?近年来,随着对干细胞认识的不断深入,研究发现干细胞具有调节炎症作用,能降低局部OS效应,促进靶细胞功能恢复。Wang等[13]用MSCs与受氧化应激损伤的小鼠胰岛微血管内皮细胞共同培养,发现内皮细胞功能明显改善,其成活率明显提高。本研究也发现,采用HUMSCs条件培养基作用OB后,可以明显降低AOPPs对OB的负性作用,减低OB凋亡率,同时OB凋亡相关蛋白Caspase-3表达也明显降低。Zhu等[14]的研究结果与此类似,这也证明了干细胞能够有效保护OB免受氧化应激损伤。
目前认为线粒体是参与细胞凋亡调节的重要细胞器之一[11]。研究发现,ROS过量会导致线粒体膜电位显著降低,线粒体膜通透性升高,线粒体功能障碍。同时,促凋亡蛋白表达上调,引导内质网应激和Ca2+超载,内源性凋亡通路激活,最终导致细胞凋亡[9]。这与本研究结果一致,即AOPP刺激OB后,可显著降低OB内活性线粒体的数量,引起细胞凋亡。
但是,当将氧化损伤OB置于人体脐带干细胞条件培养基中培养后,OB凋亡明显减低,可能是由于HUMSCs条件培养基中含有大量抗氧化应激相关因子,这些因子可以有效减少线粒体破坏,降低细胞凋亡率。Jiang等[15]用MSCs与角膜上皮细胞共同培养,以鱼藤酮诱导的OS反应,发现MSCs作用下角膜上皮细胞愈合增强,线粒体转移增加,这进一步表明干细胞能通过线粒体功能的活化来修复或保护靶细胞。
综上所述,HUMSCs条件培养基可缓解氧化应激反应导致的线粒体功能与结构损伤,并下调Caspase-3凋亡蛋白的表达,降低OB的凋亡。
