复发性肛瘘的治疗要点及方法*
2021-01-19许沂鹏姚一博王琛
许沂鹏,姚一博,王琛
上海中医药大学附属龙华医院肛肠科 上海 200032
肛瘘是临床常见的结直肠肛门良性疾病,其中瘘管累及30%以上外括约肌的经括约肌肛瘘、括约肌上肛瘘和括约肌外肛瘘、马蹄形肛瘘,与炎性肠病、放射治疗、恶性疾病、伴有肛门失禁和慢性腹泻有关的肛瘘,以及女性前侧肛瘘均为复杂性肛瘘[1]。手术是目前治疗肛瘘最有效的方法。由于复杂性肛瘘病灶走行复杂、位置隐匿且累及较多括约肌,手术不当将影响肛门功能且容易复发,是公认的疑难疾病[2]。术后由于管壁上皮残留、组织纤维瘢痕增生和深部腔隙引流不畅,致瘘管不愈或假性愈合导致复发[3-4]。复发的肛瘘因局部解剖结构紊乱、瘢痕增生明显且多伴肛门功能减退,再次手术难度增加。复发性肛瘘治疗成功与否主要取决于两个方面:一是术前明确诊断及病灶形态;二是术中对内口及深部瘘管的有效处理。本文根据本中心治疗经验结合国内外相关研究文献,对复发性肛瘘的治疗方法和理念做一述评,以期为临床提供参考。
1 全面评估,明确诊断
1.1 明确发病原因
肛瘘可以分为腺源性和非腺源性,后者病因多为炎性肠病、结核、外伤、免疫系统疾病、肿瘤等。实验室检查有助于明确病因,根据血常规、CRP可以了解有无急性感染;血沉、T-SPOT、PPD等有助于鉴别炎性肠病和结核;肿瘤特异性指标和免疫炎性因子也有助于鉴别诊断。对于排粪次数较多或近期体重明显改变的患者尤其要重视内镜检查,一些非典型的炎性肠病还需要联合胶囊内镜才能确诊[5]。而局部组织病理检查有助于排除恶变,抗酸染色对于结核诊断具有特异性[6]。
1.2 明确瘘管特征
大部分肛瘘内、外口及瘘管可以通过仔细的局部检查和麻醉下探查明确,但是复发性肛瘘往往会有一个以上内口,瘘管深部呈蹄铁状或深部有隐匿感染腔隙,因此术前全面的影像学评估非常重要[7]。随着诊断技术的不断发展,经肛门3D腔内超声、增强MRI等能比较客观全面地反映瘘管结构形态特征,能显示肛周深部间隙(括约肌间后深间隙、直肠后深间隙、肛提肌下)的病灶[8],见图1。复发性肛瘘患者的影像学检查可以发现肛管括约肌间后深间隙病灶和肛管后深间隙病灶,二者是高位经括约肌型肛瘘或括约肌上型肛瘘、全马蹄形肛瘘及肛提肌上肛瘘中的主要病因,只有结合不同解剖体位综合评估瘘管的整体特点,才能保证在术中不遗留残腔病灶[9-10]。近年来基于MRI影像进行三维(3D)成像和重建,能很好地反映肛瘘主管道、分支和伴随腔隙与内、外括约肌、肛提肌的关系,通过3D影像和3D打印模型,为影像科医师、肛肠外科医师以及患者提供了更为客观全面的评估方法[11],见图2、图3。
2 瘘管内口处理
正确处理内口,可以彻底清除原发病灶、截断再次感染的途径,有效降低复发的概率。复发性肛瘘前期手术一般已处理了内口,但再次手术时会发现内口仍然存在,或因医源性损伤而致存在多个内口,此时需结合内口的位置、大小以及周围组织条件采用不同的治疗方法,尽量减少对括约肌的损伤。
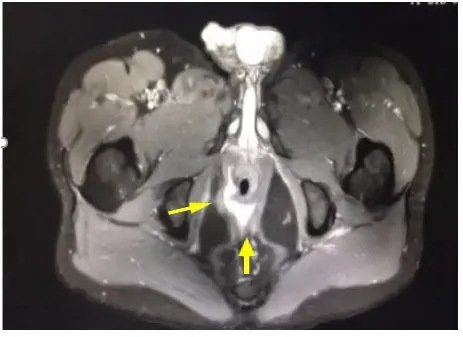
图1 复杂性肛瘘(黄色箭头)MRI图像
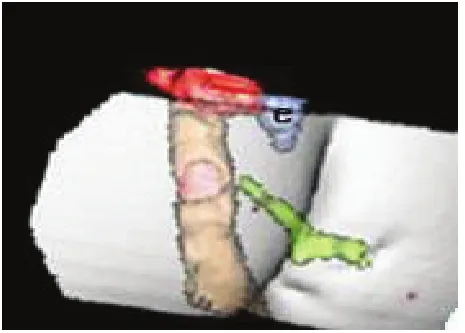
图2 复杂性肛瘘CT3D成像

图3 复杂性肛瘘MRI3D成像(图片引用自参考文献[11])
2.1 内口闭合
内口较小,周围组织健康,血供良好的复发性肛瘘,可直接闭合内口而无需切开括约肌,一般对肛门功能没有明显影响。
2.1.1 直接缝合 缝合作为处理内口的传统手段,是一种比较成熟的技术。临床对于一些较小的内口可将内口和周围炎性组织切除后采用可吸收线直接缝合,包括间断缝合、“8”字缝合等[12],见图4。单纯内口缝合不会给患者带来痛苦,术后通过适当控便,可防止缝合处感染[13]。
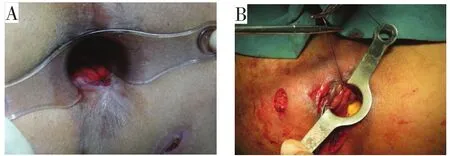
图4 内口直接缝合
2.1.2 器械闭合 有学者应用环状吻合器治疗高位肛瘘患者17例,术后随访时间1~3.5年,无1例复发[14]。还有采用吻合器(弧形闭合器或直线切割闭合器)处理复杂性肛瘘内口的报道。但吻合器往往在低位单纯性肛瘘中发挥更大的作用[15],在复杂性肛瘘中仍需要联合其他术式治疗。2015年Gautier等[16]首次报道采用记忆金属夹闭内口,待内口愈合后再拆除,而瘘管管腔采取旷置引流,该方法后续报道有效率为60%~80%[17-18],患者舒适度差,且金属架容易脱落、继发感染。几种器械闭合内口方法见图5。
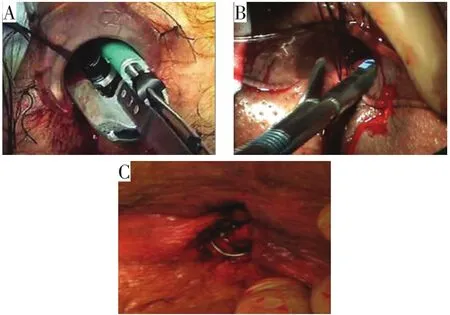
图5 器械闭合内口(图A、图B引用自KARL STORZ;图C引用自参考文献[16])
2.1.3 推移瓣技术 Elting在1912首次报道推移瓣技术治疗高位复杂性肛瘘[19],后续有研究证实采用该方法治疗高位复杂性肛瘘有效率达93%,且无肛门失禁[20]。推移瓣技术发展至今可分为经肛直肠黏膜推移瓣和肛管皮肤推移瓣两类,见图6。术中根据患者直肠黏膜松弛程度进行选择。取患者自体健康组织覆盖内口,加强闭合效果。术中操作必须细致,确保推移瓣有良好的血供、无张力的吻合是手术的关键。肛周皮瓣转移联合肛瘘切除术可缩短创面愈合时间、减轻患者疼痛,安全性高[21]。有研究报道此方法的远期疗效,中位随访20个月后,有24%复发,50%的病例瘘管延迟愈合一个月以上,全部病例无肛门失禁[22]。推移瓣技术操作难度较大、学习曲线长、对组织游离要求高,若张力太大易裂开,导致缝合处感染引起术后并发症,造成更大的内口创伤。
2.2 内口切开
通常认为切开内口(尤其位置较高的内口)会影响肛门功能,导致术后控便能力降低。但是,对于复发性肛瘘患者,由于既往手术已破坏正常解剖结构且瘢痕增生明显,若肛瘘内口较大且基底部呈空腔状态,周围组织血供较差,切开内口能更彻底有效地引流从而促进愈合。
2.2.1 直接切开 复发性肛瘘再次手术时如发现明显内口,可将其切开,见图7。一般从内口向肛缘方向切开至内外括约肌间沟处,切开深度为黏膜、黏膜下层和内括约肌,彻底搔刮清除基底部肉芽和坏死组织,开放创面,必要时可延长切口,有利于充分引流[23-24]。笔者团队对经过二次以上手术的复发性肛瘘患者,通过切开内口开放括约肌间后深间隙,可彻底清除感染病灶,结合创缘两侧袋状缝合可以缩小创面,加快愈合,愈合后未对患者肛门功能造成明显影响,经长期随访患者控便功能均良好。
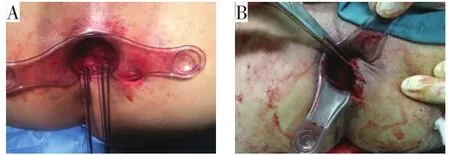
图6 推移瓣闭合内口
2.2.2 切割挂线 挂线疗法作为中医传统治疗方法,古已有之。对于高位复杂性肛瘘或复发性肛瘘,如果内口位置较高,累及组织较多,且组织纤维化瘢痕不明显时可以采用挂线法,见图8。该方法利用弹性材料缓慢切开部分括约肌,尽量减少一次快速切断括约肌造成的损伤[25]。研究表明挂线可以保证引流效果但治疗周期较长[26],治疗周期长短与切割括约肌的量有关,一般需要7~14天,且患者不适感较明显,可应用于多次手术后局部瘢痕明显的患者,切断括约肌后可嘱患者多行提肛锻炼。

图7 内口切开

图8 内口挂线
3 深部瘘管及腔隙处理
临床上部分复发性肛瘘的内口已完全愈合,但是由于存在深部瘘管腔隙,或局部上皮残留而导致肛瘘反复发作。因此,有效处理深部瘘管和腔隙对彻底治愈肛瘘尤为重要。
3.1 破坏瘘管壁组织
3.1.1 搔刮清创 搔刮清创一般用于创面肉芽高突或坏死组织较多时,操作相对简单。复发性肛瘘由于深部瘘管或腔隙引流困难,往往会残留大量坏死组织或上皮组织,直接切开会导致创面过大,故可用刮匙直接搔刮清除坏死、增生肉芽组织,但对于深部弯曲或隐匿病灶而言,单纯搔刮难以保证彻底清创,有时还会造成较难处理的深部出血。此外,对于一些管壁较厚、纤维化或瘢痕明显的瘘管,单纯搔刮往往没有效果。
3.1.2 瘘管剔除 瘘管剔除即采用不同器械,将瘘管壁彻底剥离剔除的方法,见图9。复发性瘘管中部分患者瘘管长、管壁粗硬,直接切开或切除会导致创面过大,因此可用组织剪、电刀行瘘管剔除。国内已有采用刨削刀进行瘘管剔除的研究报道[27-28]。可在直视或超声、内镜引导下对瘘管进行刨削,术中以见到红润新鲜组织为宜。通过特殊刨削设备,可以将瘘管整条或分段剔除,这样无需切开瘘管表面的皮肤和肌肉组织,可更好地保护肛门功能和形态,缩短愈合时间[29-30]。但由于手术器械的限制,该方法往往适用于较为平直的瘘管,对于相对曲折或是走行复杂的瘘管则未能体现应用优势[31]。此外,刨削术易损伤周围组织,一旦出血则较难控制。
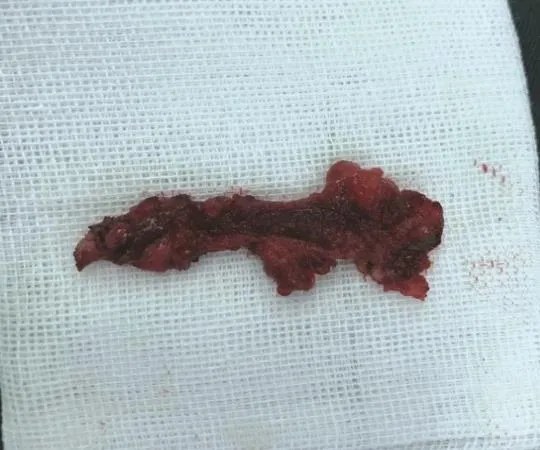
图9 完整剔除的瘘管,剖开后见瘘管管壁
3.1.3 视频辅助肛瘘治疗术 2006年由意大利Meinero发明了视频辅助肛瘘治疗术(VAAFT),具有直视下操作的特点,不仅可以用于瘘管的探查,还可以进行治疗[32],见图10。经肛瘘镜使用单极电凝可以破坏深部瘘管腔内的管壁和上皮组织,联合肛瘘刷可以搔刮清除坏死组织,因此术中无需切开括约肌即可彻底清创。王业皇等[27]也曾利用关节腔镜作为视频辅助,同时配合刨削刀头切除瘘管,但其操作较为复杂。VAAFT理论上操作相对简单,但作为一种新技术,学习曲线较长且存在一些不足:(1)用于烧灼破坏瘘管内壁的单极球头电凝接触面有限,导致破坏不彻底,且输出能量较大时可能会导致组织损伤[33];(2)肛瘘镜属于硬镜,更适合直行、较长的瘘管,对于走行曲折复杂的瘘管以及深部脓腔,难以到达病灶[34]。
3.2 促进深部腔隙组织填充生长
部分肛瘘患者虽然正确处理了瘘管和腔隙,但由于浅表皮肤肌肉组织愈合速度快于深部腔隙闭合速度导致假性愈合,引起复发。因此,促进深部腔隙组织生长是治疗这类复发性肛瘘的关键。
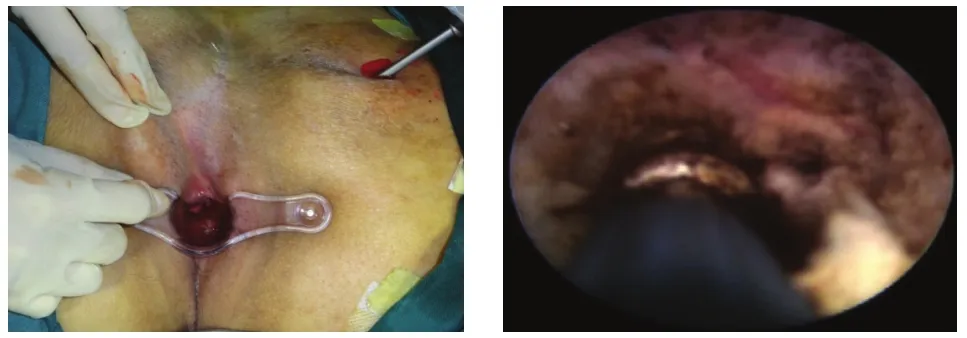
图10 肛瘘镜探查及电凝破坏管壁
3.2.1 置管负压引流术 早在1997年Eriksson等[35]报道了负压密闭引流技术(VSD)可促进伤口愈合,之后VSD技术不断发展革新,在多种创面的治疗中取得了良好的效果。通过密闭负压作用,可增加局部血流、抑制细菌繁殖、促进细胞增殖和肉芽组织生长[36-38]。对于深部瘘管腔隙采用手术治疗联合负压吸引可有利于创腔缩小,促进愈合。但是现有的VSD材料并不适合填充到位置深、形态不规则的肛瘘管腔。笔者团队根据深部腔隙的形状和大小,采用不同型号的蕈状管或“T”管留置并外接负压系统[39],既可保证深部管腔的有效引流,又可促进血液循环、加快肉芽组织生长,利于创腔恢复,缩短愈合时间[40-43]。引流管一般留置5天左右,且在引流管顶部与管腔最深处保持留有1 cm空间,有利于缩小腔隙并可防止组织被吸入引流管而导致疼痛出血[44],见图11、图12。
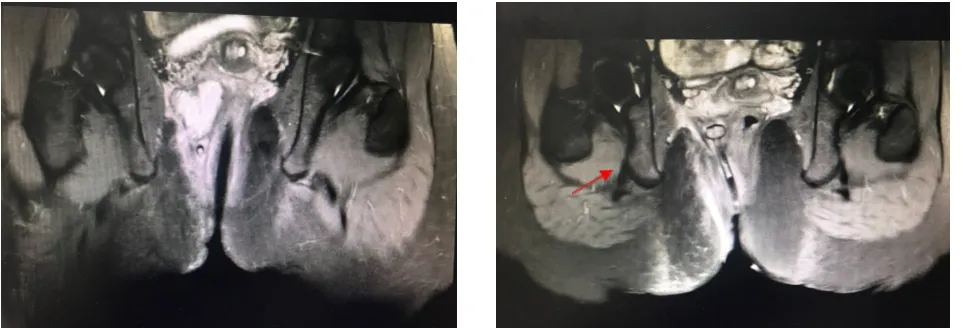
图11 MRI 显示肛提肌水平深部间隙,采用置管引流(红色箭头)
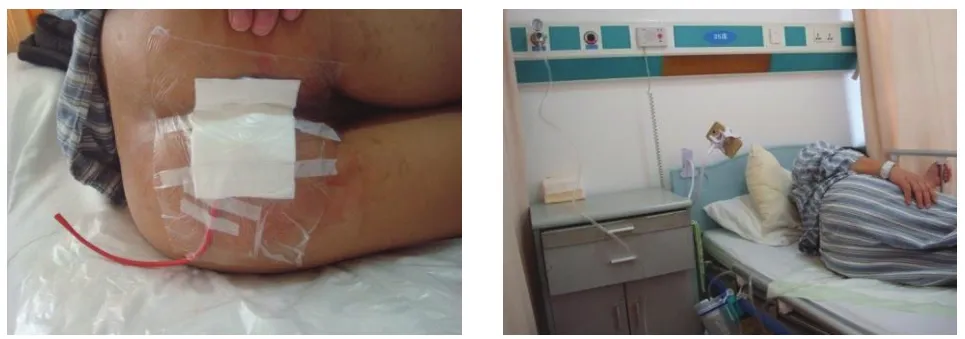
图12 负压吸引(采用橡胶导尿管并连接医院中心负压系统)
3.2.2 激光瘘管消融术 在20世纪80年代已有关于使用激光切割法治疗肛瘘的报道,当时使用的是CO2激光发射器[45]。2011年Wilhelm等[46]首次报道了采用360°径向激光探针治疗肛瘘(FiLaC®)的研究,见图13。该技术是通过激光探针发射激光,利用激光产生的光热效应破坏隐窝和瘘管同时闭合瘘管的一种微创治疗技术,经多项临床研究均证实该技术安全、有效[47-49]。FiLaC®探针头部可以360°发射激光,破坏瘘管内壁后还可以起到缩小闭合空腔的效果,因此对于存在深部瘘管腔隙尤其复发性肛瘘多次手术后深部组织瘢痕明显、愈合能力较差的患者,适合采用FiLaC®治疗。但是,临床应用中也发现FiLaC®治疗肛瘘起到的闭合作用较有限,并非一期完全闭合,且渗液较多,在术后7~10天时外口创面还可能扩大[50]。
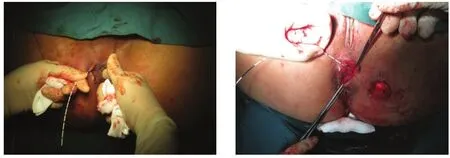
图13 激光消融闭合术
3.2.3 纤维蛋白胶(fibrin glue) 纤维蛋白胶由纤维蛋白原、纤维连接蛋白、XⅢ因子、钙离子以及凝血酶等[51]组成,通过对人体自身凝血反应的最后过程进行模拟而制成的新型外科生物材料。将纤维蛋白胶注入肛瘘管道促进愈合最早由Abel报道[52],愈合率达60%。对于非感染期的深部瘘管及腔隙,可以尝试局部注入纤维蛋白胶填充,但多项长期随访研究发现应用该方法治疗后复发率较高,其高昂的价格也限制了其在临床上广泛使用[53-56]。
3.2.4 肛瘘栓(anal fistula plug) 早期肛瘘栓采用猪小肠黏膜下层制作,可填塞于瘘管内加速瘘管的修复,具有安全性和可重复性,但文献报道的治愈率相差较大,范围在24%~88%。目前临床上使用较多的肛瘘栓有Surgisis®、Bio-A®和脱细胞异体真皮基质(ADM)等。由于复发性肛瘘深部腔隙瘢痕明显,局部组织血供较差,因此可填塞肛瘘栓促进管腔闭合生长。但是肛瘘栓容易脱出且感染率较高,有限的远期随访有效率以及治疗成本限制了其应用[57-59]。
3.2.5 干细胞疗法 目前应用于肛瘘治疗的干细胞有间充质干细胞和脂肪源性干细胞。间充质干细胞是一种具有抗炎和抗增殖作用的多能干细胞,通过自我更新和多向分化,对机体组织进行修复。而脂肪源性干细胞相比来源于骨髓的造血干细胞有更短的倍增时间和更快的增殖速度,具有跨胚层分化的潜能,临床获取简便、对人体损伤较小等优点[60-61]。对于长期不愈、复发性和伴有炎性肠病的肛瘘可联合干细胞移植治疗。Meta分析研究发现干细胞移植能明显提高复杂性肛瘘的治愈率,但干细胞具有某些肿瘤细胞特性,如癌基因激活、抑癌基因失活等,并且细胞连续传代可导致其再生、分化,因而其安全性需要考虑[62-65]。此外,自体脂肪组织移植的患者必须进行两次手术,一次提取脂肪组织,另一次注射干细胞至瘘管处,因此,治疗费用也高于其他术式[66],高昂的成本使得脂肪源性干细胞移植治疗无法广泛应用,令其发展受到掣肘。
4 小结
肛瘘是一种常见肛周感染性疾病,治疗肛瘘的方法和技术一直在不断完善和发展。而复发性肛瘘一直是临床治疗的难点,要获得良好的临床治疗效果关键在于两点:一是对疾病的全面评估和诊断;二是对瘘管内口和深部腔隙的有效处理。只有明确了肛瘘复发的原因,采用针对性强、有效的方法处理好瘘管和深部腔隙,才能使患者获益。随着肛瘘诊疗技术的发展、治疗理念的更新,我们相信灵活地运用各种治疗手段、将不同技术联合、中西医并重协同治疗将会是治疗复发性肛瘘的发展趋势。