凝胶过滤色谱分离纯化鱼蛋白酶解产物
2021-01-18胡二坤郭兴凤郑慧
胡二坤,郭兴凤,郑慧
1. 河南职业技术学院烹饪食品与健康学院(郑州 450046);2. 河南工业大学粮油食品学院(郑州 450001)
鱼蛋白粉经过蛋白酶水解,其产物具有一定的抗氧化活性。在食品工业中,为了更充分地利用鱼蛋白酶解产物,尤其利用其自由基清除能力作天然食品抗氧化剂,有必要对其复杂的水解产物进行分离和纯化,以提高水解产物的抗氧化效果。蛋白的酶解产物一般是多肽片断或游离氨基酸,目前常用的分离纯化方法有超滤、层析等。
凝胶过滤色谱法是以多孔凝胶为支持物,利用分子筛原理进行分离的方法,也是目前研究中常用的层析方法之一[1-2]。凝胶层析被广泛用于脱盐、蛋白质分离纯化和相对分子质量的测定等方面,在鱼蛋白酶解产物的分离方面也有应用。Venkatesan等[3]利用G-25葡聚糖凝胶分离纯化北方鳕鱼鱼肉蛋白;庄永亮等[4]利用G-25葡聚糖凝胶层析法分离纯化罗非鱼鱼皮抗氧化肽;江海萍[5]采用G-15葡聚糖凝胶层析法分离蓝园鰺抗氧化活性肽。
此次试验选用凝胶层析法对鱼蛋白酶解产物进行分离纯化,考察洗脱速度和上样浓度对鱼蛋白水解产物分离效果的影响,确定凝胶层析分离纯化鱼蛋白酶解产物的最佳条件,为后续分离纯化组分的抗氧化活性研究奠定基础。
1 材料与设备
1.1 材料与试剂
Sephadex G-15(Pharmacia公司);碱性蛋白酶(Alcalase 2.4 L,诺维信(中国)生物技术有限公司);还原型谷胱甘肽(纯度>99%,阿尔法化工有限公司);1, 1-二苯基-2-苦基肼自由基(DPPH·)、无水乙醇等试剂均为分析纯。
鱼蛋白酶水解产物(实验室自制)。制备条件:采用碱性蛋白酶(酶活3.0×105U/mL),在底物浓度18.05%、加酶量2.40%、水解pH 8.07、水解温度48.84℃条件下进行酶水解,酶解液经真空浓缩、冷冻干燥后制成粉末。
1.2 试验仪器与设备
仪器与设备见表1。

表1 仪器与设备
1.3 试验方法
1.3.1 凝胶型号的选择
理论上,蛋白质酶解后的氨基酸片断与水解程度有关。随着水解程度的增加,蛋白质的分解程度也增加,所得到的氨基酸片断变小。蛋白质酶解程度和氨基酸片断平均链长度的关系如式(1)所示[6]。

式中:AR为肽段的链长度。
蛋白水解物的平均相对分子质量与水解度有关。水解度越大,蛋白质肽键被切开得越多,肽链越短,相对分子质量越小[7]。试验制备的鱼蛋白水解产物的水解度为23.15%,可推断出水解产物平均含有4~7个氨基酸,平均相对分子质量在520 Da左右[8]。G-15葡聚糖凝胶的分离范围为100~1 500 Da,因此选取G-15葡聚糖凝胶作为分离用凝胶。
1.3.2 预处理及装柱
此次试验选用内径为15 mm、高460 mm的中高压色谱塔。根据凝胶的膨胀系数及柱体积称取适量的凝胶,在沸水浴中煮沸并充分溶胀后,用蒸馏水润洗3遍。装柱前,先向凝胶柱中加入约1/4柱高的蒸馏水,排除柱子下端的气泡,将润洗好的凝胶缓慢倾倒入柱子中,使凝胶自然沉降。为了避免凝胶分层,尽可能一次性地将搅拌均匀的凝胶注入柱子中,若多次注入,每次倾倒凝胶前先搅起沉降的凝胶,再用上述方法倾倒。装好的柱子呈现均一的状态,无气泡和分层。装好的柱子用3~5倍柱体积的蒸馏水对装好的凝胶柱进行平衡,使凝胶充分沉降[6]。
1.3.3 Sephadex G-15凝胶层析方法
仪器设定自动体积2 mL,采用280 nm紫外检测分离产物,蒸馏水为洗脱液,系统自动收集分离样品。考察洗脱速度和上样浓度对鱼蛋白水解产物分离效果的影响。
1.3.4 洗脱速度的选择
上样质量浓度为100 mg/mL,探究洗脱速度分别为1.5,2.0和2.5 mL/min对鱼蛋白水解产物的分离效果。
1.3.5 上样浓度的选择
洗脱速度为2.0 mL/min,探究上样质量浓度分别为75,100和125 mg/mL对鱼蛋白水解产物的分离效果。
1.3.6 DPPH自由基清除率的测定
DPPH·清除率的测定步骤参见表2[9]。

表2 DPPH·清除率测定试验步骤
各混合液充分振荡、混匀,避光条件下反应30 min,在517 nm下测定吸光度。清除率按式(2)计算。
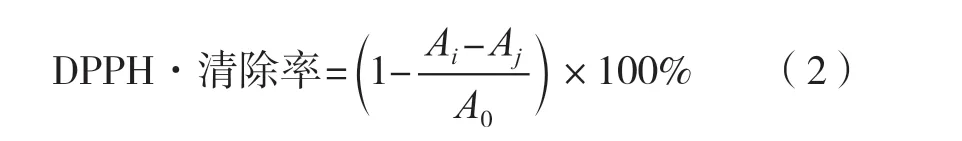
1.3.7 数据处理
采用Collection 2.0.0软件进行凝胶层析峰的计算。
2 结果与讨论
2.1 洗脱速度对鱼蛋白水解产物分离效果的影响
在上样质量浓度100 mg/mL、上样体积2 mL条件下,考察洗脱速度对鱼蛋白水解产物分离效果的影响,结果如图1所示。一般情况下,低流速时凝胶层析的分离效果较好,但流速过慢会导致样品扩散加剧,影响分离效果。流速过快可能会导致样品未得到完全分离就在洗脱液冲洗下流出来,也会影响分离和收集效果[5]。由图1可以看出,鱼蛋白水解产物凝胶层析得到3个洗脱峰。当洗脱速度为1.5 mL/min时,由于洗脱速度慢、出峰慢,样品扩散严重,洗脱出的谱带变宽,峰形不够尖锐,洗脱出来的峰拖尾严重,分离效果不理想。当洗脱速度为2.0 mL/min时,样品得到较好的分离。当洗脱速度为2.5 mL/min时,洗脱出的峰与洗脱速度2.0 mL/min洗脱峰相比,第一个峰和第二个峰的重叠程度高,样品未完全分离开。因此,选择洗脱速度2.0 mL/min进行凝胶层析。
2.2 上样浓度对鱼蛋白水解产物分离效果的影响
在洗脱速度为2.0 mL/min、上样体积2 mL条件下,考察上样质量浓度对鱼蛋白水解产物分离效果的影响,结果如图2所示。在凝胶层析试验中,上样质量浓度过小和过大,均会影响分离效果。由图2可以看出,当上样质量浓度为75 mg/mL时,浓度过小,不利于收集组分。当上样质量浓度为100 mg/mL时,分离效果理想,3个分离组分得到很好的分离。当上样质量浓度为125 mg/mL时,浓度过高,导致样品在洗脱柱的洗脱过程中,高浓度样品向周围扩散,造成分离出的峰重叠现象[7],分离效果较差。因此,选取上样质量浓度100 mg/mL进行凝胶层析。

图1 洗脱速度对鱼蛋白水解产物分离效果的影响
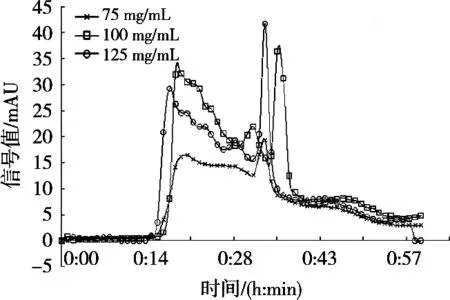
图2 上样质量浓度对鱼蛋白水解产物分离效果的影响
通过以上研究,得出鱼蛋白水解产物分离纯化的最佳操作条件:上样质量浓度100 mg/mL,上样体积2 mL,蒸馏水洗脱,洗脱速度2.0 mL/min。在此操作条件下鱼蛋白水解产物得到3个洗脱峰。
2.3 鱼蛋白水解产物分离图谱及分离组分的蛋白含量
在还原型谷胱甘肽上样质量浓度50 mg/mL、鱼蛋白水解产物上样质量浓度100 mg/mL、上样体积2 mL、蒸馏水洗脱、洗脱速度2.0 mL/min的条件下,将还原型谷胱甘肽和鱼蛋白水解产物分别经过G-15葡聚糖凝胶层析柱,得到的分离图谱如图3所示。鱼蛋白水解产物经过葡聚糖凝胶层析分离,按照出峰先后顺序分别得到组分Ⅰ,组分Ⅱ和组分Ⅲ。鱼蛋白分离组分的蛋白含量及所占的比例由表3所示。
鱼蛋白粉经过酶解后会断裂成不同长度的肽段。由图3可以看出,鱼蛋白水解产物经过G-15葡聚糖凝胶洗脱后出现3个洗脱峰,根据葡聚糖凝胶的分子筛原理,得知组分Ⅲ的相对分子质量最小,组分Ⅱ次之,组分Ⅰ相对分子质量最大。将还原型谷胱甘肽(MW=307.32,纯度>99%)经过洗脱通过G-15葡聚糖凝胶层析柱,得到一个洗脱峰。通过对比还原型谷胱甘肽和鱼蛋白水解产物的洗脱峰,可估算出组分Ⅱ和组分Ⅲ的相对分子质量小于还原型谷胱甘肽。由表3可见,组分Ⅰ相比与其他两个组分所占比例较大,为51.70%,组分Ⅱ和组分Ⅲ占的比例分别为13.90%和34.40%。

表3 鱼蛋白分离组分蛋白含量
图3 鱼蛋白水解产物和还原型谷胱甘肽凝胶层析图谱
2.4 鱼蛋白酶解产物及分离组分的DPPH·清除能力研究
将鱼蛋白水解产物及分离纯化得到的组分Ⅰ、组分Ⅱ和组分Ⅲ分别进行DPPH·清除能力的测定,结果如图4所示。将测定数据进行拟合分析,得到各组分的DPPH·清除能力的IC50值,结果见表4。
由图4可以看出,鱼蛋白酶解产物和3个分离组分的DPPH·清除能力均随着浓度的增大而增强。从图4(a)中可以看出,当质量浓度为1.0~7.5 mg/mL时,随着鱼蛋白水解产物浓度的增加,其DPPH·清除率呈现显著性增加(p<0.05);当鱼蛋白水解产物质量浓度为2.1 mg/mL时,DPPH·清除率达到47.0%。由图4(b)可见,当组分Ⅰ质量浓度为0.8~5.0 mg/mL时,其DPPH·清除率呈现显著性增加;当质量浓度为1.6 mg/mL时,组分Ⅰ的DPPH·清除率为51.1%。组分Ⅱ的DPPH·清除能力由图4(c)所示,当质量浓度为0.5~7.9 mg/mL时,组分Ⅱ的DPPH·清除率显著性增强;当质量浓度为2.0 mg/mL时,组分Ⅱ的DPPH·清除率为33.6%。组分Ⅲ的DPPH·清除能力由图4(d)所示,组分Ⅲ的DPPH·清除率在0.4~3.7 mg/mL质量浓度范围内显著增加,当其DPPH·清除率为55%时,组分Ⅲ的质量浓度为1.5 mg/mL。
由表4可见,鱼蛋白水解产物经过G-15葡聚糖凝胶层析,组分Ⅰ和组分Ⅲ的DPPH·清除率明显提高,组分Ⅱ的DPPH·清除率相比鱼蛋白酶解产物变化不大。组分Ⅲ的DPPH·清除率最大,组分I次之,组分Ⅱ的DPPH·清除能力略低于鱼蛋白水解产物的DPPH·清除能力,但均低于还原型谷胱甘肽和抗坏血酸的DPPH·清除能力。

图4 鱼蛋白水解产物及分离组分浓度对DPPH·清除能力的影响

表4 水解产物和分离组分的DPPH·清除能力测定结果 mg/mL
鱼蛋白酶解产物对DPPH·清除作用是其可以向DPPH·提供电子或氢供体的疏水氨基酸暴露,使得鱼蛋白水解产物具有清除DPPH·的能力[10]。鱼蛋白水解产物提供电子或氢原子给自由基后,自身成为自由基中间体,中间体达到稳定态的时间和稳定态的稳定程度直接影响最终的自由基清除能力,还原型谷胱甘肽和抗坏血酸的DPPH·清除能力远高于鱼蛋白水解产物,原因可能是鱼蛋白水解产物提供氢原子给自由基后,形成稳定中间体的速度较慢,时间较长[11]。
3 结论
此次试验选择G-15葡聚糖凝胶作为柱材料分离纯化鱼蛋白水解产物,通过改变凝胶层析色谱的上样浓度和洗脱速度,确定G-15葡聚糖凝胶层析分离纯化鱼蛋白水解产物的条件:上样质量浓度100 mg/mL,上样体积2 mL,蒸馏水洗脱,洗脱速度2.0 mL/min。鱼蛋白水解产物经过G-15葡聚糖凝胶层析,按相对分子质量大小得到3个分离组分:组分Ⅰ、组分Ⅱ和组分Ⅲ。3个分离组分的蛋白含量依次为83.70%,49.20%和36.91%,峰面积分别占51.70%,13.90%和34.40%。组分Ⅰ和组分Ⅲ的DPPH·清除率明显提高,组分Ⅱ的DPPH·清除率相比鱼蛋白酶解产物变化不大。
