茶皂素的提取及其热稳定性分析
2021-01-18谭登峰庞锦英胡华林孙超
谭登峰,庞锦英,胡华林,孙超
1. 贵州医科大学,省部共建药物植物功效与利用国家重点实验室/贵州省中国科学院天然产物化学重点实验室(贵阳 550014);2. 南宁师范大学化学与材料科学学院(南宁 530001)
茶皂素(Tea saponin)是山茶科(Theaceae)山茶属(Camellia)植物皂素的统称[1],是一类三萜类皂苷混合物[2],由疏水性的配基、亲水性的糖体和有机酸组成[3-4]。茶皂素具有性温和、可降解、无毒害等特点,是一种生物活性能和表面活性能优异的生物质原料,市场价格较高,纯度60%的茶皂素售价达5 000万元/t,在医药、洗涤、纺织、阻燃等领域应用广泛[5-9]。
茶皂素的提取方法主要分为水浸法和有机溶剂法以及在此基础上衍生的微波或超声波辅助提取法[10-11],其工艺大多以茶皂素提取率或纯度中的一种为优化对象,同时考虑以提取率及纯度为优化对象的研究较少,并且多数醇提或水提后便直接浓缩,缺少后续的纯化步骤,造成提取率及纯度都不高。因此,有必要对茶皂素的提取工艺做进一步深入研究。
热重分析仪(TGA)是利用热重法来检测物质质量随温度变化的一种仪器,被广泛运用于天然产物及其改性物的热稳定性研究[12-14]。茶皂素的研究主要集中在提取、分离、生物活性等方面,而对其材料本身的表征研究较少,特别是在茶皂素的热稳定性方面。鉴于此,试验同时考虑以提取率及纯度为优化对象,采用Box-Behnken试验设计法从廉价的油茶饼粕中提取高纯度的天然茶皂素,确定最优提取工艺,进而利用热重分析仪来分析不同纯度的茶皂素热稳定性能,以期为油茶饼粕中茶皂素的提取及其在表面活性剂领域中的应用提供科学依据。
1 材料与方法
1.1 主要试剂及仪器
油茶饼粕(茶枯,贵州石阡佛顶山野生油茶油业有限公司);石油醚、无水乙醇、丙酮、明矾、氧化钙、盐酸、碳酸氢铵等(分析纯)。
XFB-500型高速中药粉碎机(吉首市中湘制药机械厂);AL204-IC型电子天平(瑞士梅特勒-托利多公司);DLSB-5/20型低温冷却液循环泵(郑州长城科工贸有限公司);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);N-1000S-WA型旋转蒸发仪(东京理化器械株式会社);OSB-2100型油浴锅(东京理化器械株式会社);PC 101NT型化学隔膜泵(德国vacuubrand公司);Discovery型热重分析仪(美国TA公司)。
1.2 试验方法
1.2.1 试验设计
在前期文献调研及单因素试验基础上,选取对茶皂素提取影响较大的乙醇体积分数、液固比、浸提温度、浸提时间等因素进行Box-Behnken试验,以茶皂素提取率及纯度为指标,采用Design-Expert软件中的Box-Behnken试验设计法优化茶皂素的提取工艺,其因素和水平数值见表1。
1.2.2 提取方法
取一定量经粉碎的冷榨油茶饼粕,用5倍量的石油醚50 ℃回流1 h,去茶油,过滤,残渣用同样的方法浸提一次过滤,挥发石油醚得脱脂油茶饼粕;将20 g脱脂油茶饼粕添加到500 mL圆底烧瓶中,用电热套进行加热浸提,各提取条件按Box-Behnken试验设计方法来进行,趁热过滤,并用同一浸提溶剂洗涤残渣3次,合并滤液;待滤液浓缩成浆状时,停止加热,加入浆状滤液质量10%明矾,充分搅拌15 min,静置1 h后分离沉淀剂,即得浆状茶皂素粗品,干燥后记为CZS-1。茶皂素提取率计算方法见式(1)。

1.2.3 纯化方法
将浆状茶皂素粗品加入圆底烧瓶,并加入质量5%氧化钙,充分搅拌15 min,静置1 h,过滤分离;将碳酸氢铵加入沉淀物中,使茶皂素转化成液体,过滤,得茶皂素液体,干燥后记为CZS-2。
1.2.4 茶皂素含量测定
参照SN/T 1852—2006法[15],并略有修改。精密称取约1.5 g粉状试样置于三角烧瓶中,加10 mL去离子水溶解后加12 mL 36%盐酸,接蛇形冷凝管置通风橱中100 ℃回流2 h,取出冷却至室温,沉淀过滤洗涤至中性;将沉淀和滤纸置于85 ℃真空干燥箱中烘干,用滤纸包好置于索氏提取器内,用丙酮作溶剂,于75 ℃抽提2 h,回收丙酮至干,接收瓶和提取物放入110±2℃烘箱中干燥2 h,取出,放入干燥器中冷却0.5 h后称其质量,重复上述步骤,至前后2次质量之差不超过2 mg,即为恒质量。茶皂素含量计算方法见式(2)。

式中:W为茶皂素含量,%;m0为空白残留物质量,g;m1为样品质量,g;m2为接收瓶质量,g;m3为恒质量后接收瓶和抽提物质量,g。
1.2.5 热稳定性分析
分别称取约5 mg茶皂素样品CZS-1和CZS-2,采用热重分析仪以20 ℃/min升温速率,从40 ℃升温到750℃,N2为测试气氛,气体流速10 mL/min。
2 结果与讨论
2.1 茶皂素的提取
2.1.1 模型及回归方程的建立
Box-Behnken的四因素三水平试验结果见表2,共29个试验点。其中,试验号10,14,17,19和27为中心试验,其余为析因试验。29个试验点又可分为零点和析因点,其中零点为效应面的中心点,试验重复5次,用于评估试验误差[16];析因点为自变量值A、B、C、D所构成的四维顶点。茶皂素提取率及纯度试验值见表2。
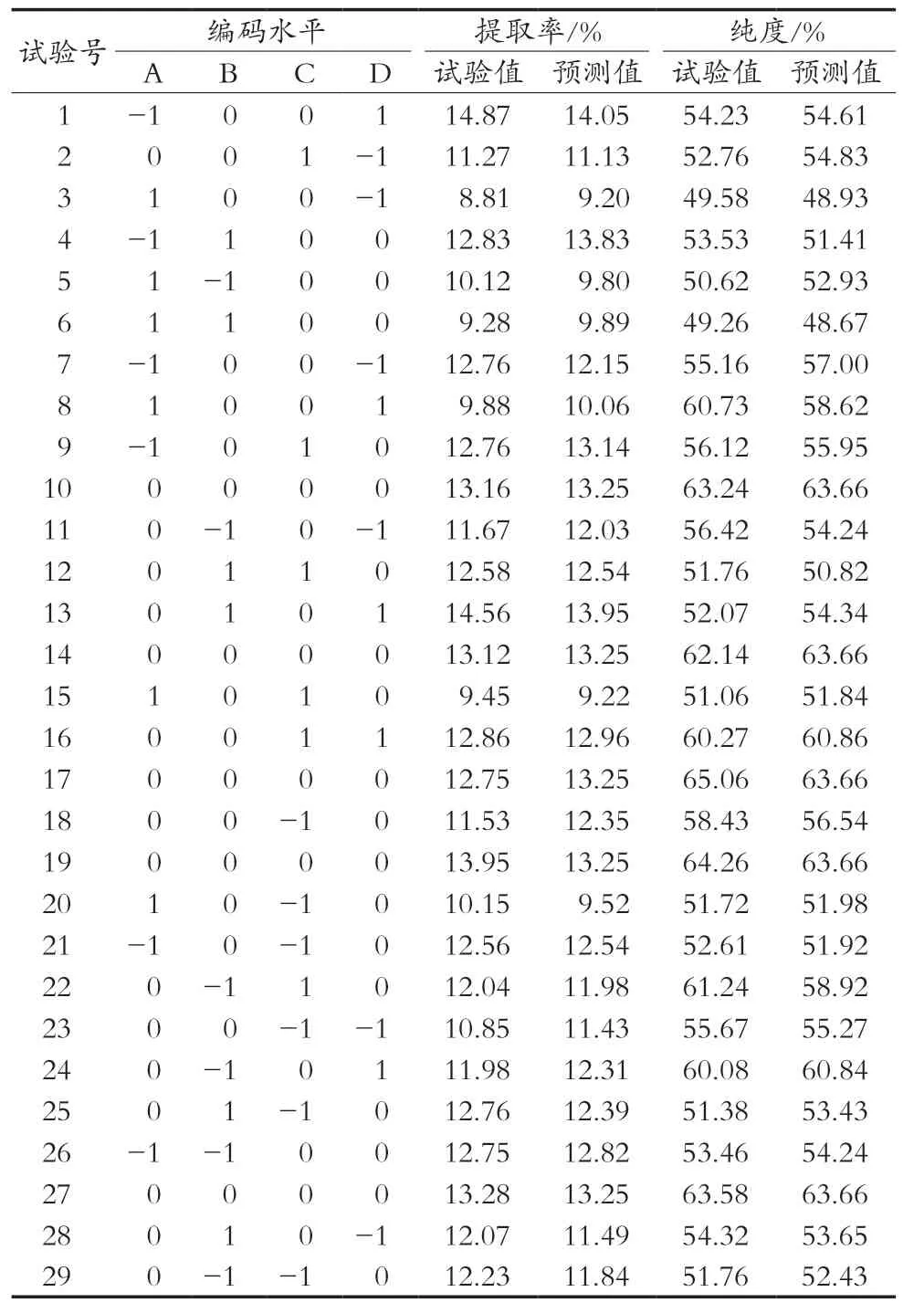
表2 Box-Behnken试验设计及结果
选用模型Quadratic回归方程分析法分析,可得各因素对茶皂素提取率及纯度影响的多元回归预测模型方程,如表3所示。

表3 响应指标的预测模型
2.1.2 方差分析

表4 提取率方差分析

表5 纯度方差分析
由表4可知,以茶皂素提取率为响应值,模型p<0.000 1,说明该模型极显著,失拟项p=0.156 9>0.100 0,表明该数学模型与试验结果拟合较好,可用于推测试验结果。多元方程相关系数为R2=0.903 1,可说明90.31%的数据可用此方程解释。校正判定系数0.806 1,说明该数学模型能较好地预测提取条件与提取率之间的关系。由F值大小还可知,各因素对茶皂素提取率影响的主次顺序为:A>D>B>C,即乙醇质量分数>液固比>浸提温度>浸提时间。
由表5可知,以茶皂素纯度为响应值,模型p<0.000 1,说明模型极显著,失拟项p=0.089 4>0.100 0,表明该数学模型与试验结果拟合较好,可用于推测试验结果。多元方程相关系数R2=0.916 2,可说明91.61%的数据可用此方程解释。校正判定系数0.832 3,说明该数学模型能较好地预测提取条件与提取率之间的关系。由表5可知,AD、BC的交互影响差异显著,其他因素交互影响差异不显著。
2.1.3 交互因子的响应面分析
等高线形状可以反映各因素交互作用大小,其排列密集程度可表明各因素对响应指标的影响程度;响应曲面图能直观反映各因素对响应指标影响的整体趋势[17]。根据Box-Behnken试验结果和回归方程,各因素对响应指标的影响可用等高线图及响应面图表示,在试验中,乙醇体积分数、浸提温度、浸提时间和液固比交互因子对响应指标的等高线图和响应面图如图1和图2所示。由图1可知,在浸提温度和浸提时间不变的情况下,响应面图为一坡度较大曲面,说明各混料因子之间交互作用明显。固定液固比,响应指标提取率先升后降,且有最大值,表明乙醇体积分数对茶皂素提取率影响较大,这与提取率方差分析结果一致。图2描述各因素对茶皂素纯度的影响作用,在浸提温度和浸提时间不变的情况下,响应面图为一坡度较大曲面,说明各因素之间交互作用明显。固定乙醇体积分数,响应指标纯度先升后降,且有最大值,表明液固比对茶皂素纯度影响较大;由等高线图可知,乙醇体积分数与液固比的交互作用显著,这与纯度方差分析结果一致。
2.1.4 验证试验
根据Box-Behnken试验结果和回归方程得到最优预测提取工艺,即乙醇体积分数83.73%、浸提温度79.56 ℃、浸提时间3.10 h和液固比10.38∶1(mL/g)。在该工艺下,模型预测茶皂素提取率和纯度分别为13.80%和63.86%。考虑试验操作便利,优选工艺为:乙醇体积分数84%、浸提温度80 ℃、浸提时间3 h和液固比10∶1(mL/g)。依据优选工艺进行茶皂素的提取,重复3次取平均值,茶皂素粗品(CZS-1)的提取率和纯度分别为13.52%和63.92%,与预测值基本相符,表明优选工艺可用于茶皂素的提取。
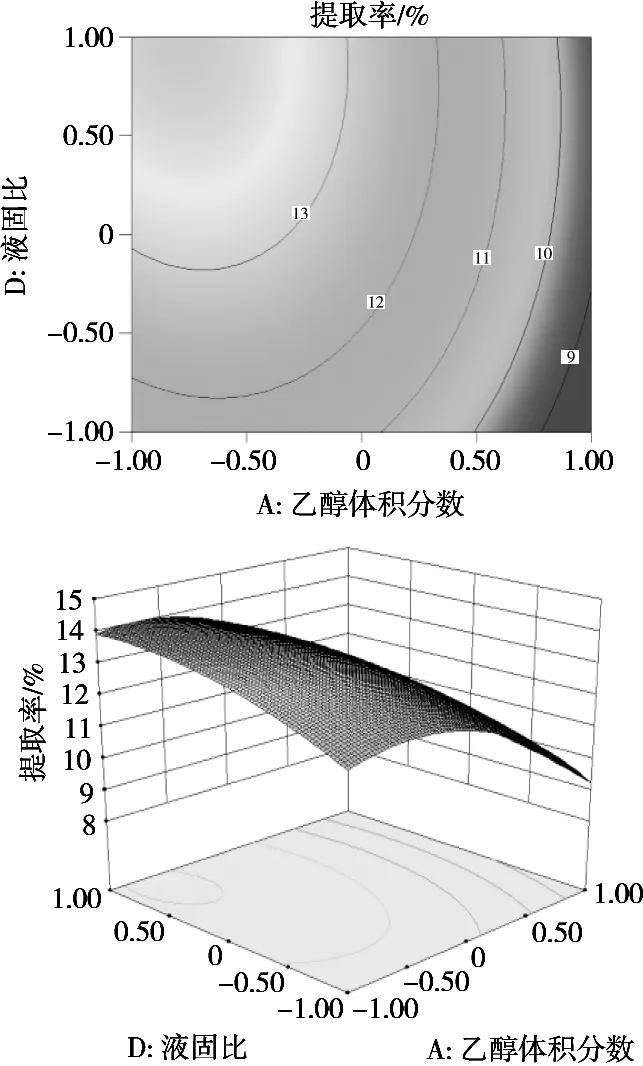
图1 交互因子对提取率影响的等高线图和响应面图
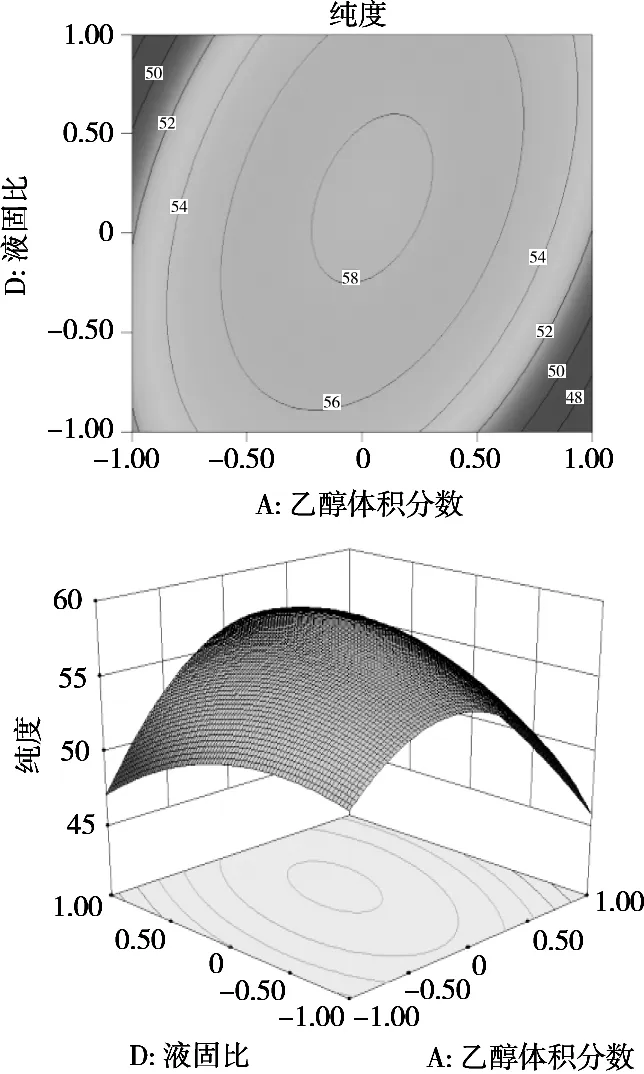
图2 交互因子对纯度影响的等高线图和响应面图
2.2 热稳定性分析
为考察不同纯度茶皂素热稳定性能,将茶皂素粗品(CZS-1)按1.2.3的纯化方法,可得精制茶皂素(CZS-2),其纯度为86.24%。不同纯度茶皂素热降解行为见图3和表6。由图3可知,2个不同纯度茶皂素的热稳定性分别在低温区和高温区展示出不同的变化规律。分解温度低于430 ℃,两者的降解行为相似,但纯度越高,茶皂素在低温区的热稳定性越差。这可能的原因是茶皂素纯度越大,如—O—、—OH、—COO—、—COOH等强电负性的含氧亲水基团含量也增大,在体系中更容易吸潮,且生成受热容易降解的氢键。当分解温度高于430 ℃时,两者关系正好相反。由表2可知,茶皂素纯度越高,其低温区第一和第二阶段最大分解温度也随之降低,该阶段与水分的增加有关,说明茶皂素纯度越高,体系越易吸潮,生成易降解的氢键。分解温度700 ℃时,CZS-1和CZS-2的残炭率分别为2.3%和21.5%。结果表明茶皂素纯度越高,其高温残炭率越高。分析其原因可能是纯度越高,体系中容易结碳的C—C五环结构比例就越大,促进材料在高温区快速成碳,体系的感温稳定性提高。
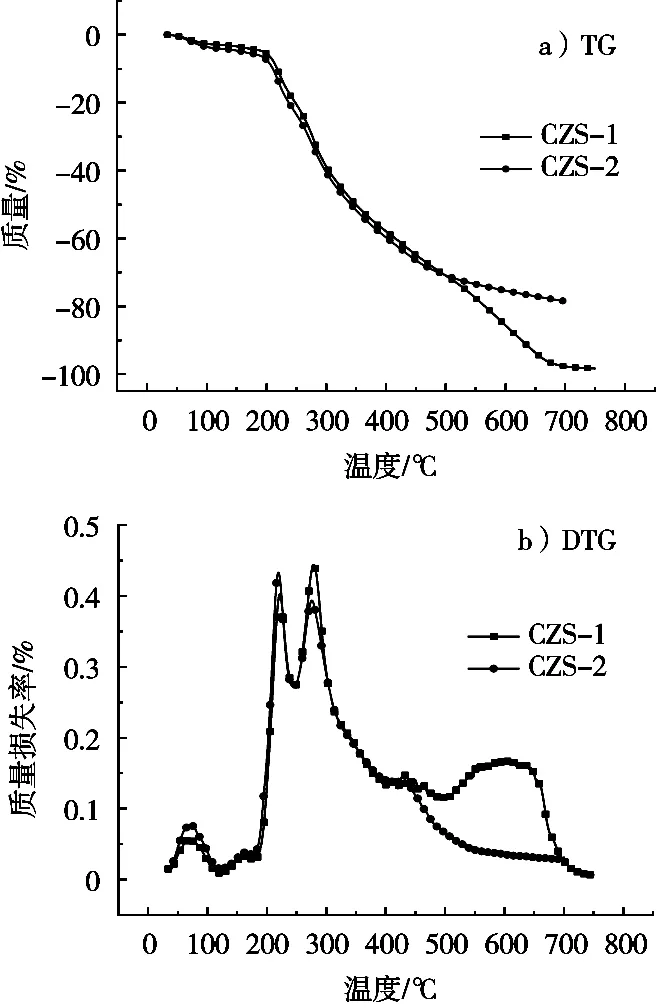
图3 CZS-1和CZS-2的热降解曲线
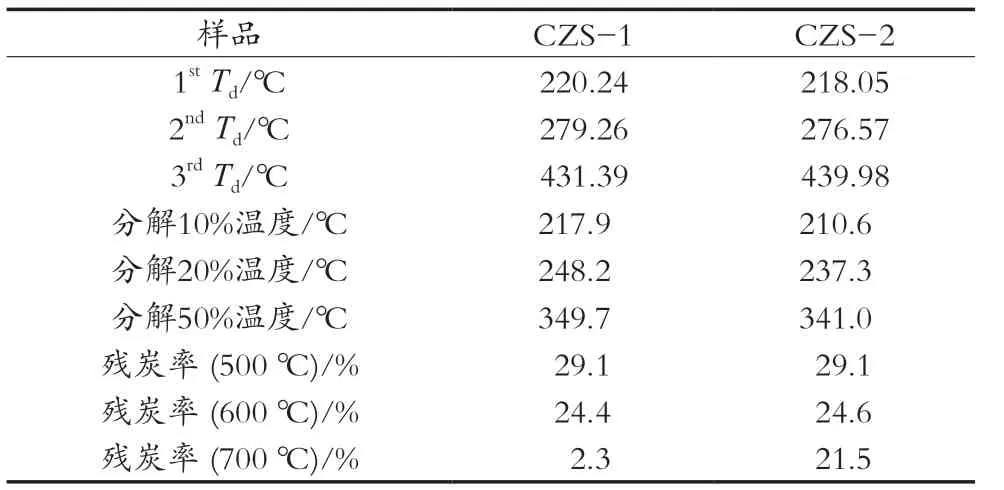
表6 CZS-1和CZS-2的热降解数据
3 结论
在前期文献调研及预试验基础上通过Box-Behnken试验优化,获得茶皂素提取的最佳工艺:乙醇体积分数84%、浸提温度80 ℃、浸提时间3 h和液固比10∶1(mL/g)。在该工艺下,模型预测茶皂素提取率和纯度分别为13.52%和63.92%。验证试验结果与预测值基本相符,试验模型优化工艺与预测值可信度高,可用作茶皂素的提取工艺。
在相同升温速率下,当分解温度<430 ℃时,茶皂素纯度越高,其热稳定性越差;当分解温度>430℃时,两者关系正好相反。当分解温度为700 ℃时,茶皂素纯度越高,其高温残碳性能越好。
