蒜酶HPLC定性检测方法的建立及应用
2021-01-18李心雨罗春霞敬爽李新霞
李心雨 ,罗春霞,敬爽,李新霞
1. 新疆医科大学药学院(乌鲁木齐 830011);2. 石河子大学药学院(石河子 832000);3. 新疆师范大学化学化工学院(乌鲁木齐 830054)
大蒜(Allium sativumL.)为百合科葱属植物蒜的鳞茎,是一种具有悠久历史的药食两用植物[1]。蒜氨酸裂解酶(Alliinase,EC4.4.1.4)简称蒜酶,是用来催化大蒜中活性成分蒜氨酸,使其裂解生成大蒜辣素[2-4]。大蒜辣素是公认的大蒜活性成分,具有多种药理活性作用[5-9]。蒜氨酸酶相对分子质量为103 kDa[10],大蒜粉末中蒜酶有两个相同的亚基结构,相对分子质量为51.5 kDa[11]。一般常采用还原型SDSPAGE凝胶电泳法测定蒜酶相对分子质量及蒜酶在大蒜总蛋白中的含量[12],但是由于蒜酶结构为双亚基结构[13],在电泳测定前加入的载样缓冲液首先使蒜酶中二硫键断裂而最终检测为蒜酶亚基,不能真实反映大蒜中的蒜酶分布情况。为了进一步确定蒜酶含量和分布,建立蒜酶的HPLC检测方法,被测蛋白与其他干扰物质之间有很好的分离度[13-14],试验采用高效分子排阻色谱(SEC-HPLC)法检测蒜酶,根据凝胶色谱柱的分子筛原理,对蒜酶提取物中的蒜酶二聚体和亚基结构进行检测,进一步研究大蒜及大蒜蒜酶提取物中的蒜酶分布和结构特征。
1 仪器与试药
1.1 仪器与设备
LC-20AD-SPD-RID高效液相色谱仪(日本岛津);Exceed-E艾柯超纯水机(成都唐氏康宁科技发展有限公司);M1-L213B微波炉(Midea集团);JYL-C020E匀浆机(九阳股份有限公司)。
1.2 试剂与材料
磷酸氢二钠(成都市科龙化工试剂厂,批号2013100801);磷酸二氢钾(天津市福晨化学试剂厂,批号20131007);牛血清蛋白(上海源叶生物科技有限公司,批号L16M6S2,纯度≥98%);卵清蛋白(美国Sigma-Aldrich公司,批号SLBM7240V,纯度≥98%)。
不同产地大蒜冻干粉(新疆埃乐欣药业、山东大蒜、塔城博孜达克农场大蒜、巴里坤农丰园大蒜、巴里坤板房沟大蒜);不同产地鲜蒜(新疆埃乐欣药业);蒜酶提取物(新疆埃乐欣药业,批号201702011,201703013,201703012和201702024)。
2 方法与结果
2.1 溶液制备
蒜酶供试品溶液:精密称取60 mg蒜酶提取物1置10 mL量瓶中,用纯水溶解定容至刻度。
大蒜供试品溶液1:精密称取约160 mg大蒜冻干粉置10 mL量瓶中,用纯水溶解定容至刻度。
大蒜供试品溶液2:精密称取约640 mg大蒜冻干粉置10 mL量瓶中,用纯水溶解定容至刻度。
鲜蒜供试品溶液:取10 g去皮鲜蒜,精密称定,加35 mL水,匀浆1 min,浆液转移至50 mL容量瓶中,加水定容至刻度,经0.22 μm微孔滤膜过滤,即得。
牛血清蛋白溶液:称取20 mg牛血清蛋白溶液,精密称定,置于10 mL量瓶中,用纯水溶解定容,经0.22 μm微孔滤膜过滤,备用。
卵清蛋白溶液:称取20 mg卵清蛋白溶液,精密称定,置于10 mL量瓶中,用纯水溶解定容,经0.22 μm微孔滤膜过滤,备用。
2.2 HPLC测定蒜酶方法的建立
Kitamura等[15]采用C8柱测定蒜酶,参考文献确定蒜酶在325 nm波长下的色谱峰,具有专属性,所以采用325 nm作为蒜酶提取物液相色谱检测波长。
精密称定牛血清蛋白、卵清蛋白、大蒜冻干粉(供试品溶液2)、鲜蒜和蒜酶提取物,按2.1小节的方法制备供试品溶液。
色谱条件:采用TSK gel G3000SWXL(7.8 mm×300 mm,7 μm)色谱柱;检测波长325 nm;流动相:0.1 mol/L磷酸盐缓冲液(7.098 g磷酸氢二钠,6.803 g磷酸二氢钾,加水至1 000 mL);流速0.5 mL/min;柱温25 ℃;进样量15 μL。
采用凝胶色谱柱定性测定蒜酶提取物中蒜酶,根据凝胶色谱柱分子筛原理大相对分子质量的物质先出峰,即保留时间越短,相对分子质量越大。牛血清蛋白和卵清蛋白的相对分子质量分别是66.4和44.5 kDa,在色谱图中的保留时间分别是18.850和20.225 min(图1)。蒜酶单个亚基相对分子质量为51.5 kDa[10],蒜酶二聚体相对相对分子质量为103 kDa。蒜酶提取物和大蒜冻干粉(图2和图3)在14和19 min处均有色谱峰出现,出峰时间较牛血清蛋白提前,可以确定在325 nm检测波长处,14 min的色谱峰为蒜酶二聚体峰,而另一个在牛血清蛋白和卵清蛋白保留时间之间的峰(19 min)可以确定为蒜酶的单个亚基峰。色谱图结果还显示,蒜酶提取过程,除去了部分大蒜蒜酶中蒜酶亚基结构。

图1 牛血清蛋白、卵清蛋白液相色谱图
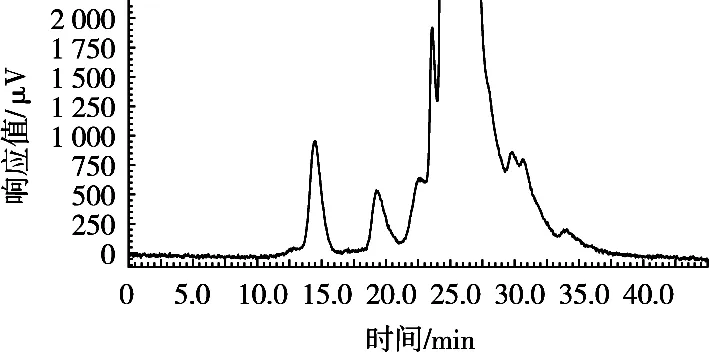
图2 大蒜冻干粉中蒜酶HPLC测定液相色谱图

图3 蒜酶提取物中蒜酶HPLC测定液相色谱图
2.3 大蒜冻干粉和蒜酶提取物中蒜酶的检测
精密称定不同批次蒜酶提取物和不同产地大蒜冻干粉,4批蒜酶提取物A1~A4,4个不同产地大蒜冻干粉G1~G4。按照2.1的方法制备蒜酶供试品溶液和大蒜供试品溶液1,按照2.2的色谱条件测定蒜酶提取物和大蒜冻干粉中的蒜酶。
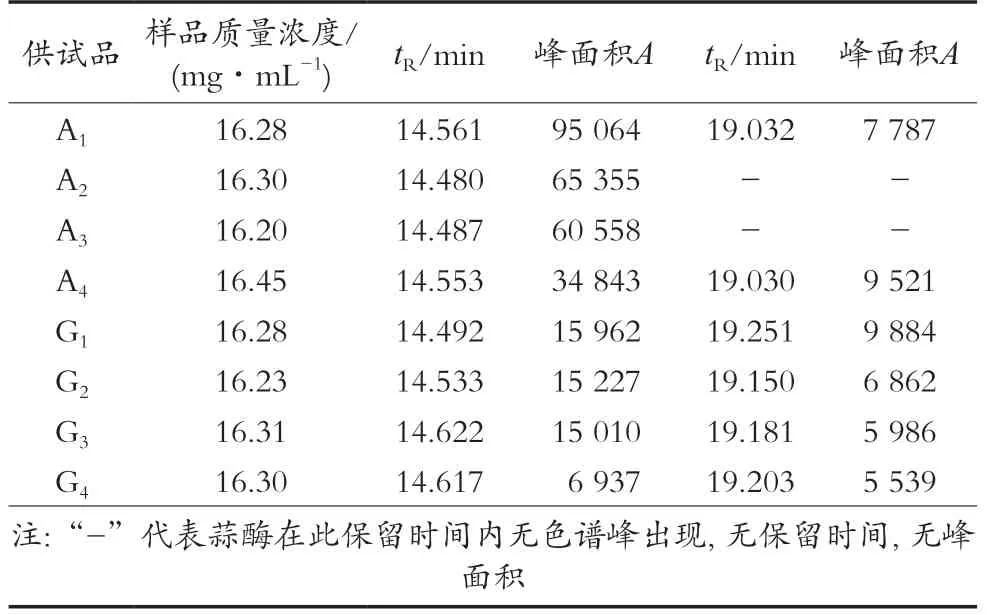
表1 HPLC测定不同批次蒜酶提取物和大蒜提取物中蒜酶
根据大蒜冻干粉和蒜酶提取物中蒜酶及蒜酶亚基的峰面积测定结果,对比它们在大蒜冻干粉和蒜酶提取物中的相对含量。结果如表1和图4所示,蒜酶提取物中蒜酶二聚体含量较高,且有些批次的蒜酶提取物不含蒜酶亚基,仅有蒜酶二聚体;大蒜冻干粉中蒜酶二聚体的含量较低,不同产地的大蒜冻干粉均含有蒜酶二聚体和蒜酶亚基。所以大蒜冻干过程中保留了蒜酶二聚体和亚基结构,而经过提取纯化的蒜酶提取物中二聚体得以富集,亚基比例降低。

图4 大蒜冻干粉和蒜酶提取物中蒜酶二聚体和亚基峰面积柱状图
2.4 不同产地大蒜冻干粉中蒜酶相对含量比较
精密称定不同产地大蒜冻干粉,按照2.1的方法制备大蒜供试品溶液,采用2.2的色谱条件测定17个不同产地大蒜冻干粉。结果列入表2。
不同产地大蒜冻干粉的蒜酶HPLC检测结果显示,来源于17个产地大蒜冻干粉中蒜酶二聚体有较大差异,蒜酶二聚体峰面积均高于蒜酶亚基峰面积,两者峰面积比值为2.75±0.79(均值±SD,n=17)。采用SPSS分析软件对17个产地大蒜冻干粉中蒜酶二聚体和蒜酶亚基峰面积进行配对样本t检验统计分析。相关分析结果显示,蒜酶二聚体峰面积与蒜酶亚基峰面积的相关系数r=0.624,p值(Sig)=0.007<0.05,表明两者存在相关关系。同时按照建立的方法,对不同产地大蒜冻干粉中的蒜氨酸进行测定,对蒜酶与蒜氨酸含量进行相关关系分析,结果显示蒜酶含量高低与蒜氨酸含量之间不存在相关关系。
2.5 灭酶处理方法对蒜酶二聚体和亚基含量的影响
按照2.1的方法制备鲜蒜供试品溶液和灭酶鲜蒜供试品溶液,采用2.2的色谱条件对不同产地鲜蒜进行检测。
图6显示,鲜蒜经匀浆处理,有14 min处的蒜酶二聚体和19 min处蒜酶亚基色谱峰,而同一鲜蒜经微波灭酶处理,检测不到蒜酶的色谱峰,供试品溶液中蒜酶二聚体和蒜酶亚基色谱峰均消失。鲜蒜经灭酶处理,蒜酶因变性而聚集沉淀,溶解度下降,在样品前处理的过程中灭酶供试品溶液经0.22 μm滤膜过滤,样品溶液中蒜酶因沉淀而无法透过滤膜,所以HPLC方法检测不到灭酶鲜蒜供试品的蒜酶色谱峰。

表2 不同产地大蒜冻干粉中蒜酶峰面积和蒜氨酸含量
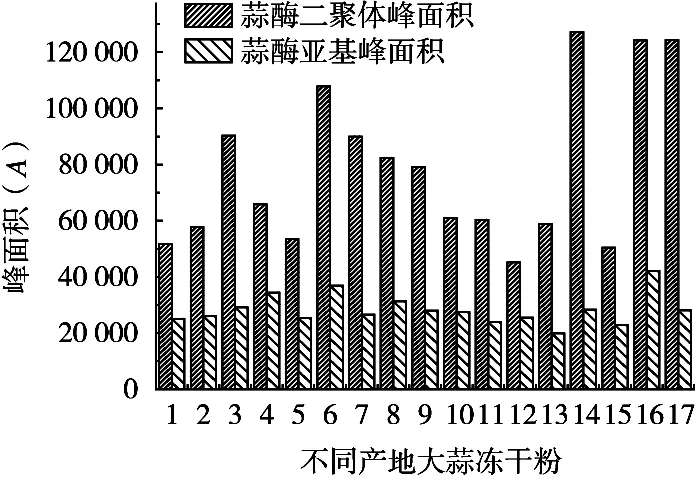
图5 不同产地大蒜冻干粉柱状图

图6 鲜蒜灭酶和不灭酶处理液相色谱图

表3 不同产地鲜蒜中蒜酶二聚体和蒜酶亚基峰面积

图7 不同产地鲜蒜的蒜酶二聚体及蒜酶亚基峰面积柱状图
3 讨论与结论
试验采用HPLC法分别测定蒜酶提取物、大蒜冻干粉和鲜蒜中蒜酶,在大蒜样品中分别检测到蒜酶和蒜酶亚基存在,而经过提取纯化的蒜酶提取物中蒜酶亚基含量减少。研究建立的方法与SDS-PAGE法比较,不用破坏蒜酶结构,并且可以分别检测到蒜酶和蒜酶亚基的色谱峰。据文献[16]报道,蒜酶分子作为二聚体,具有生物活性,是由于它的活性位点由两个亚基的残基构建,需组成二聚体才具有活性。所以蒜酶活力是由蒜酶二聚体结构决定的,试验通过采用HPLC法检测蒜酶中二聚体结构,为后续提取纯化蒜酶具有指导意义,为进一步探索蒜酶催化蒜氨酸产生大蒜辣素的机制奠定研究基础。
根据表3和图7可知,不同产地鲜蒜中均含有蒜酶二聚体和蒜酶亚基,两者峰面积比值为3.01±0.84(均值±SD,n=7)。表3显示大蒜冻干粉中蒜酶二聚体与蒜酶亚基峰面积的比值为2.75±0.79(均值±SD,n=17),与鲜蒜中比值一致。所以鲜蒜经冷冻干燥处理,不影响鲜蒜中蒜酶二聚体及亚基结构,而微波处理后蒜酶变性,使其溶解度下降而未能检出。
对不同产地的鲜蒜中的蒜酶二聚体和蒜酶亚基峰面积进行统计相关分析,结果显示,相关系数r=0.852,p值(Sig)=0.015<0.05,表明蒜酶二聚体峰面积与蒜酶亚基峰面积存在相关关系。对不同产地鲜蒜中蒜酶峰面积与蒜氨酸含量进行相关性分析,结果显示蒜酶峰面积与蒜氨酸含量之间不具有相关关系。这一结果与大蒜冻干粉一致。
