哈密大枣中β-D-葡萄糖苷酶活性测定条件的优化
2021-01-18关尚玮陈恺范利君王雪妃刘慧丽李焕荣
关尚玮,陈恺,范利君,王雪妃,刘慧丽,李焕荣
新疆农业大学食品科学与药学学院(乌鲁木齐 830052)
枣(Ziziphus jujubeMill)为鼠李科(Rhamnaceae)木本植物。目前市场上的大枣制品90%以上为干制品,且绝大多数采用传统自然干制或者热风干制的方式[1-2]。大枣在干制过程中容易出现大枣的口感劣变和风味物质减弱等现象[3-7]。大枣中的风味物质主要存在方式为游离态物质与键合态物质,键合态物质一般无挥发性,通常以糖苷键合态的形式存在于大枣中[8]。通过对糖苷键合态成分酶解处理,酶解为游离态物质和糖苷,可增强水果的风味[9-11]。
β-D-葡萄糖苷酶活性的测定方法主要有Barush和Swiain法、荧光法、比色法[12-13]。其中以对硝基苯基-β-D-葡萄糖醛酸苷(pNPG)为反应底物的比色法最为精确[14]。已有学者[15]以pNPG为底物对茶叶中β-D-葡萄糖苷酶的活性测定条件进行了研究,建立了茶叶中β-D-葡萄糖苷酶活性的测定条件。
此次试验以脆熟全红期哈密大枣为材料,探究β-D-葡萄糖苷酶活性测定的最佳条件,通过PVP的添加量、缓冲液的pH、反应温度和反应时间对β-D-葡萄糖苷酶活性的影响,建立哈密大枣中β-D-葡萄糖苷酶活性的检测方法。根据前期试验研究基础[16],哈密大枣在自然晒干与45 ℃热风干制条件下有较好的果型指数与细胞结构。采用此条件对哈密大枣进行干制,并对干制过程中β-D-葡萄糖苷酶的活性进行测定,为进一步研究哈密大枣在干制过程中香气成分和香气形成的机理提供理论依据[17-18]。
1 材料与方法
1.1 主要材料与试剂
哈密大枣(新疆哈密);对硝基苯基-β-D-葡萄糖醛酸苷(pNPG)、聚乙烯吡咯烷酮(PVP):上海源叶生物科技有限责任公司;对硝基苯酚、Na2CO3、柠檬酸、柠檬酸钠、磷酸氢二钠、乙酸、乙酸钠等(分析纯,国药集团化学试剂有限公司)。
1.2 主要仪器与设备
PHS-3C型雷磁pH计(上海仪电科学仪器股份有限公司);UV-7500型紫外分光光度计(上海棱光技术有限公司);JY-2002电子天平(上海良平仪器有限公司);DZKW-D-2型电热恒温水浴锅(北京市永光明医疗仪器厂);Anke GL-20G-II型冷冻离心机(上海安亭科学仪器厂)。
1.3 方法
1.3.1 样品处理
自然晒干:晾晒场地系乌鲁木齐新疆农业大学工科楼,平均日照12 h,晾晒期间最高温度27 ℃,最低气温7 ℃。脆取30 kg熟全红期哈密大枣平铺于凉席上,放置于天台空地进行晾晒,当大枣的水分含量至25%左右时停止晾晒,在自然晒干过程中每隔2 d取一次样,每次取样500 g,测定大枣中β-D-葡萄糖苷酶活性。
热风干制:干燥箱升温至45 ℃,将哈密大枣平铺于干燥箱内托盘上进行热风干制,在干制过程中每隔4 h取一次样,每次取样500 g,当大枣的水分含量至25%左右时干制结束,测定指标同上。
1.3.2 哈密大枣中β-D-葡萄糖苷酶粗酶液提取
精密称取5.0 g哈密大枣,置于经预冷的研钵内,在研磨过程中添加一定量的PVP和0.5 g石英砂,用预冷后pH 5.5的缓冲液,冰浴研磨至匀浆,在4 ℃,10 000 r/min下离心20 min,转移上清液,用缓冲液定容至10 mL,得到粗酶液,保存在4 ℃冰箱中备用。
1.3.3 哈密大枣中β-D-葡萄糖苷酶活性测定
在具塞试管中依次加入1 mL缓冲液、1.5 mL粗酶提取液和0.2 mL pNPG,迅速盖上试管塞后立即放到水浴锅中反应一定时间,之后立即加入2 mL 1 mol/L Na2CO3溶液终止反应,在对硝基苯酚的最佳吸收波长处测其吸光度。
空白对照:以加热失活的酶液进行同样处理。
酶活单位定义为每毫升酶液1 min水解1 μmol/L pNPG的酶活力为一个酶活单位U。
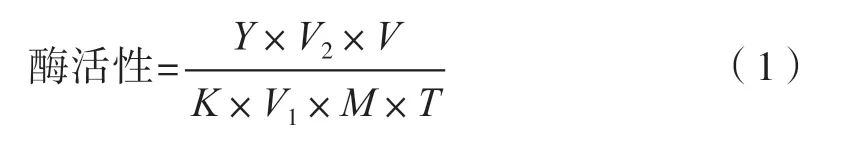
式中:K为对硝基苯酚标准曲线的斜率;V为提取酶液总量,mL;Vl为反应体系中酶液量,mL;V2为反应液总量,mL;M为样品鲜重,g;Y为酶促反应的吸光度;T为反应的时间,min。
1.3.4 波长的选择
精确称取21.0 mg对硝基苯酚,用蒸馏水定容至1 000 mL。用紫外分光光度计于390~420 nm进行全波段扫描,波长间隔为1 nm,确定对硝基苯酚最大吸收波长。
1.3.5 标准曲线的绘制
精密称取50.0 mg对硝基苯酚,以蒸馏水定容至1 000 mL容量瓶中。然后以1 mol/L Na2CO3溶液作为溶剂,进行等比稀释,以1 mol/L Na2CO3溶液作为空白对照,以对硝基苯酚浓度为横坐标,吸光度A为纵坐标,绘制标准曲线。
1.3.6 PVP添加量对酶活性的影响
在粗酶液的提取过程中,PVP的添加量分别为0,1%,2%,3%,4%和5%,在试验得到的最大吸收波长下测定其吸光度,最终根据酶活选择PVP添加的浓度。
1.3.7 不同时间和温度对酶活的影响
分别在反应温度为30,35,40,45和50 ℃条件下进行酶活反应,分别反应30,60,90,120和150 min,在得到的最大吸收波长下测定其吸光度,最终根据酶活性选择最适反应时间与温度。
1.3.8 不同缓冲溶液类型和pH对酶活性的影响
反应过程中缓冲溶液的类型分别为柠檬酸-柠檬酸三钠、乙酸-乙酸钠、柠檬酸-磷酸二钠,pH分别为4,4.5,5,5.5,6,6.5和7,其他测定条件保持一致,在最大吸收波长处测定吸光度,确定最适缓冲溶液类型与pH。
1.3.9 响应面优化提取条件
在单因素试验的基础上,采用Design-Expert V 8.0.6软件进行四因素三水平响应面试验设计,以β-D-葡萄糖苷酶活性为响应值进行回归分析,建立二次回归模型以及二次回归方程。
1.4 数据统计分析
此次试验的所有数据均取3次重复试验的平均值,采用Origin Pro软件进行制图及Design-Expert V 8.0.6软件和Box-Behnken试验方法设计响应面优化分析。
2 结果与分析
2.1 单因素试验分析
2.1.1 吸收波长的选择
由图1可知,对硝基苯酚在390~420 nm可见光波长范围内有特征吸收曲线,且在400 nm处有最大吸收峰,因此确定400 nm是对硝基苯酚的最适测定波长。
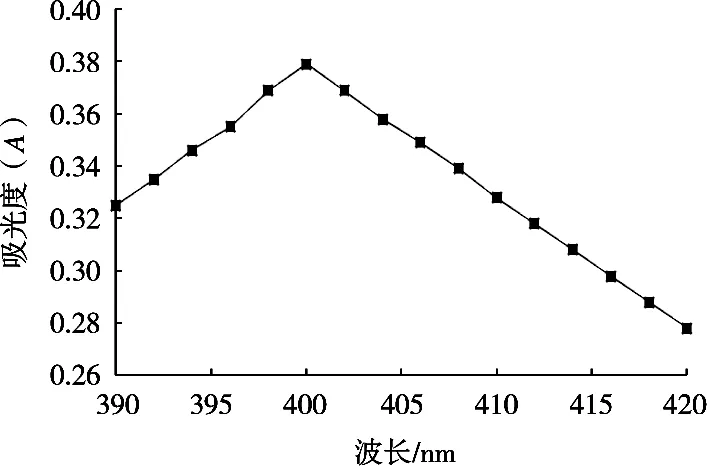
图1 对硝基苯酚波长扫描
2.1.2 对硝基苯酚标准曲线
由图2可知,标准曲线为y=0.017 2x+0.007 4,相关系数R2=0.999 1,对硝基苯酚与吸光度线性关系良好,符合测定要求。
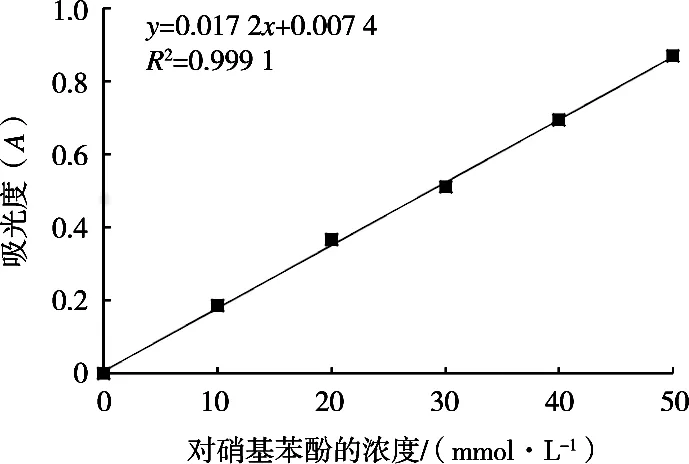
图2 对硝基苯酚标准曲线
2.1.3 PVP添加量对酶活性的影响
PVP能够在酶解的过程中吸附多酚类物质,提取酶液过程中添加适量的PVP能够防止多酚类物质对酶活性的影响,通过在提取酶液的过程中适当控制PVP的添加量,对改变酶活性起着重要的作用。由图3可知,随着PVP的添加量逐渐增加,酶活性逐渐升高,当PVP的含量添加到3%时酶活性达到最高。添加过量的PVP,酶活性呈现下降趋势。
2.1.4 反应温度与反应时间对酶活性的影响
由图4可知,酶促反应在35 ℃时线性关系最好,40 ℃次之,50 ℃较差。并且在35 ℃ 90 min条件下酶活性相对较高,条件最优。
2.1.5 缓冲溶液类型与pH对酶活性的影响
在2.1.3和2.1.4试验基础上,对反应过程中缓冲溶液的类型与pH进行筛选。由图5可知,乙酸-乙酸钠在pH 5.5时的酶活性明显高于其他类型的缓冲溶液,柠檬酸-柠檬酸三钠与柠檬酸-磷酸二钠的酶活性较低。由此得出,选用乙酸-乙酸钠在pH 5.5时对哈密大枣中β-D-葡萄糖苷酶活性进行测定的效果最好。
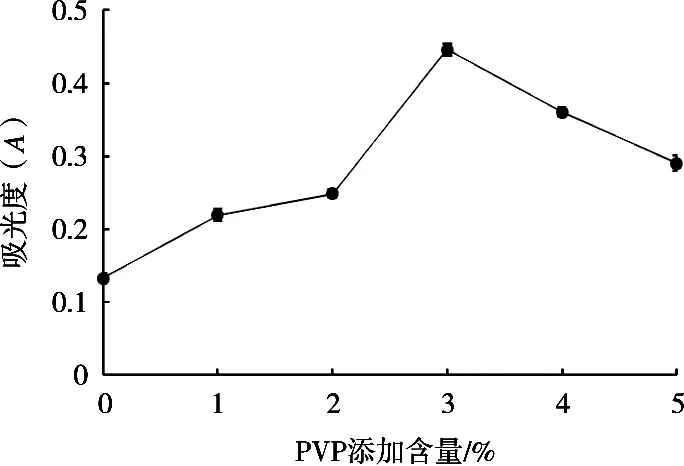
图3 PVP添加量对酶活性的影响
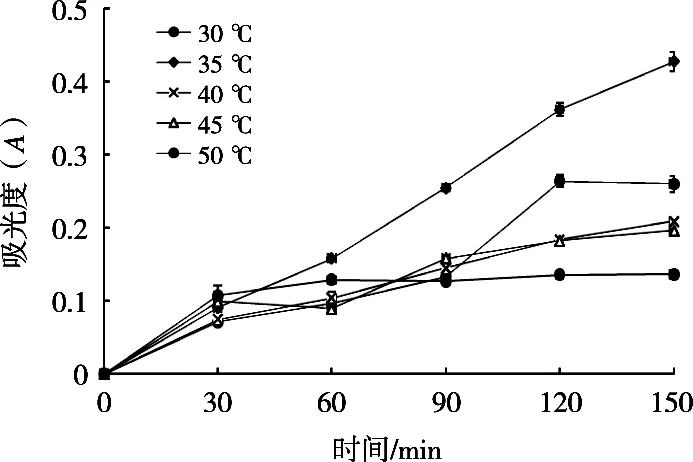
图4 不同温度、时间对酶活性的影响

图5 不同缓冲液类型和pH对酶活性的影响曲线
2.2 响应面试验设计与结果分析
2.2.1 响应面四因素三水平设计方案及结果
在单因素试验基础上,以酶解温度、酶解时间、pH、PVP添加量为自变量,酶活性作为响应值,设计四因素三水平的二次回归方程拟合自变量与酶活性之间的函数关系,采用响应面分析法优化酶解工艺。见表1。

表1 响应面试验因素与水平表
采用Design-Expert V 8.0.6软件进行回归分析,得出回归方程:Y=1 366.23+25.78A+97.28B+26.16C+74.24D-2.34AB+6.01AC-16.25AD-12.41BC+64.38BD+62.05CD-543.83A2-255.20B2-424.15C2-450.62D2。在回归方程中,试验回归方程的二次项系数为负值,表明响应值有极大值点,可进行优化分析。响应面结果见表2。

表2 设计响应面试验方案及结果
由表3、图6和图7可知,模型的显著性检验p<0.000 1,R2=0.993 3,该模型高度显著,失拟项不显著(p=0.052 8),回归模型和实际试验拟合充分,模型可行性和精准度高,可以用该模型对哈密大枣中β-葡萄糖苷酶的活性进行分析测定。F(A)=4.74,F(B)=67.46,F(C)=4.88,F(D)=39.28,各因素对β-D-葡萄糖苷酶活性影响顺序为酶解温度>酶解时间>PVP添加量>缓冲液pH,其中PVP添加量与酶解时间对β-D-葡萄糖苷酶活性影响极显著(p<0.001),pH与酶解温度对哈密大枣中β-D-葡萄糖苷酶活性影响差异显著(p<0.05)。一次项B(酶解温度)、D(酶解时间)影响差异极显著(p<0.001),交互项BD(pH和酶解温度)以及CD(PVP添加量和酶解时间)影响差异高度显著(p<0.01),4个二次项的影响差异极显著(p<0.001)。综合得出,各因素对哈密大枣中β-D-葡萄糖苷酶活性影响呈不同的线性关系。各因素在试验范围内,响应面坡度越大,响应值对不同条件的变化越敏感;响应面坡度越平缓,对响应值的影响越小。
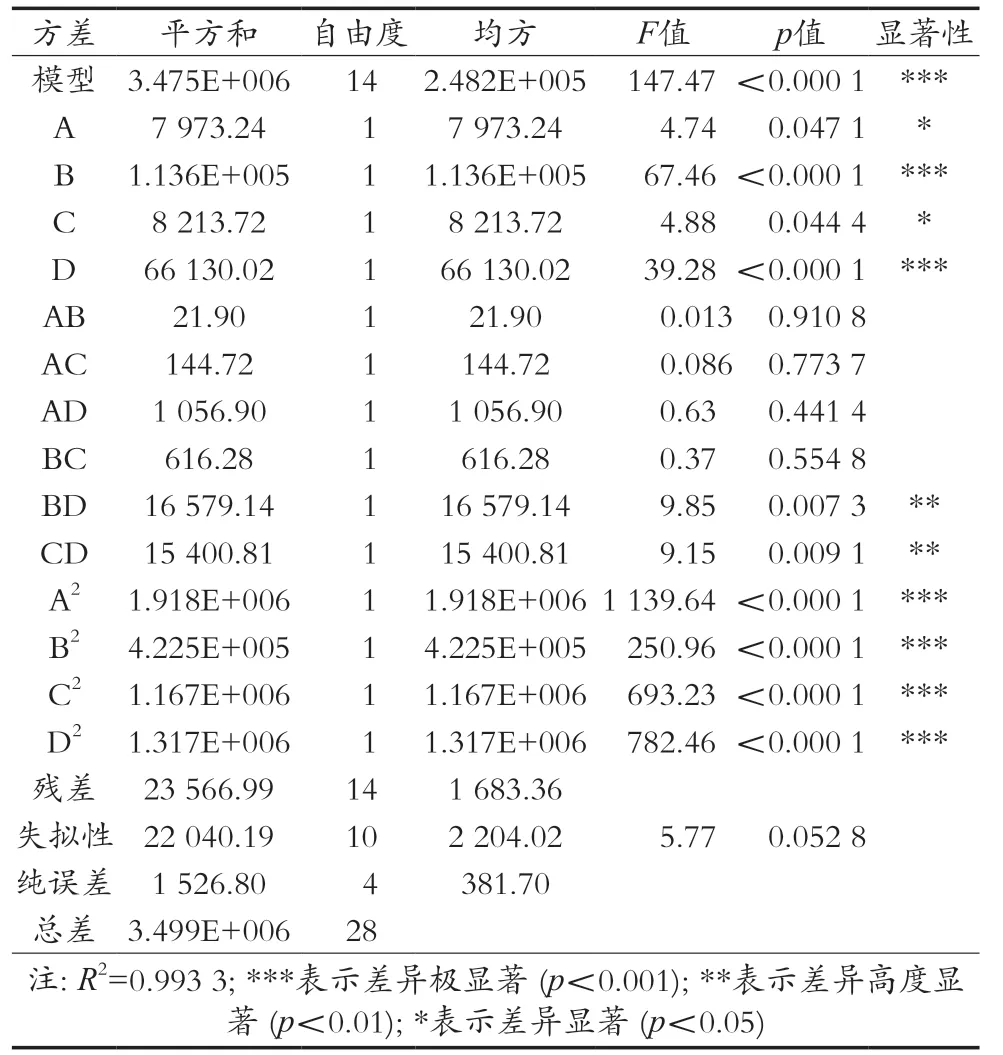
表3 响应面回归方程方差分析结果
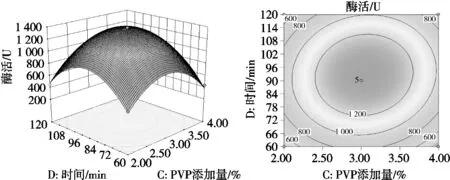
图7 酶解时间和PVP添加量对β-D-葡萄糖苷酶活性影响的响应面图
2.2.2 最佳条件的确定及验证试验
该模型得到的最优处理水平为缓冲溶液pH 5.23,PVP添加量3.03%,酶解温度36.03 ℃,酶解时间93.27 min。在此条件下哈密大枣中β-D-葡萄糖苷酶活性为1 204.88 U。考虑到操作的实际性,将实际试验条件调整为酶解时缓冲溶液的pH 5.3,PVP添加量3%,酶解温度36 ℃,酶解时间94 min。在此条件下重复3次试验,β-D-葡萄糖苷酶的活性为1 200.56 U,与模型相符。
2.2.3 不同干制方式对哈密大枣中β-D-葡萄糖苷酶活性的影响
由图8和图9可看出,自然晒干与45 ℃热风干制过程中β-D-葡萄糖苷酶的活性呈现先上升后下降的趋势。在自然晒干条件下,β-D-葡萄糖苷酶活性在干制第2天上升到最高点(1 700.32 U),从第2天起呈下降趋势,在第6天酶活消失。在45 ℃热风干制过程中,β-D-葡萄糖苷酶活性持续时间较短,β-D-葡萄糖苷酶在第8小时酶活性达到最高,从第12小时开始下降,在第16小时酶活下降速率趋于平缓,在第36小时酶活性消失。综合分析,哈密大枣在干制过程中β-D-葡萄糖苷酶活性变化均呈现干制期前期酶活性较高,干制结束时期开始下降的趋势。
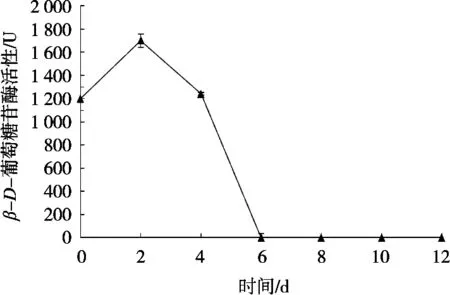
图8 自然晒干过程中β-D-葡萄糖苷酶活性的变化
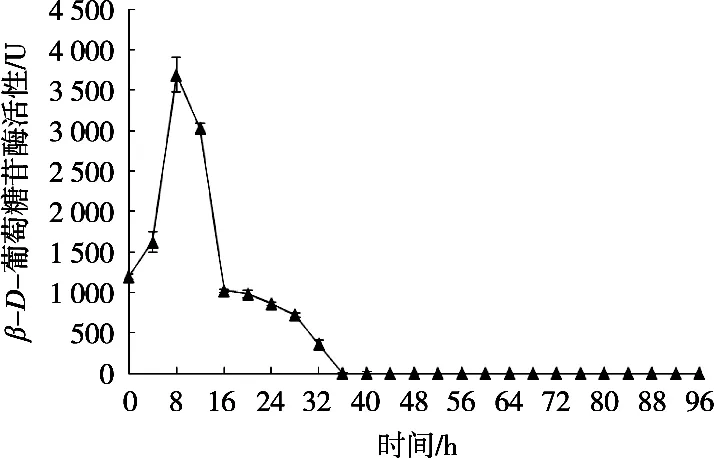
图9 45 ℃热风干制过程中β-D-葡萄糖苷酶活性的变化
3 结论
对脆熟全红期哈密大枣中β-D-葡萄糖苷酶测定过程中缓冲溶液的pH、PVP添加量、反应时间、反应温度以及测定波长对酶活性影响进行试验。结果显示,当酶解时缓冲溶液的pH为5.3,PVP添加量为3%,酶解温度为36 ℃,酶解时间为94 min,测定波长为400 nm时,β-D-葡萄糖苷酶活性最大。在自然干制过程中,β-D-葡萄糖苷酶活性在干制第2天上升至最高点(1 700.32 U),在第6天酶活性消失;在45 ℃热风干制过程中,β-D-葡萄糖苷酶在第8小时酶活性到达最高点,在第36小时酶活性消失。通过β-D-葡萄糖苷酶活性测定条件的确定,探究不同干制方式以及干制过程中β-D-葡萄糖苷酶活性的变化规律,对大枣中β-D-葡萄糖苷酶活性与香气成分的种类和含量的相关性有待进一步研究。
