黄秋葵多糖的提取纯化及其喷雾干燥粉的开发
2021-01-18王坤立傅娆李贝倪元颖
王坤立,傅娆,李贝,倪元颖
1. 中国农业大学食品科学与营养工程学院(北京 100083);2. 国家果蔬加工工程技术研究中心(北京 100083)
黄秋葵(Abelmoschus esculentus)别名秋葵、羊角豆、洋辣椒,属于锦葵科(Malvaceae)秋葵属(AbelmoschusMedic),为一年生草本植物[1]。黄秋葵在中国种植面积逐渐扩大,是一种有较大经济潜力的新型蔬菜。研究发现,黄秋葵嫩荚中含有丰富的黏性多糖物质,主要是由阿拉伯聚糖、鼠李糖、半乳聚糖、果胶类多糖及少量糖蛋白组成的混合物[1-2]。黏液是黄秋葵最突出的特点,此黏液可以助消化、防便秘、促进胆固醇物质排出体外、治疗胃炎、保护肠胃,润滑关节、增强身体抵抗力、抗疲劳[3-4]。多糖是一种大分子化合物,具有非常重要的生物功能,是现代医学和食品功能化学关注的焦点之一[5-6]。多糖大多采用热水浸泡提取[7],但热水浸提存在时间长、得率低的缺点。
随着国民的健康意识越来越强,营养保健成为广大人民群众的基本需求之一。保健食品的功能也扩展到各种生物活性功能,如抗疲劳、降血糖、调节免疫、降血脂等[8]。然而除了市场上出现的黄秋葵冻干食品、黄秋葵罐头、黄秋葵饼干、黄秋葵酸奶等加工产品,黄秋葵的保健产品种类较少,因此具有很大开发空间。
采用超声辅助热水提取黄秋葵多糖,其效率较传统热水浸提法有显著提高;鉴定黄秋葵多糖功能性多糖组分;研制黄秋葵多糖喷雾干燥粉,筛选多糖粉辅料,对多糖粉的收率、抗氧化能力进行测定。试验旨在为黄秋葵的深加工、黄秋葵保健品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
黄秋葵(产于青海省贵德县,冷冻运输,-60 ℃冻存)。
DEAE Sepharose Fast Flow和Sepharose CL-6B填料(Pharmacia公司);葡聚糖T-series标准品(色谱纯,Sigma公司);麦芽糊精、β-环糊精、可溶性淀粉、卵磷脂、氢氧化钙(均为食品级,广州嘉德乐生化科技有限公司);总抗氧化能力测定试剂(南京建成生物工程研究所);其余试剂(均为分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备
KQ-500DE超声波清洗器(昆山市超声仪器有限公司);R-100旋转蒸发仪(BUCHI);FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司);T6紫外可见分光光度计(北京普析通用仪器有限公司);TH-500A梯度混合器(上海青浦沪西仪器厂);HL-2恒流泵(上海沪西分析仪器厂);BSZ-100自动部份收集器(上海沪西分析仪器厂);Nicolet Nexus FT-IR红外光谱仪(美国Thermo Electron公司);DSH水分活度测定仪(上海佑科仪器仪表有限公司);FB-110F1500ML喷雾干燥机(上海励途机械设备工程有限公司);Finnigan Trace GC-2000气相色谱仪(美国Finnigan公司);Finnigan DSQ质谱仪(美国Thermo Finnigan公司);高效液相色谱(美国Waters公司)。
1.3 试验方法
1.3.1 黄秋葵粗多糖的提取纯化
提取:参照Wang等[9]的方法进行黄秋葵粗多糖(ROP)的提取。ROP得率计算如式(1)。
ROP得率=粗多糖冻干粉质量(g)/提取用黄秋葵干粉质量(g)×100% (1)
纯化:准确称取ROP 70.0 mg,溶于21 mL pH 7.4的Tris-HCl缓冲液中,经孔径0.45 μm混合纤维素微孔膜过滤。将处理好的样品溶液缓慢上样于DEAE Sepharose Fast Flow阴离子交换层析柱(2.6 cm×20 cm),吸附20 min。依次用150 mL缓冲液洗脱、200 mL含0~0.6 mol/L NaCl的缓冲液梯度洗脱,洗脱速度4 mL/min,8 mL/tube收集。采用苯酚-硫酸法测定样品液中的糖含量[10-11]。根据洗脱曲线收集洗脱峰,用扁平宽度26 mm、透过相对分子质量为8 000~14 000 Da的透析袋透析72 h,冻干。
1.3.2 黄秋葵粗多糖组分纯度鉴定
凝胶柱层析检测:准确称取多糖样品10.0 mg,溶于4 mL微滤水中,经孔径0.22 μm混合纤维素微孔膜过滤,上样于Sepharose CL-6B凝胶柱。用0.15 mol/L NaCl的微滤水以1 mL/min,4.0 mL/tube洗脱样品。采用苯酚-硫酸法测定洗脱液中的糖含量。根据洗脱曲线收集洗脱峰,透析(方法同1.3.1),冻干。
高效液相色谱检测:使用Shodex SB-805HQ色谱柱,以0.1 mol/L NaNO3为流动相,柱温38 ℃、进样量20 μL、体积流量0.8 mL/min、检测池温度45 ℃。用KANUER示差折光检测器跟踪检测,得到样品在色谱柱中的保留峰。用葡聚糖T-系列标准品:T-1(1 kDa),T-7(7 kDa),T-10(10 kDa),T-40(40 kDa),T-500(500 kDa),T-1000(1 000 kDa)作标准曲线[12]。根据标品的保留时间(x)和其相对分子质量的对数(y)制作标准曲线,所得方程为y=-1.282 7x+20.136(R2=0.998 9)。
1.3.3 黄秋葵粗多糖组分的单糖组成分析
参照Li等[13]方法,取2 mg黄秋葵粗多糖组分样品进行前处理。GC-MS色谱条件:采用Agilent公司的GC-MS分析仪进行分析,DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);初始柱温50 ℃,100 ℃(15 ℃/min)、170 ℃(10 ℃/min)、300 ℃(3 ℃/min);进样口温度250 ℃,检测器温度280 ℃,以He作载气,进样量0.5 μL,流速0.8 mL/min,分流比1∶30;质谱条件为电子轰击源EI,电子能量70 eV,倍增器电压350 V,接口温度250 ℃,离子源温度200 ℃,质量数扫描范围10~800 amu。
1.3.4 黄秋葵多糖喷雾干燥粉的开发
称取一定量过孔径0.425 mm筛的黄秋葵冻干粉[14],经脱脂、脱游离糖的前处理,分别按照1∶30(g/mL)的料液比加入去离子水,用饱和石灰水调节至pH 7.6±0.3。在功率522 W、温度59 ℃下超声30 min,以8 000 r/min离心8 min,取上清液。重复超声提取操作3次,将上清液合并,减压浓缩[9]。在进风温度170 ℃,蠕动泵转速21 r/min,通针8 s(通针间隔指2次喷雾的间隔时间),风速50 Hz,进气压力0.5 MPa,添加7.5%卵磷脂,固形物含量1.1%条件下,考察不添加助干剂以及添加量为总固形物含量40%的不同助干剂(麦芽糊精、β-环糊精及可溶性淀粉)对产品喷雾干燥的综合影响。
1.3.4.1 喷雾干燥工艺单因素试验
在风速50 Hz,进气压力0.5 MPa,添加7.5%卵磷脂,固形物含量1.1%条件下,分别考察β-环糊精添加量(10%,20%,30%,40%和50%)、进风温度(150,160,170,180和190 ℃)、蠕动泵转速(17,19,21,23和25 r/min)、通针间隔(2,6,10,14和18 s)等对产品喷雾干燥的综合影响。评价主要从含水率、粉末收率、抗氧化保留率和喷雾效果4个方面进行[15]。喷雾干燥粉末的含水率通过DSH水分活度测定仪测得。
粉末收率=喷雾干燥粉末质量(g)/喷雾干燥液固形物含量(g)×100% (2)
具体评分方法为含水率、粉末收率和抗氧化保留率中的最大值定为10分,3项中其余的按照其与最大值的比例分别评分,最终的综合评分结果等于3个指标的分值相加。喷雾效果则通过感官评定。
1.3.4.2 喷雾干燥工艺正交优化试验
通过单因素试验,发现β-环糊精添加量、进风温度和通针间隔3个因素对黄秋葵多糖液喷雾干燥效果的影响最大。以这3个因素为自变量,以单因素试验得出的各个最佳条件为中心点,以黄秋葵多糖喷雾干燥粉的综合评分为响应值,进行三因素三水平正交试验方案,详细条件见表1。

表1 喷雾干燥试验因素水平表
1.3.5 总抗氧化能力测定
采用南京建成总抗氧化能力测定试剂盒进行多糖干粉的抗氧化能力测定。以抗坏血酸为阳性对照,绘制标准曲线,y=0.004 48x+0.018 42(R2=0.997)。
总抗氧化能力定义:37 ℃时,与0.4 mL 10 mg/mL的样品有相同吸光度(抗氧化效果)的抗坏血酸的量为总抗氧化能力(μg)。
抗氧化保留率=样品的总抗氧化能力/黄秋葵多糖喷雾干燥原料的抗氧化能力×100% (3)
1.3.6 傅里叶红外光谱扫描
参照Woo[15]的方法进行试验。将黄秋葵多糖ROP-2与OPSP的红外光谱扫描图进行比对分析。
1.3.7 数据分析
采用SPSS 20分析软件及Microsoft Excel 2010软件进行试验数据统计处理。显著水平p=0.05,p<0.05时,表示存在显著性差异。采用Origin 9进行图形处理和分析。
2 结果与分析
2.1 黄秋葵粗多糖的提取及纯化
ROP的得率为10.35%,其中多糖含量为47.92%,蛋白质含量为2.13%。试验结果与已报道的热水提取工艺[16]相比较,提取温度下降31 ℃,提取时间缩短10 h,得率提高64.15%。
ROP的洗脱曲线如图1,对其3个主要的峰分别命名为ROP-1、ROP-2和ROP-3。由去离子水洗脱得到ROP-1,由浓度约0.15 mol/L和0.4 mol/L的NaCl溶液洗脱分别得到ROP-2和ROP-3。结果表明,试验获得的3种黄秋葵多糖组分中,ROP-2是中性多糖,ROP-1、ROP-3为酸性多糖。由于实际操作中ROP-1和ROP-3的得率过低,无法收集,故仅对ROP-2进行收集研究。进样量70.00 mg,收集ROP-2 26.74 mg,得率为38.2%。
2.2 黄秋葵粗多糖组分纯度鉴定
对ROP-2进行凝胶柱(Sepharose CL-6B)[17]和HPLC法[18]进行纯度鉴定。从图2和图3均可以看出,ROP-2的洗脱曲线均为单一对称峰,可以证明其为均一组分。图3中ROP-2出峰时间为11.58 min,根据标准曲线方程y=-1.282 7x+20.136(R2=0.998 9)计算可以得出ROP-2的相对分子质量为1.92×105Da。
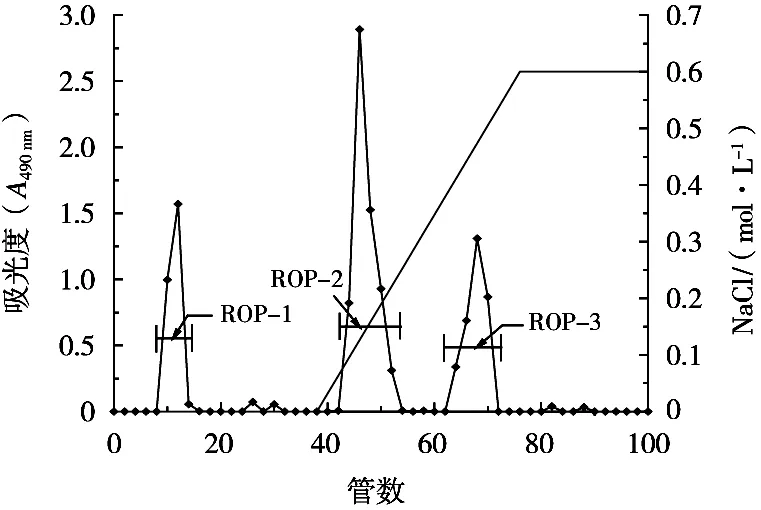
图1 离子交换层析结果
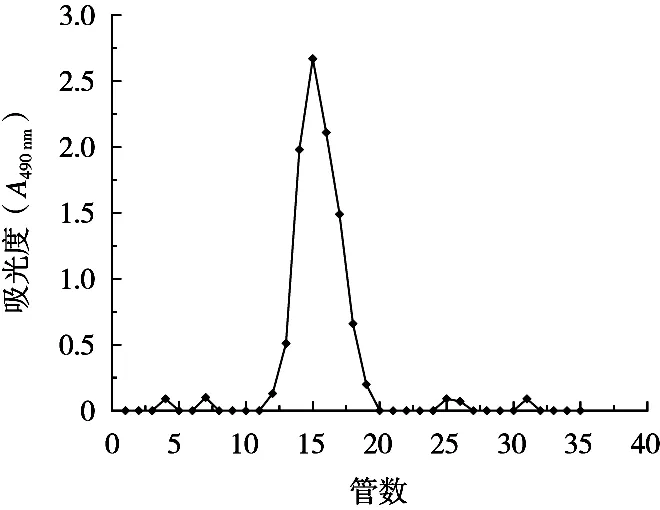
图2 ROP-2 Sepharose CL-6B凝胶过滤曲线

图3 ROP-2的HPLC洗脱曲线
2.3 黄秋葵粗多糖组分的单糖组成分析
通过GC-MS分析表明,ROP-2主要由葡萄糖、甘露糖、半乳糖、阿拉伯糖、木糖、果糖、鼠李糖组成。
2.4 黄秋葵多糖喷雾干燥粉助干剂的选择
从表2可知,与未添加助干剂的样品相比,3种助干剂均可大幅降低OPSP含水率并可提粉末收率。这主要是由于糖类玻璃化转化温度较低,黄秋葵多糖液糖类物质含量较高,而3种助干剂均可提高样品的玻璃化转化温度,使雾滴颗粒容易转变为玻璃态,从而提高粉末收率[19]。此外,助干剂为β-环糊精时,黄秋葵多糖喷雾干燥粉抗氧化保留率最高,达到83.64%±1.23%。这可能是由于β-环糊精是聚合度为7的低聚糖,其结构具有高度的对称性,呈圆筒形立体结构,分子中的糖苷键是共平面,疏水性基团在环内,亲水性基团在环外,可使β-环糊精很容易包裹样品中的抗氧化活性物质,从而保护其不被高温破坏[20]。综合4项指标,采用β-环糊精作为黄秋葵多糖液的喷雾干燥助干剂。
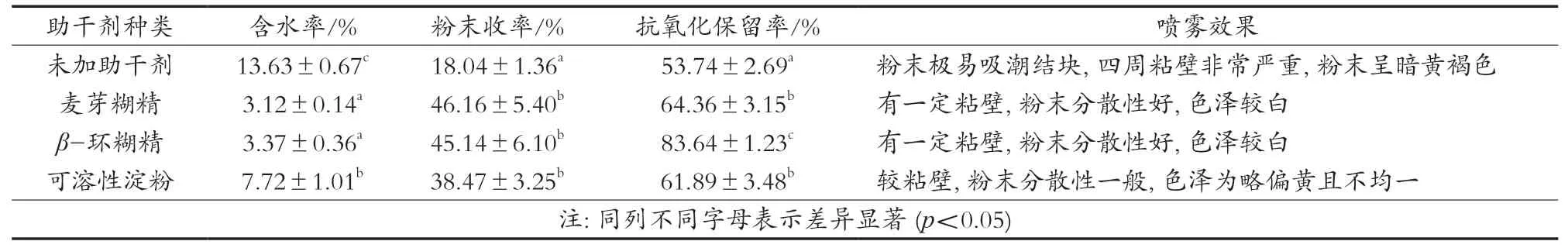
表2 不同助干剂对喷雾干燥效果的影响
2.5 喷雾干燥工艺单因素试验结果
不同β-环糊精添加量的试验结果(图4A)表明,随着添加量增加,OPSP的含水率下降,粉末收率明显上升。抗氧化保留率先上升,在40%添加量时达到最大值83.64%±1.23%,随后稍有下降。这可能是因为添加量增大,对黄秋葵多糖的保护效果增强,故抗氧化保留率上升。但添加量过大会降低干粉中的多糖比例,故抗氧化保留率在较高添加量下成下降趋势。从图4A可以看出,在40%添加量时达到最大分值28.40±1.95,即喷雾干燥综合效果最好。随着添加量增大,喷雾效果有明显改善,挂壁情况减轻、粉末分散性好、色泽佳。故选择30%,40%和50%这3个添加量进行后续的正交试验。
随着温度的升高,OPSP含水率明显下降,粉末收率则先上升后下降;抗氧化保留率随着温度的升高显著降低,推测是高温破坏了多糖的结构进而降低其抗氧化活性。从图4B看出,进风温度在170 ℃时综合评分达27.83±1.37。温度较低时,有粘壁现象,随着温度上升,粘壁现象减轻、粉末分散性变好。但在190 ℃的高温下,多糖干粉有轻微焦糊现象。综合上述分析,选择160,170和180 ℃这3个进风温度进行后续的正交试验。
随着蠕动泵转速加快,OPSP含水率升高,粉末收率和抗氧化保留率都成先升高后降低的趋势。因为转速越高,进料速度越快,样品中水分蒸发不完全,粘壁现象也较其他条件严重。图4C为不同蠕动泵转速的分数,在21 r/min时综合评分显著高于其他4个条件下的总分,达到28.82±1.57分,其他4个条件总分无显著性差异。因此,选定21 r/min为喷雾干燥的蠕动泵转速。
随着通针间隔增长,各含水率之间无显著性差异,粉末收率则呈先增长后下降趋势。通针间隔短,喷雾压力小,多糖液雾化颗粒无法形成,或形成的液滴颗粒直径较大、比表面积小,热交换不充分,故难以达到物料的玻璃化温度,从而导致粉末收率较小;通针间隔大于14 s时,所形成的雾化液滴虽然水分蒸发面积大、热交换充分,但由于颗粒小,容易被热空气带走,粉末收率反而下降[20]。通针间隔过高或过低,都使得粘壁现象加重,喷雾效果相对较差。由图4D可知,综合评分呈现先增后减的趋势,10 s时分数最大,为29.16±0.37。因此,选择6,10和14 s 3个通针间隔进行后续的试验。
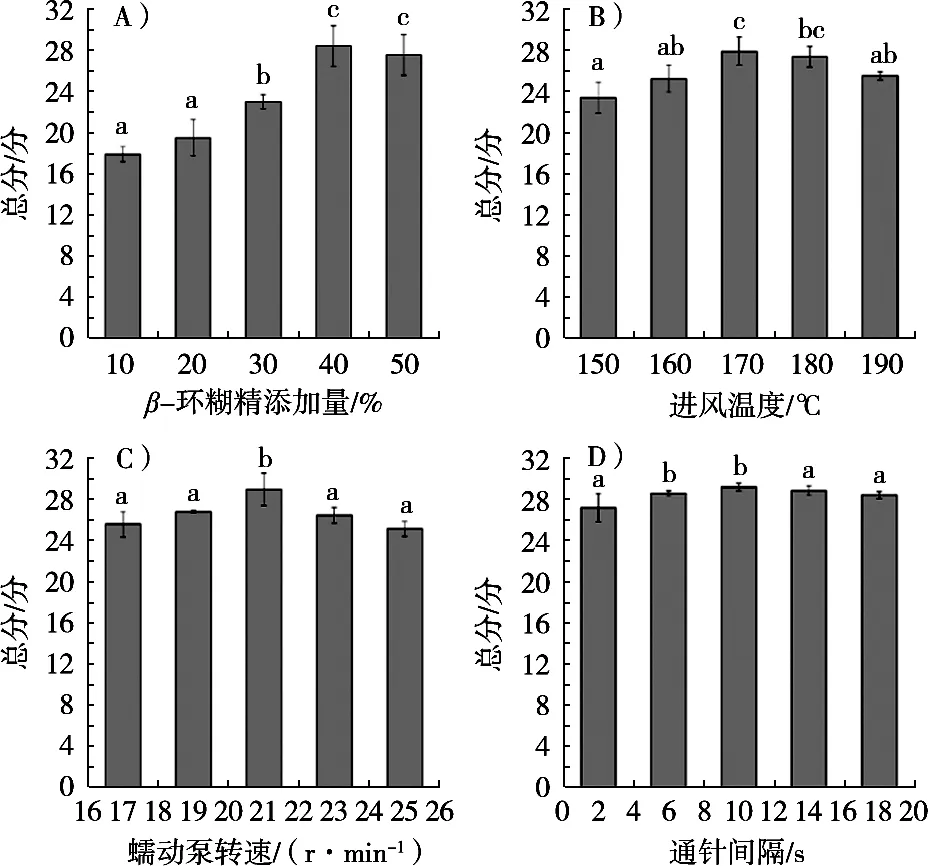
图4 喷雾干燥工艺单因素试验结果
2.6 喷雾干燥工艺正交优化试验结果
根据单因素试验中β-环糊精(A)、进风温度(B)和通针间隔(C)对喷雾干燥总分数的影响进行分析,以含水率、粉末收率和抗氧化保留率的综合评分为指标,采用三因素三水平的正交设计,结果见表3和表4。由表3知,各因素的影响的主次顺序为B>A>C(进风温度>β-环糊精添加量>通针间隔)。由表4知,β-环糊精添加量和进风温度的3个水平的变动均对喷雾干燥总分数有显著性影响(pβ-环糊精添加量<0.05,p进风温度<0.01);通针间隔(C)的F<9,表明该因素的3个水平的变动对喷雾干燥总分数没有显著性影响。通过极差分析,可以确定正交试验最佳组合为A2B2C1,最佳工艺条件为添加40%的β-环糊精,进风温度170 ℃,通针间隔6 s。经验证,在所得最佳工艺条件下,含水率3.29%,粉末得率45.26%,抗氧化保留率83.31%,总得分29.39分。
2.7 傅里叶红外光谱扫描结果
ROP-2与OPSP的红外扫描图谱重合性较高(图5),说明喷雾干燥没有给黄秋葵多糖的结构和官能团造成太大改变。试验证明ROP-2有体外抗氧化功能,故红外扫描光谱给OPSP具有体外抗氧化性提供支持。
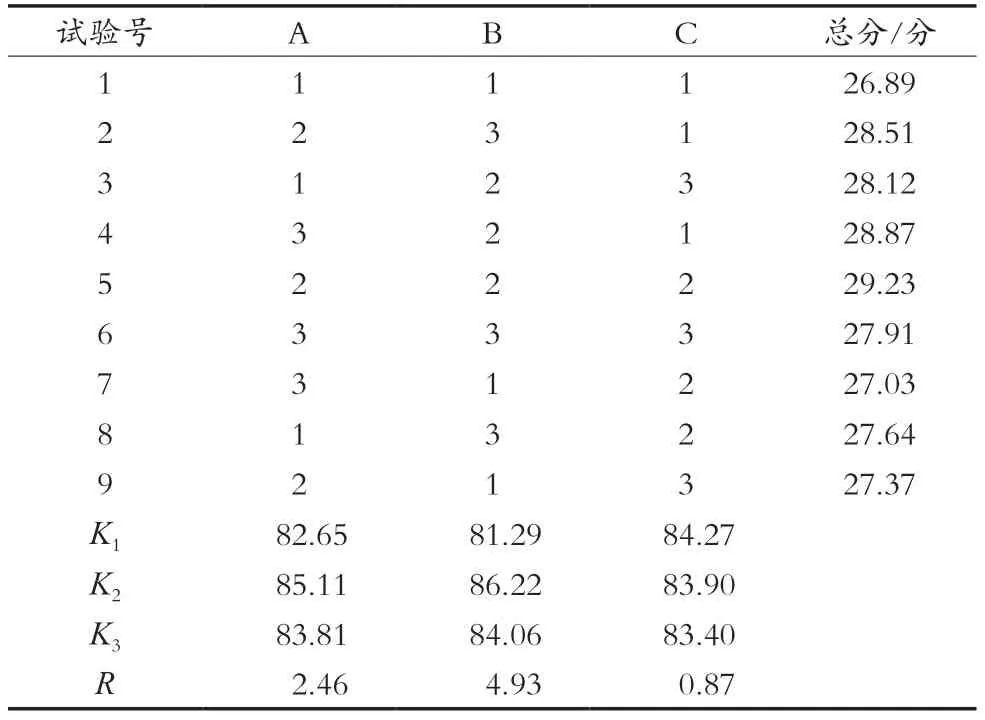
表3 正交试验结果与极差分析
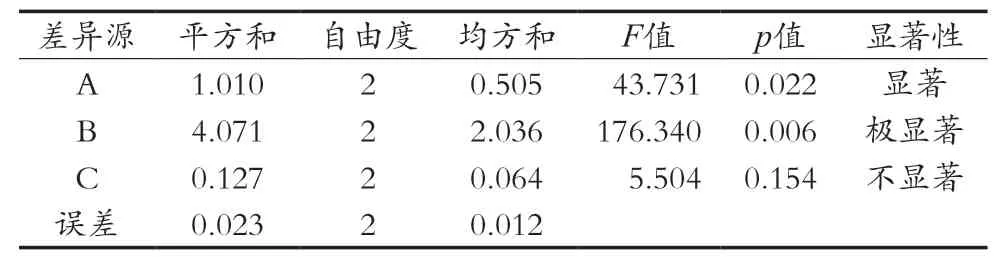
表4 正交试验方差分析

图5 ROP-2和OPSP的红外扫描图
3 结论
试验制备ROP的超声辅助提取与POSP。试验的提取方式与现已报道的热水提取工艺相比较,温度下降31 ℃,提取时间缩短10 h,得率提高64.15%。因此超声辅助提取是一个值得推广的ROP提取方式。试验还对ROP功能性组分进行分离、鉴定。通过助干剂筛选试验,确定β-环糊精作为喷雾干燥的助干剂。通过正交试验,确定制备黄秋葵多糖喷雾干燥粉的最佳工艺条件。红外光谱扫描结果以及体外抗氧化性测定结果显示喷雾干燥的加工方式并未对ROP的结构和官能团造成太大影响。试验结果为ROP的高效提取和组分鉴定提供理论基础,也为黄秋葵高值化深加工提供思路和基本试验参数。
