腰椎术后感染应用万古霉素致药物热伴白细胞减少1例
2021-01-18历冬旭王学昌陈春梅
历冬旭,王学昌,陈春梅
万古霉素是临床常用的一种糖肽类抗菌药物,主要用于治疗革兰阳性球菌感染,治疗窗窄,易产生不良反应,是发生药物热几率较高的一类药物[1-2]。抗菌药物相关药物热极易与原有感染性疾病相混淆,临床中白细胞减少也是抗菌药物常见不良反应,两者可单独发生也可同时发生[3]。药物热伴白细胞减少还可能伴有其他临床症状或体征,常与结缔组织疾病、自身免疫性疾病等表现极其类似,而且缺少特异性的检验指标,往往依靠排除性诊断及经验性的诊断方式,导致病情延误,增加患者痛苦和医疗支出,因此诊断抗菌药物相关药物热极为关键[4]。近年来万古霉素导致的不良反应常有发生,但并未引起医疗工作者的高度重视,误诊率仍居高不下,现提供个案为万古霉素导致的不良反应再提供有力证据,同时希望为广大临床工作者提供用药参考。
1 病例资料
1.1 临床资料 患者,男,63岁,因“双下肢疼痛麻木10余年,加重2年余”于2020年11月9日入院,于11月13日行“腰椎锥体间融合术,后入路”,围术期予头孢拉定预防感染,留置引流管处理,术后第2天开始发热,体温38.0 ℃,后反复发热,最高体温(Tmax)39.1 ℃,红细胞沉降率(ESR)47 mm/h、C反应蛋白(CRP)48 mg/L、降钙素原(PCT)0.2 ng/ml,白细胞计数(WBC)、中性粒细胞绝对值(NEUT)无明显异常。考虑术后感染,先后使用头孢呋辛、哌拉西林他唑巴坦抗感染,体温波动在37.5~38.2 ℃,于11月30日使用注射用盐酸万古霉素治疗7 d,体温下降不明显,MR提示软组织肿胀明显,于12月8日行肌肉清创术,引流液、伤口分泌物及穿刺液培养均提示表皮葡萄球菌,药敏试验对万古霉素、左氧氟沙星等敏感,清创术后体温仍异常升高,Tmax 39.6 ℃,给予“注射用万古霉素及注射用美罗培南”联合抗感染治疗,但患者体温仍处于中高热且白细胞进行性下降,最低为2.39×109/L。
1.2 诊疗过程 经一系列的对症治疗和抗感染治疗无效后,请求临床药师会诊。临床药师仔细阅读病历后,查阅相关文献并做出以下思考:患者多次微生物培养提示表皮葡萄球菌,结合其手术时间长、出血多等高危因素,多考虑术后感染,但患者精神状态良好,全身中毒症状不明显,不能排外药物热。建议停用美罗培南及可能引起白细胞减少的药物,行“万古霉素血药浓度检测”,如果血药浓度足够,可更换盐酸左氧氟沙星注射液0.75 g,必要时可加用利福平胶囊0.3 g口服,每天2次。万古霉素血药浓度监测(谷)为19.6 μg/ml,12月16日后更换抗菌药物为左氧氟沙星0.75 g静脉滴注。12月17-20日未发热,体温平稳4 d,最高体温37.1 ℃,考虑现治疗方案有效并维持治疗方案。但12月21日夜间出现全身性皮疹,为弥漫性红斑、丘疹、斑丘疹伴皮肤剧烈瘙痒。12月22日实验室检查显示WBC和NEUT较前有所上升,PCT和RCT略有下降,虽左氧氟沙星控制感染有效但考虑其所致的药物性皮炎,故12月23日停用左氧氟沙星,将其更改为万古霉素继续抗感染治疗。12月24日体温再次升高达39.0 ℃,伴头痛、出汗,无明显腰腿及下肢麻木不适感。12月25日停用万古霉素改用利福平抗感染、抗过敏等支持对症治疗。12月27日患者体温、白细胞恢复正常,皮疹基本消退。直至12月31日患者未再发热,无明显皮疹及瘙痒后,患者及家属要求好转出院。诊疗过程实验室检测结果见表1。
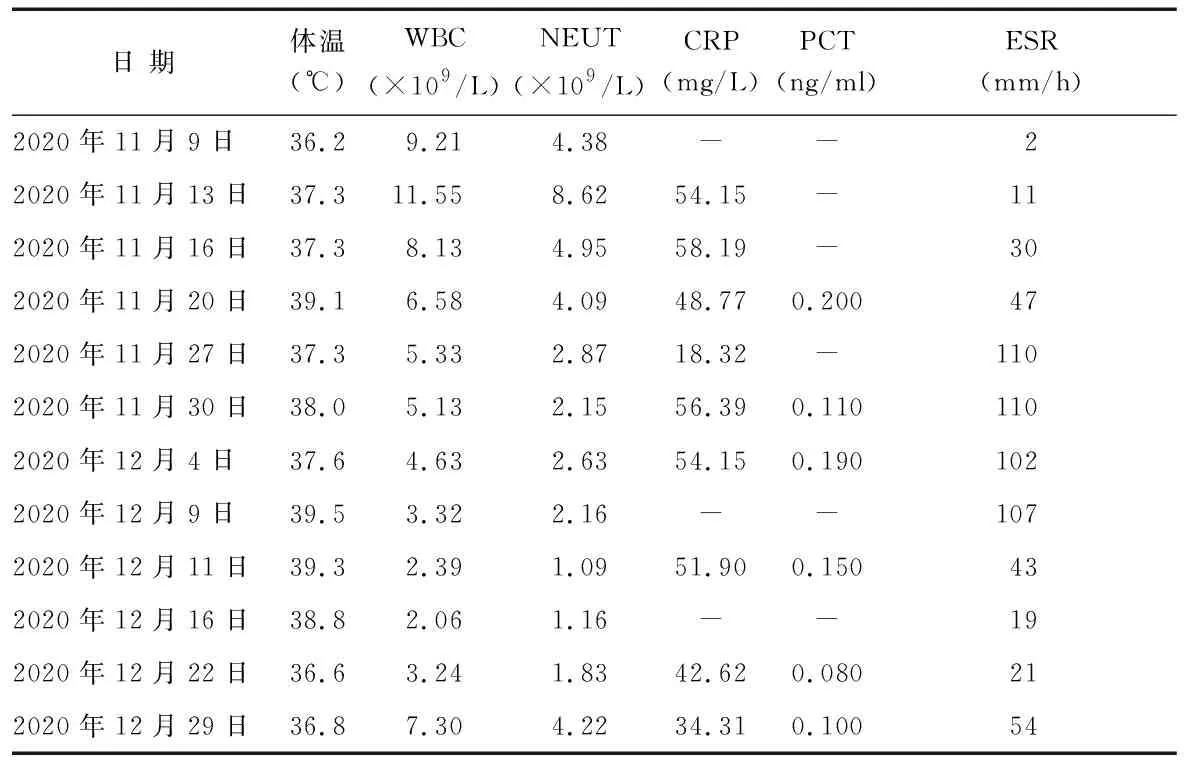
表1 患者住院期间体温和实验室检测结果
2 讨 论
2.1 抗菌药物引起药物热和白细胞减少的机制 药物热是一种由药物引起的发热,有时会伴有一般症状,如白细胞减少症、嗜酸性粒细胞增多症等,但在所有病例中,发现实验室指标异常总是轻中度的,一般来说预后良好,这种药物不良反应很常见,尤其是抗菌药物[5]。药物热的发病机制尚未完全明确,可能与给药途径、药理作用、特异质反应、不合理的药物联用及变态反应有关,其中变态反应得到了更广泛的认同[4],也有学者认为某些药物可能导致的体温调节中枢的改变而引起药物热[6]。药物热可伴有其他症状如皮疹、内脏损害等,具有一定的潜伏期,停药后体温自行消退,再次使用原致敏药物体温可迅速升高,预后良好[5,7-8]。早在几十年前就有学者发现万古霉素可致患者发热伴白细胞减少,并分析其可能的原因。我国学者总结出万古霉素导致的药物热常伴有白细胞减少,但也可单独存在,白细胞降低可能与免疫介导的变态反应和药物直接导致的骨髓抑制有关[9],还可能与药物蓄积有关[10]。彭文星等[8]研究发现并分享了发生药物热时白细胞上升的案例,并且对药物热的导致转氨酶、嗜酸性粒细胞、ESR的实验室检查结果进行了分析总结,为临床诊疗药物热提供了更多的实验室检查异常结果的可借鉴性经验。Smith等[11]发现白细胞和中性粒细胞下降与发热程度具有一定相关性。观察患者住院期间体温、白细胞、中性粒细胞的数值走向加以分析,自12月4日起体温与WBC、NEUT的变化具有明显相关性,并与Smith的分析图像走行一致,同时与万古霉素发生此不良反应时间吻合,但其具体的伴随发生机制需要更多的大样本案例进行更深入的探讨。
2.2 不良反应相关性 此患者血培养及药敏试验显示万古霉素敏感,且TDM达标,正确规范用药,用药2周后体温不降但白细胞进行性下降,虽未观察到控制感染后的体温下降后再次上升的明显时间节点,但换药后患者体温下降,由于其他因素再次使用万古霉素体温1 d内升到39 ℃,白细胞计数未测,考虑药物热,及时停药后体温逐渐降至正常,基本与药物热的诊断特点相符。白细胞减少虽不能排除其他药物的可能性,但先后使用芪胶升白胶囊和利可君片效果微弱,停用万古霉素后出院时白细胞逐渐回升至正常值范围,考虑白细胞减少与万古霉素相关的可能性大,但也不能排除合并用药中其他药物导致。根据药品不良反应相关性评价中的计分推算法算出得分6分,此药品不良反应很可能与其相关,结合国家药品不良反应因果关系评定方法的结论是肯定的,药师认为万古霉素很可能是患者反复发热伴白细胞进行性减少的罪魁祸首。
3 关于药物热伴白细胞减少的经验总结
3.1 预防 药物热及药物相关性白细胞减少是不可预测的,需提高临床工作者的警惕性,面对不明原因性发热或白细胞减少时,注意是否使用存在这种不良反应的高风险药物,如抗菌药物、抗癫痫药及抗抑郁药等。两种药品不良反应均存在一定的潜伏期,万古霉素导致的药物热通常发生在治疗后7 d,白细胞减少通常发生在治疗10 d后,但症状大多在停药后3~5 d消退,再次使用该药药物热可在10 min~2 h内迅速发生[1,11]。作为临床一线工作者应正确规范地诊疗疾病,对高危患者谨慎用药,注意合并用药情况,避免同时使用具有相同不良反应的药物,减少药物不良反应,还应对患者进行科学合理的宣教,避免再次使用此药。
3.2 诊断 从患者原有疾病和身体状态情况综合考虑,根据其伴随症状、体征和实验室影像学检查结果,依次排除是否存在感染性发热和其他非感染性发热疾病。考虑用药剂量和用药时间是否规范,是否使用此类不良反应的高风险药物,推理用药时间的相关性,结合实验室检查,再根据药品不良反应评价表进行判断,怀疑药物热又无法排除感染性发热时,可停药或换药观察。由于导致药物热的药物品种、机制不同及患者之间的个体性差异,在诊断药物热时应仔细审阅患者病史和治疗方案,长期使用抗菌药物且一直存在发热并有感染指征的患者,也应思考到存在药物热的情况[12],患者的感染症状可能会掩饰药物热的症状,不明原因的发热应时刻保持存在发生药物热的可能。本文试图为药物热或药物导致的白细胞减少找到更多的实验室指标,帮助诊断并证实它们之间的关系,以便掌握药物不良反应的程度和制定下一步诊疗计划。此案例中除白细胞、中性粒细胞和体温的变化之间存在明显的规律外,患者ESR变化幅度较大,曾经有报道过抗菌药物导致的药物热会导致ESR加快的案例[8],但推理万古霉素的用药时间与ESR变化时间相关性不大,故ESR判断是否存在药物不良反应还有待商榷。患者PCT、CRP等变化不明显,同时由于部分数据缺失导致分析数据缺乏可靠性,但笔者认为诊断抗菌药物导致的药物热还是有必要检测感染指标,以排除患者是否存在感染性发热。诊断药物不良反应的敏感指标如嗜酸性粒细胞,本例患者未见明显异常,目前药物不良反应缺乏特异性指标,上述提及的实验室指标均需大样本数据进行分析验证,仅可作为简单提示,并不能作为确诊依据,故需医务人员提高可能发生药品不良反应的意识,并按照正规程序及时上报。
3.3 处理措施 最有效的治疗措施是在不影响治疗原发病的情况下停用可疑药物,如需继续治疗,建议更换同类药物,不能换药者,可预防性使用糖皮质激素或抗组胺药预防变态反应[12]。患者体温高峰时,可采用对乙酰氨基酚或布洛芬降温[13],或采用温水、乙醇擦拭等物理降温的方法对症处理。许多药物会导致白细胞减少,严重药物性白细胞减少的患者临床均以对症治疗为主给予升白药物,如重组人粒细胞集落刺激因子,但近几年来发现,中医药治疗血液病症具有一定优势和广阔前景。陈作忠等[14]发现地榆升白片、利血生等治疗抗菌药物导致的白细胞减少有一定作用。本例患者先后使用芪胶升白胶囊和利可君片升白细胞对症处理后疗效微弱,笔者认为药物性白细胞减少的最佳处理方案同样为及时停药或更换治疗方案,可尝试采用中医药方式对症处理,并对患者进行科学宣教,医护人员与患者始终保持同一战线,消除患者痛苦,并减少不必要医疗支出。但由于此例患者部分数据缺失且样本量太少,导致分析不完美,药物热伴白细胞减少的敏感指标和严重时的紧急处理方案还需大样本数据为临床治疗提供证据,关于药品不良反应的发生和处理也待于临床医务工作者的进一步探讨。
