miR-383靶向PRDX3对肝癌HepG2细胞增殖、侵袭的影响
2021-01-18牟尚东
田 姗,江 海,刘 慧,曹 霞,张 丹,牟尚东,李 曾
1.西安交通大学医学院附属三二〇一医院肿瘤内科,陕西 汉中 723000;2.陕西理工大学生物科学与工程学院;3.西安交通大学医学院附属三二〇一医院血液内科
肝癌是危害人类健康的常见恶性肿瘤之一,在全国范围内发病率及死亡率均呈逐渐上升趋势[1-2]。虽然目前对肝癌的诊治技术在不断改进和完善,但其恶性程度高,术后5年生存率仅50%左右[3],主要原因是患者确诊时多为中晚期,失去最佳手术机会[4]。因此,探寻肝癌新型生物治疗靶标已成为临床研究热点。有研究发现,利用微小载体携带外源RNA进入癌变部位,能够对癌细胞中相关蛋白合成发挥抑制作用,进一步起到抗癌作用[5]。微小RNA(microRNA,miRNA)是一类内源性非编码单链RNA,存在于真核生物细胞内,能与靶基因mRNA3′非编码区特异性结合,调节基因转录和表达,在细胞增殖、凋亡、侵袭及迁移等过程中发挥重要作用[6]。Yan等[7]研究发现,miR-383可直接靶向PAX6抑制结直肠癌细胞增殖和侵袭。有研究报道,miR-383在食管鳞癌[8]、卵巢癌[9]中均发挥抑癌作用,但其在肝癌中的生物学功能及作用机制却鲜有报道。人过氧化物还原酶-3(human peroxide reductase-3,PRDX3)是硫氧还蛋白过氧化物酶抗氧化剂家族的线粒体成员,是调节细胞氧化还原状态的线粒体过氧化物还原酶,与肿瘤形成有关[10]。Liu等[11]研究发现,PRDX3促进肝癌的生长并介导细胞增殖、迁移及侵袭,是肝癌潜在治疗靶点。王晓玫等[12]研究发现,在人髓母细胞瘤D341细胞系miR-383过表达可靶向调控PRDX3基因表达水平,抑制D341细胞增殖、侵袭及迁移。因此本研究通过检测miR-383在人肝癌HepG2细胞中表达水平,探讨其与PRDX3靶向关系及对肝癌HepG2细胞增殖、侵袭的影响,以期揭示miR-383在肝癌发生、发展中作用,为寻找有效生物学靶标、实现肝癌的精准治疗提供一定理论参考。现将具体结果报道如下。
1 材料与方法
1.1 细胞HepG2肝癌细胞(货号:SCS-519)购自中国科学院上海生物科学研究所。
1.2 主要试剂与仪器DMEM培养基(批号:NBG1236)购自美国Hyclone公司;胎牛血清(批号:36G5782)购自美国Gibco公司;链霉素(批号:NBG1236)、青霉素(批号:FH673J)、二甲基亚砜(批号:N6582J)购自美国Sigma公司;蛋白提取试剂盒(批号:ME861R)、BCA试剂盒(批号:2763DB)、胰蛋白酶(批号:BD735N)购自上海碧云天公司;双荧光素酶报告基因检测试剂盒(批号:YBP165)购自北京百奥莱博科技有限公司;PRDX3(批号:YBS903)、Ki-67(批号:RM-9106)、MMP-2(批号:35G5642)、MMP-9(批号:J1620032)、β-actin(批号:D648JF)抗体、山羊抗兔HRP(批号:674GN6)二抗购自美国Proteintech公司;6孔细胞板(批号:SU732)购自美国Bio-Rad公司;反转录试剂盒(批号:7856GU)购自美国Sigma公司);AceQqPCR SYBR Green Mix(批号:NC9343)购自南京Vazyme生物公司;Trizol Reagent核酸分离试剂(批号:83H296)购自日本Takara公司;LipofectamineTM3000转染试剂盒(批号:HUDY03)购自美国Invitrogen公司;miR-383 mimic、miR-383 mimic-negativecontrol由上海生工公司合成。CO2培养箱(型号:NHD DYE1738)购自日本Sanyo公司;普通光学显微镜(型号:BNJD7836)购自美国Olympus公司;Elx800酶标仪(型号:HSG9832)购自美国Thermo公司;荧光定量PCR仪(型号:HDBC0291)购自美国Bio-Rad公司。
1.3 方法
1.3.1 细胞培养:复苏HepG2细胞,培养于含质量浓度为150 g/L灭活胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的DMEM培养基中,防止细菌污染,培养于37 ℃饱和湿度、体积分数为5%的CO2、20%的O2培养箱中,每2~3 d更换1次培养液,无菌操作,待细胞生长良好,且达对数生长期时进行后续实验。
1.3.2 细胞转染及分组:将培养至对数生长期的HepG2细胞,用质量浓度为2.5 g/L的胰蛋白酶消化,接种6孔细胞板(1×106个/孔),待细胞融合度至80%时,更换为无血清DMEM培养基,采用LipofectamineTM3000进行转染,严格按照试剂盒说明书进行操作,转染后用无血清DMEM培养基继续培养24 h。实验分为3组:(1)空白(normal glucose,NG)组:只含HepG2细胞;(2)miR-383阴性对照(negative control,NC)组:转染终浓度为100 nmol/L miR-383 NC序列;(3)miR-383过表达(miR-383 mimics)组:转染终浓度为100 nmol/L miR-383 mimics序列。6 h后弃去培养基,更换为质量浓度为100 g/L胎牛血清DMEM培养基培养。转染48 h后将培养板置于倒置荧光显微镜下观察,镜下随机选择3个视野,分别计数细胞总数及绿色荧光的细胞数,计算转染效率,当转染效率为80%时,加入嘌呤霉素进行压力筛选,获得稳定转染细胞株。
1.3.3 实时定量聚合酶链反应(quantitative real-time PCR,qRT-PCR)检测miR-383水平:按照试剂盒说明书提取各组HepG2细胞中总RNA,使用分光光度计测定RNA浓度,OD260/280值为1.8~2.0,代表提取的RNA合格;以RNA为模板,按照试剂盒说明书进行逆转录反应,所得cDNA进行qRT-PCR反应。反应体系20 μl:2×ULtraSYBR mixture 10.0 μl,cDNA模板(25 ng/μl)2.0 μl,上下游引物各2.0 μl,ddH2O 4.0 μl;反应条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火60 ℃ 30 s,延伸72 ℃ 20 s,共40个循环。引物由大连宝生生物工程有限公司设计并合成,以U6作为内参基因。采用2-ΔΔCt方法计算各组HepG2细胞中miR-383相对表达量。引物设计见表1。

表1 qRT-PCR引物序列Tab 1 qRT-PCR primer sequence
1.3.4 MTT法检测HepG2细胞增殖能力:取1.3.2各组稳定表达miR-383的HepG2细胞,将细胞接种于96孔板进行培养,细胞密度为5×104个/孔,分别培养0、24、48、72、96 h后向各孔加入浓度为5 g/L的MTT溶液20 μl,继续培养4 h后,弃去上清,加入150 μl DMSO,振荡10 min,使蓝紫色结晶充分溶解。在酶标仪中570 nm处测定各孔OD值,重复3次,取平均值。计算细胞增殖抑制率,细胞增殖抑制率(%)=(空白组OD值-实验组OD值)/空白组OD值×100%。
1.3.5 Transwell法检测各组HepG2细胞侵袭能力:Transwell小室上室底膜表面铺Matrigel胶(20 μl 2.0 mg/ml),室温孵育40 min,收集1.3.2转染后的HepG2细胞,采用不含胎牛血清的DMEM培养基调整HepG2细胞浓度(2×105个/ml),然后在Transwell小室的上室加入100 μl细胞悬液,在下室加入质量浓度为100 g/L的胎牛血清的DMEM培养基(600 μl),放入培养箱继续培养24 h,取出小室,弃上室培养液,采用无水甲醇固定,30 min后擦去上室未透过膜的细胞,结晶紫(0.2%)染色20 min,将其置于倒置显微镜下观察计数。每组实验重复3次。
1.3.6 Transwell法检测各组HepG2细胞迁移能力:取1.3.2转染后的HepG2细胞,采用不含胎牛血清的DMEM培养基调整HepG2细胞浓度(2×105个/ml),然后在Transwell小室的上室加入100 μl细胞悬液,在下室加入含质量浓度为100 g/L的胎牛血清的DMEM培养基(600 μl),放入培养箱继续培养24 h,取出小室,弃上室培养液,采用无水甲醇固定,30 min后擦去上室未透过膜的细胞,结晶紫(0.2%)染色20 min,将其置于倒置显微镜下观察计数。每组实验重复3次。
1.3.7 双荧光素酶报告基因检测miR-383对PRDX3的转录调控:(1)荧光素酶报告基因实验突变型载体的制备:TargetScan数据库显示人PRDX3基因3′UTR区域含2个miR-383结合位点。对含2个位点的PRDX3-3′UTR区域进行扩增,连到PGEM-T载体上,测序筛选,酶切连至pGL4荧光素酶报告载体,构建p-GL3-PRDX3-3′UTR质粒,以此质粒为模板进行定点缺失(Del1:374~380位点;Del2:809~815位点)突变,测序确认突变成功,构建p-GL4-PRDX3-3′UTR-Del1、p-GL4-PRDX3-3′UTR-Del2、p-GL4-PRDX3-3′UTR-Del1,2质粒。(2)荧光素酶报告基因实验:HepG2细胞铺48孔板,24 h后,将p-GL4-PRDX3-3′UTR野生型与miR-383 NC共转染,将p-GL4-PRDX3-3′UTR-Del1、p-GL4-PRDX3-3′UTR-Del2、p-GL4-PRDX3-3′UTR-Del1,2质粒分别与miR-383 mimics共转染,每组设6个复孔。转染后24 h,收集细胞,加入100 ml荧光素酶检测试剂Ⅱ,测定荧光强度,记作A,之后加入Stop & Glo,测定荧光强度,记作B,采用A/B表示荧光素酶相对活性。
1.3.8 蛋白免疫印迹(Western blotting)法检测PRDX3、Ki-67、MMP-2、MMP-9蛋白表达:收集各组HepG2细胞,加入RIPA裂解液提取总蛋白,并采用BCA法检测PRDX3、Ki-67、MMP-2、MMP-9总蛋白浓度,分别取20 μg蛋白上样于SDS-PAGE分离蛋白,将各蛋白转至PVDF膜,放入脱脂奶粉(5%)溶液室温封闭2 h,加入PRDX3(1∶1 000)、Ki-67(1∶1 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)、β-actin(1∶1 000)抗体作为一抗,4 ℃孵育过夜,TBST清洗,加入HRP标记山羊抗兔二抗(1∶5 000),室温孵育1 h,采用ECL发光试剂显影,采用Tanon 600图像分析系统拍照,以β-actin为内参分析PRDX3、Ki-67、MMP-2、MMP-9蛋白相对表达水平。

2 结果
2.1 各组转染效果检测结果倒置荧光显微镜下观察NC组、miR-383 mimics组细胞转染效果,miR-383 mimics组镜下可见绿色荧光,HepG2细胞成功转染miR-383(见图1)。miR-383 mimics组HepG2细胞中miR-383表达水平(1.42±0.23)显著高于NG组(0.87±0.19)、NC组(0.88±0.19)(P<0.05)。

图1 倒置显微镜下观察细胞转染效果(100×)A:NC组;B:miR-383 mimics组
2.2 miR-383过表达对HepG2细胞增殖能力影响随着培养时间的延长,miR-383 mimics组HepG2细胞增殖抑制率明显升高(P<0.05),不同时间点miR-383 mimics组HepG2细胞增殖抑制率均显著高于NG组、NC组(P<0.05)(见表2)。

表2 miR-383过表达对HepG2细胞增殖能力的影响Tab 2 Effect of miR-383 overexpression on proliferation of HepG2 cells
2.3 miR-383过表达对HepG2细胞迁移能力的影响
与NG组、NC组比较,miR-383过表达组HepG2细胞迁移数明显减少(P<0.05)(见图2、表3)。
2.4 miR-383过表达对HepG2细胞侵袭能力的影响
与NG组、NC组比较,miR-383过表达组细胞侵袭数明显减少(P<0.05)(见图2、表3)。

图2 miR-383过表达对HepG2细胞迁移、侵袭能力的影响Fig 2 Effects of miR-383 overexpression on migration and invasion of HepG2 cells

表3 miR-383过表达对HepG2细胞迁移、侵袭能力的影响Tab 3 Effects of miR-383 overexpression on migration and invasion of HepG2 cells
2.5 miR-383靶向调控PRDX3基因的关系验证Targetscan(http://www.targetscan.org/)预测结果显示,PRDX3基因3′UTR区有2个miR-383结合位点,分别位于miR-383 3′UTR374-380和809~815。荧光素酶报告基因实验结果见图3,与PRDX3-3′UTR+NC组比较,PRDX3-3′UTR+mimics组的荧光素酶活性显著降低,差异有统计学意义(P<0.05);mimics各突变型PRDX3组的荧光素酶活性差异无统计学意义(P>0.05)。
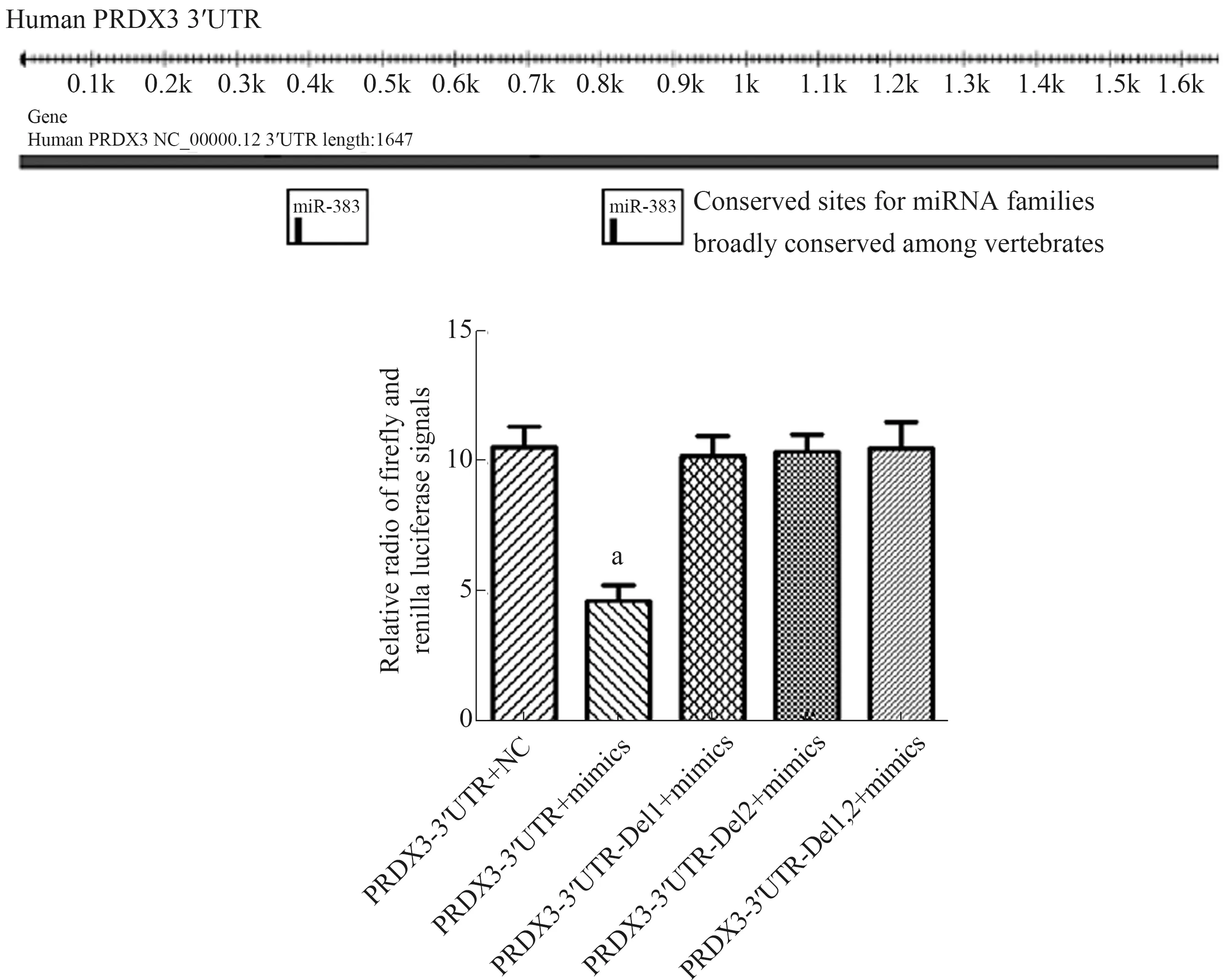
注:与PRDX3-3′UTR+NC组比较,aP<0.05;Del1:374~380位点突变;Del2:809~815位点突变。图3 荧光素酶报告基因实验检测miR-145与MY06基因3′UTR区域的结合Fig 3 Luciferase reporter gene assay was used to detect the binding of miR-145 with 3′UTR region of MY06 gene
2.6 miR-383过表达对HepG2细胞PRDX3、Ki-67、MMP-2、MMP-9蛋白表达的影响与NG组、NC组比较,miR-383 mimics组HepG2细胞PRDX3、Ki-67、MMP-2、MMP-9蛋白相对表达量显著降低(P<0.05)(见图4、表4)。

图4 miR-383过表达对HepG2细胞PRDX3、Ki-67、MMP-2、MMP-9蛋白表达的影响

表4 miR-383过表达对HepG2细胞PRDX3、Ki-67、MMP-2、MMP-9蛋白表达的影响
3 讨论
肝癌作为一种恶性肿瘤,其发病隐匿,早期症状不明显,多数患者确诊时已是肿瘤转移或晚期,因此具有高发病率、高死亡率特点。目前仍缺乏有效的早期筛查和诊断肝癌的生物学指标。
成熟miRNA是长度为20~23个核苷酸的单链RNA分子,是基因表达的重要调节剂,通常会降低mRNA稳定性,包括介导肿瘤发生过程基因的mRNA。miRNA靶向主要是通过miRNA 5′端(“种子”区域)与mRNA编码区和非翻译区(UTR)内位点之间特定碱基配对相互作用实现的[13-14]。Cui等[15]研究发现,在结肠癌中,miR-383的上调可能通过靶向APRIL的调节来抑制结肠癌细胞的增殖、迁移和侵袭。Ma等[16]研究发现,miR-383通过靶向调节EPAS1而抑制肺癌细胞增殖、侵袭及迁移,miR-383可能作为治疗肺癌的潜在生物学靶标。以上研究结果说明,miR-383在恶性肿瘤发生、发展中多作为抑癌基因发挥作用。然而,有关miR-383在肝癌发生、发展中的作用及机制研究较少。本研究结果发现,miR-383过表达后肝癌HepG2细胞增殖抑制率明显升高,细胞迁移、侵袭能力均显著下降,提示miR-383过表达可显著抑制HepG2细胞增殖、迁移、侵袭。
本研究采用TargetScan数据库对miR-383靶基因预测发现,PRDX3是miR-383潜在靶基因。PRDX3是PRXS家族重要成员,其定位于线粒体中并由核基因进行编码,可靶向线粒体的氨基酸序列,在内质网合成后经线粒体定位信号转运发挥作用,能够维持线粒体内氧化还原反应动态平衡及肿瘤形成[17-18]。研究表明,PRDX3促进肝癌的生长并介导细胞迁移和侵袭,是肝癌治疗的潜在治疗靶点。Shi等[19]研究发现,肝癌患者的血清PRDX3表达显著高于肝硬化患者及健康对照组,且血清PRDX3表达高的肝癌患者的中位生存时间比PRDX3表达低的肝癌患者的中位生存时间短,可作为非侵入性生物标志物用于肝癌的诊断或预后。王少增等[20]研究发现,PRDX3在人髓母细胞瘤组织及Daoy细胞系中过表达,而miR-383可能通过下调PRDX3的表达水平来抑制Daoy细胞系的增殖,并促进其凋亡。本研究发现,miR-383可显著抑制野生型PRDX3组荧光素酶活性,PRDX3基因3′UTR区与miR-383任一结合位点发生突变均可以恢复荧光素酶活性,提示miR-383可靶向调控PRDX3基因。进一步研究显示,miR-383过表达可显著抑制肝癌HepG2细胞中PRDX3、Ki-67、MMP-2、MMP-9蛋白表达,表明在HepG2细胞细胞中,miR-383过表达可显著抑制PRDX3基因转录和翻译,并可能通过抑制增殖、侵袭、迁移相关蛋白进而抑制细胞增殖、侵袭、迁移。
综上所述,miR-383在肝癌HepG2细胞中呈低表达,其可能通过下调PRDX3表达抑制HepG2细胞的增殖、迁移和侵袭能力,表明miR-383可能作为潜在靶标为肝癌基因治疗提供新方法。本研究存在不足之处,关于肝癌中miR-383靶向PRDX3具体调控过程,需深入研究并进行验证。
