AMH 基因多态性与PCOS 发病的关系探讨
2021-01-18祁彦萍杨瑞杨建敏
祁彦萍,杨瑞,杨建敏
(郑州大学附属医院南阳市中心医院妇产科,河南 南阳473000)
抗苗勒管激素(AMH)是转化生长因子β 超家族中的一员,是由卵巢颗粒细胞分泌的苗勒管抑制物质。其血清水平高低可代表不同的卵巢储备功[1]。有研究报道[2]多囊卵巢综合症(PCOS)患者血清AMH 水平显著升高,充分说明,AMH 表达水平在卵巢储备功能不同患者体内存在差异。由此提醒研究者AMH 基因多态性与PCOS 发病机制具有一定的联系[3]。本研究通过检测PCOS 患者组与排卵正常的对照组 GT 基因型、BMI、PRL、P、T、FSH、E2及上述指标与PCOS 的相关性差异,并同时研究A MH 基因多态性与患者体质重指数(BMI)、GT 基因型、BMI、PRL、P、T、FSH、E2 进行比较,以探讨 AMH基因多态性与PCOS 患者代谢及激素紊乱之间的关系。现报告如下。
1 资料与方法
1.1 一般资料 选取我院2015 年 5 月-2017 年 5月确诊的 PCOS 患者 100 例(PCOS 组)、正常排卵妇女 100 例(对照组)。PCOS 组,年龄 24~38 岁,平均 29.1±3.5 岁,体质量指数(BMI)24.2±2.3kg/m2。对照组,年龄 22~38 岁,平均 28.7±3.1 岁,BMI 21.8±1.8 kg/m2。
1.2 纳入排除标准
1.2.1 纳入标准[4]⑴患者年龄 19~38 岁;⑵PCOS组患者严格按照2003 年鹿特丹标准选取:①稀发排卵或无排卵;②高雄激素临床表现和(或)高雄激素血症;③一侧或双侧卵巢多囊样改变,上述3 条中符合2 条;⑶对照组妇女为正常排卵的健康自愿者;⑷本研究实施前与患者签署保密协议、知情同意书。
1.2.2 排除标准:⑴伴有严重的血液系统疾病;⑵感染性疾病;⑶肿瘤疾病;⑷合并其他类型疾病。
1.3 E2、PRL、FSH、P、T 检测方法 抽取患者月经第3 天的空腹静脉血进行血清雌激素(E2)、催乳素(PRL)、卵泡雌激素(FSH)、孕酮(P)、睾酮(T)测定,采用化学发光免疫分析法,所需要的试剂盒购自瑞士罗氏公司。
1.4 PCR 方法 ⑴总DNA 的提取:采用试剂盒提取DNA 方法,并严格按照说明书进行(试剂盒由天根生化科技有限公司提供);⑵AMH 目的基因序列PCR 扩增:PCR 反应总体积 25ul,AMHF 引物序列如下:上游5 一CCTI'CCACTCGGCTCGGCTCACTTA-3’,下游 TCCTCCAGGTGTAGGACCAC-5’,扩增片段长度430bp AMH 扩增反应程序为94℃预变性 2 分钟,94℃变性 3O 秒,55℃退火 30 秒,72℃延伸30 秒,从变性至延伸共3O 个热循环后,再72℃延伸,12℃保存。反应完成后,取5ul 上样于2%琼脂糖凝胶孔电泳35~35min 后,在紫外透射/凝胶成像仪上观察PCR 产物的扩增情况。⑶PCR 产物纯化:严格按照Milli.pore 公司96 纯化板操作流程操作。
1.5 统计学方法 统计软件采用SPSS16.0,采用均数±标准差进行统计描述,组间比较采用t 检验;计数资料组间比较采用χ2检验,多因素分析采用Logistic 回归分析法;P<0.05 为差异具有统计学意义。
2 结果
2.1 两组的AMH 基因型、 等位基因频率比较PCOS 组的GT 基因型45.00%,显著的高于对照组的 25.00%(P<0.05),PCOS 组的等位基因 T、G 频率与对照组比较差异不具有统计学意义 (P>0.05);见表1。
2.2 两组的年龄、BMI、 性激素水平比较 PCOS 组和对照组的年龄、E2 比较,差异无统计学意义(P>0.05);PCOS 组的 BMI、PRL、P、T 的水平显著的高于对照组(P<0.05),PCOS 组的 FSH 水平显著的低于对照组(P<0.05);见表 2。
2.3 多因素分析结果 Logistic 回归分析结果显示:PRL、P、T 的水平、AMH 基因中 GT 基因型增高、FSH 水平降低是并发PCOS 的独立危险因素 (P<0.05);见表 3。
3 讨论
PCOS 是一种复杂的内分泌及代谢性疾病,增加肥胖症、动脉硬化、心血管疾病及妊娠期糖尿病的风险[5]。有研究表明[6]在 PCOS 患者中,约 30%妊娠期糖尿病患者产后多发展为2 型糖尿病。同时,PCOS 引起胰岛素抵抗会引发一系列高胰岛素血症所伴随的临床症状如高雄激素血症、代谢紊乱、生殖紊乱、多毛、痤疮等。研究者认为[7]胰岛素抵抗是PCOS 的始发因素和中心环节。近年来有学者研究PCOS 基因水平的发病机制, 发现PCOS 的发病与AMH 基因多态性有关。AMH 是一种糖蛋白二聚体由二硫键连接形成[8]。AMH 需要与受体结合进行相应的信息传递,实现生物学效应。有I、II、III 三种受体,其中起主要作用的是AMHII 受体,其大部分由颗粒细胞表达,少量由卵泡膜细胞表达。通过连接AMHII 受体和AMH 实现AMH 的信息传递过程,具有控制卵泡生长和发育的功能,主要通过抑制卵泡细胞的起始和循环募集实现的[9]。由于相关研究发现[10]在IVF-ET 过程中,AMH 的表达不受促性腺激素作用的影响,能较独立反应卵巢储蓄功能,排除其他因素的影响。
近年来,很多学者开始从基因水平研究PCOS的发病机制。周伟伟等研究发现[11]AMH 基因多态性与PCOS 发病机制相关,有研究通过给予外源性的AMH 发现,芳香酶mRNA 水平显著降低,可进一步抑制孕酮、睾酮的合成,下调LH 水平,最终抑制卵泡的形成过程,以此参与PCOS 的发生发展过程。其对PCOS 患者AMH、AMHII 受体的基因型多样性与PCOS 发病机制密切相关。本研究结果证实了学者认为AMH 基因多态性与PCOS 发病相关性的观点,且研究结果发现PCOS 组的GT 基因型45.00%显著的高于对照组的 25.00%(P<0.05),PC OS 组的等位基因T、G 频率与对照组比较差异不具有统计学意义(P>0.05);这与孙娜等学者报道研究结果一致[12],其中 G/T 表型的患者中 BMI、LH、T水平显著高于G/G 和T/T 表型的PSOS 患者。说明G/T 基因型能增加PCOS 患者并发肥胖、高雄激素血症。其原因主要是由于代谢紊乱导致的LH/FSH比值异常,合成雄激素的关键酶-P450-17-α 碳酸酶活性增强从而使血清T 水平明显升高。证实PCOS 患者AMH 基因型多态性不仅与PCOS 发病机制密切相关还与其病理生理学研究相吻合。
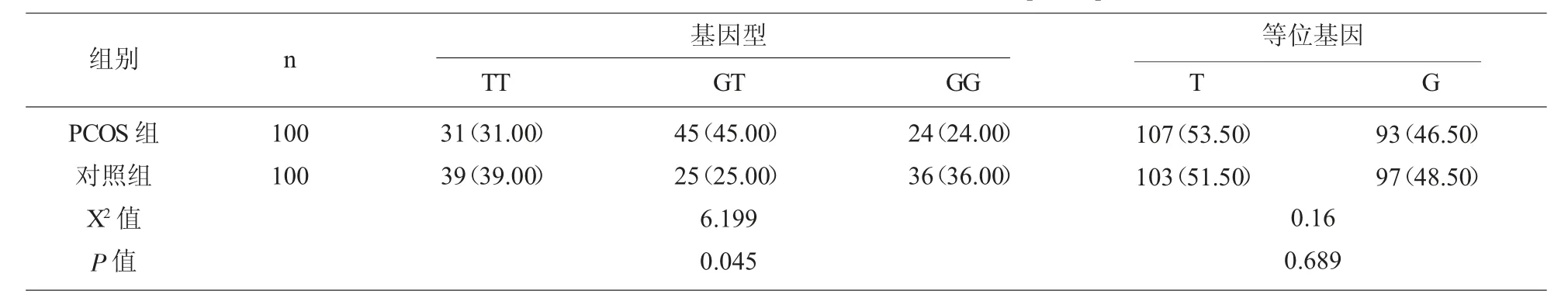
表1 两组患者的AMH 基因型、等位基因频率比较[n(%)]
表 2 两组的年龄、BMI、性激素水平比较

表 2 两组的年龄、BMI、性激素水平比较
组别n 年龄(岁)BMI(kg/m2)29.1±3.5 28.7±3.1 1.408 0.296 E2(pg/ml) PRL(ng/ml) FSH(/mIUml) P(ng/ml) T(ng/dl)PCOS 组对照组t 值P 值100 100 24.2±2.3 21.8±1.8 10.064<0.001 51.09±9.41 53.00±10.86 1.628 0.105 14.86±2.62 12.04±2.21 10.076<0.001 5.57±0.92 6.83±1.22 10.099<0.001 0.73±0.14 0.61±0.16 6.913<0.001 59.66±11.72 28.43±5.09 29.934<0.001
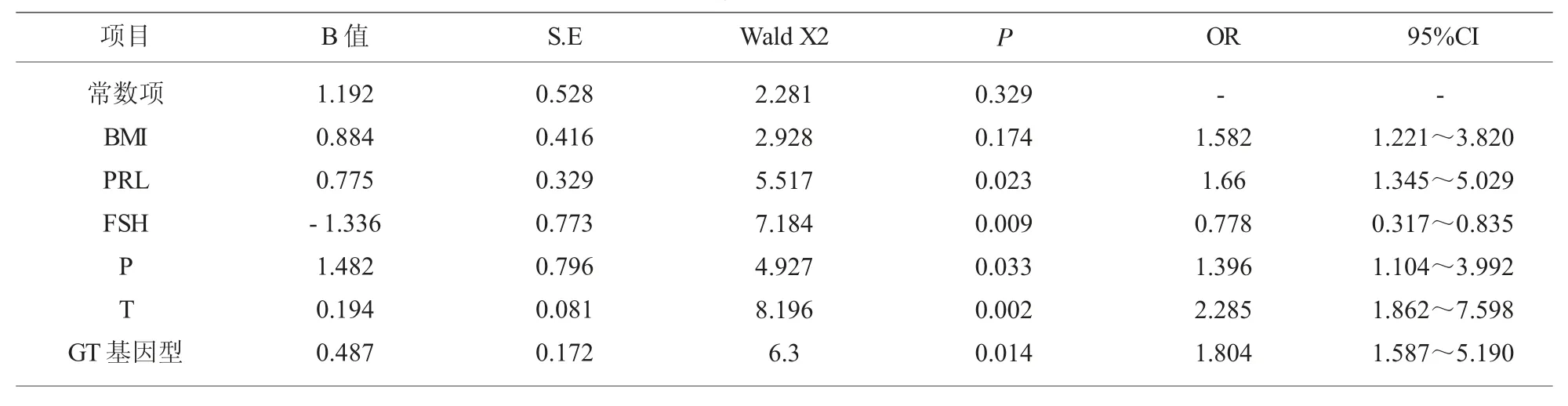
表3 Logistic 回归分析结果
本研究结果显示PCOS 患者FSH 水平下降,其原因可能是,PCOS 患者主要的临床表现月经不调和不孕主要是由于卵泡发育障碍引起的[13]。PCOS 甾体激素代谢紊乱是PCOS 病理生理学变化的基础。FSH 调节卵巢颗粒细胞芳香化酶活性受阻,雌二醇合成相对低下。有研究表明[14,15]PCOS 患者卵巢内的芳香化酶活性正常甚至亢进使雌二醇的合成增加。由于FSH 与雌二醇之间存在负反馈调节机制,PCOS 合成雌二醇能力亢进反馈性抑制FSH 的合成。与本研究结果一致。提示 PCOS 患者卵巢本身的雌激素合成亢进负反馈引起FSH 降低是导致PCOS 相关临床症状的始发因素。同时本研究结果显示 PRL、P、T 的水平、AMH 基因中 GT 基因型增高、卵泡雌激素(FSH)水平降低是并发PC OS 的独立危险因素(P<0.05)。提示 PRL、P、T 的水平、AMH 基因中GT 基因型增高、卵泡雌激素(FSH)水平降低是并发PCOS 的独立危险因素,上述指标的变化应警惕PCOS 并及时诊治。
综上所述,AMH 基因型中G/T 将会加大PCOS的发病风险。其发病可能不受年龄的影响,需进一步扩大临床样本以研究年龄对PCOS 发病的影响。
