血清MMP-3 水平预测类风湿性关节炎MRI 影像学变化的研究
2021-01-18朱柏林梁丽婷
朱柏林,梁丽婷
(江西省抚州市中医院检验科,江西 抚州 344000)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为主要病理表现的慢性、 系统性自身免疫性疾病[1,2],主要表现为以双手和腕关节等小关节受累为主的对称性、 持续性多关节炎,病理表现为关节滑膜的慢性炎症、血管翳形成,并出现关节软骨和骨质的破坏,最终可导致关节畸形和功能丧失。据统计,RA 的发病率约为1%, 好发于40~60 女性[3]。早期诊断并治疗,尽可能防止致残为治疗RA 的首要目标。磁共振(MRI)影像学检查,可用于RA 的诊断、监测疾病进展、评估治疗效果。基质金属蛋白酶3(MMP-3)是滑膜成纤维细胞和关节软骨细胞分泌的蛋白酶,主要参与组织基质和胶原降解,与关节损伤密切相关[4]。本研究通过观察药物治疗前、后不同活动期的RA 患者MMP-3 水平与MRI 影像学变化,探讨MMP-3 在RA 病情活动性评估中的作用及对RA 患者MRI 影像学进展的前瞻性预测。
1 资料与方法
1.1 一般资料 选取 2019 年 01 月至 2020 年 01月来我院门诊及住院的RA 患者40 例作为观察组,根据28 个关节疾病活动指数(DAS28)分为重度活动期(DAS28>5.1)15 例、中度活动期(DAS28≥3.2~<5.1)11 例、轻度活动期(DAS28≥2.6~<3.2)9 例、稳定期(DAS28<2.6)5 例。另选同期健康体检者 20 例作为对照组。观察组,男 14 例、女 26 例,年龄 29~83 岁,平均年龄 56.2±27.2 岁。对照组,男 7例、 女 13 例, 年龄 27~69 岁, 平均年龄 47.7±20.7岁。所有受试者在留取血液标本的同时记录各项临床资料,包括 28 个肿胀关节数(28SJC)、28 个压痛关节数(28TJC)、28 个关节疾病活动指数(DAS28)、红细胞沉降率(ESR)、类风湿因子(RF)、抗环瓜氨酸肽抗体(抗CCP 抗体)。所有研究对象均签署知情同意书。本研究经过医院伦理委员会批准。
1.2 纳入排除标准
1.2.1 纳入标准 观察组RA 的诊断符合1987 年美国风湿病学会 (ACR) 关于RA 的分类标准或2009 年 ACR 与欧洲风湿病学会(EULAR)联合修订的RA 分类标准。对照组来自于我院健康体检者。
1.2.2 排除标准 排除可能影响MMP-3 检测结果的疾病, 如合并其他累及关节的疾病以及恶性肿瘤、女性孕期及哺乳期等。
1.3 试剂与仪器 日本Hitachi7180 型全自动生化分析仪及日本MMP-3 测定试剂盒;美国GE SIGAN Creator 1.5T 智能磁共振成像系统。
1.4 测定方法 采集患者空腹静脉血5ml,3000r/min 分离血清待测。血清MMP-3 检测方法为胶乳增强免疫比浊法。RA 观察组分别于药物治疗前和药物治疗后的第一周、第四周动态监测血清MMP-3 水平和MRI 影像学进展。对照组仅于体检当日进行血清MMP-3 和MRI 影像学检查。
1.5 MRI 影像学分析 所有MRI 图像采用OMERACT RAMRIS 评分系统[5],对滑膜炎、骨炎、骨侵蚀等进行评分。具体评分方法为:⑴滑膜炎,血管翳形成,0~3 分(正常、轻、中、重),正常为 0 分,强化范围大于滑膜总体积或厚度的1/3 为1 分,强化范围大于滑膜总体积或厚度的2/3 为2 分,强化范围大于滑膜总体积或全层厚度为3 分。⑵骨炎,无水肿为0 分,水肿范围在 0~1/3 的为 1 分,1/3~2/3 为 2 分,2/3 以上的为 3 分。⑶骨侵蚀,无侵蚀为 0 分,骨侵蚀体积在0%~10%为1 分,11%~20%为2 分, 依此类推,直至 91%~100%为 10 分。最高 448 分。
1.6 统计学处理 采用SPSS 19.0 统计软件进行数据处理。计量资料以表示。采用 Kruskal—Wallis 秩和检验比较两组样本间的差别,多重线性回归分析血清MMP-3 与RA 病情活动度、与MRI影像学变化的相关程度。P<0.05 为差异有统计学意义。
2 结果
2.1 RA 观察组与对照组一般临床资料比较 对照组和 RA 稳定期 28 个肿胀关节数 (28SJC)、28 个压痛关节数(28TJC)、28 个关节疾病活动指数(DA S28)、ESR、RF、抗 CCP 抗体显著低于 RA 轻、中、重度活动期 (P<0.05);RA 稳定期和对照组一般临床资料比较,差异无统计学意义(P>0.05)。见表 1。
2.2 药物治疗前RA 观察组与对照组血清MMP-3水平比较 药物治疗前第一周和第四周RA 轻、中、重度活动期血清MMP-3 水平依次升高,均显著高于RA 稳定期和对照组(P<0.05);药物治疗前RA稳定期和对照组MMP-3 水平比较, 差异无统计学意义(P>0.05)。见表 2。
2.3 药物治疗前RA 观察组与对照组MRI 影像学OMER-ACT RAMRIS 评分比较 药物治疗前第一周和第四周RA 轻、 中、 重度活动期MRI 影像学OMER-ACT RAMRIS 评分渐次升高, 均明显高于RA 稳定期和对照组(P<0.05);药物治疗前 RA 稳定期和对照组MRI 影像学OMER-ACT RAMRIS评分比较,差异有统计学意义(P<0.05)。见表 3。
表1 观察组与对照组一般临床资料比较
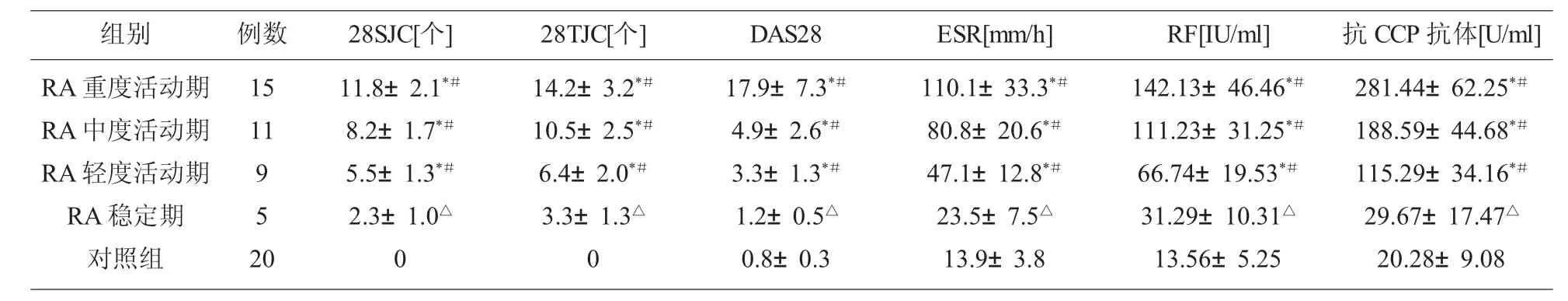
表1 观察组与对照组一般临床资料比较
注:*P<0.05,与对照组比较;#P<0.05,与 RA 稳定期比较;△P>0.05,与对照组比较
组别 28TJC[个] DAS28 ESR[mm/h] RF[IU/ml] 抗CCP 抗体[U/ml]RA 重度活动期RA 中度活动期RA 轻度活动期RA 稳定期对照组例数15 11 9 5 2 0 28SJC[个]11.8±2.1*#8.2±1.7*#5.5±1.3*#2.3±1.0△0 14.2±3.2*#10.5±2.5*#6.4±2.0*#3.3±1.3△0 17.9±7.3*#4.9±2.6*#3.3±1.3*#1.2±0.5△0.8±0.3 110.1±33.3*#80.8±20.6*#47.1±12.8*#23.5±7.5△13.9±3.8 142.13±46.46*#111.23±31.25*#66.74±19.53*#31.29±10.31△13.56±5.25 281.44±62.25*#188.59±44.68*#115.29±34.16*#29.67±17.47△20.28±9.08
表2 药物治疗前观察组与对照组血清 MMP-3 水平[ng/ml,]比较
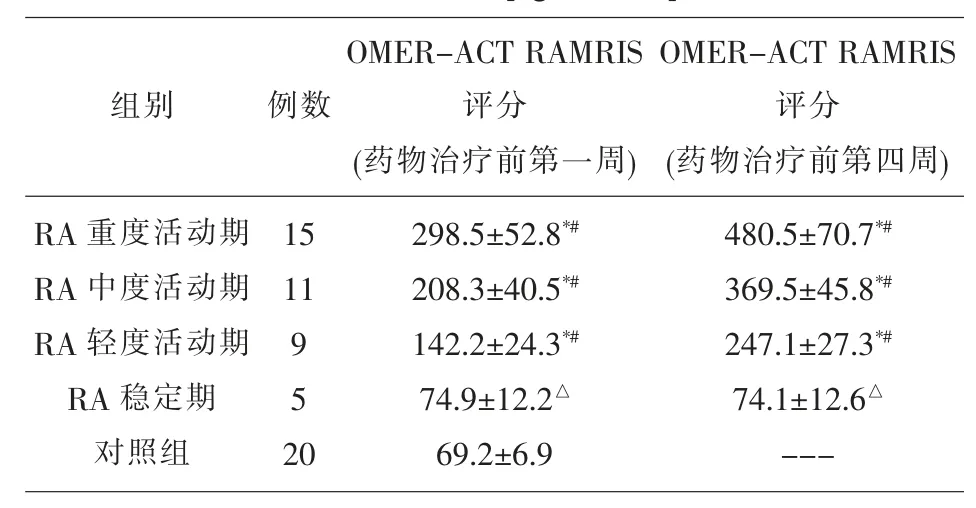
表2 药物治疗前观察组与对照组血清 MMP-3 水平[ng/ml,]比较
注:*P<0.05,与对照组比较;#P<0.05,与 RA 稳定期比较;△P>0.05,与对照组比较;---表示无数据
组别 例数RA 重度活动期RA 中度活动期RA 轻度活动期RA 稳定期对照组15 11 9 5 2 0 OMER-ACT RAMRIS评分(药物治疗前第一周)298.5±52.8*#208.3±40.5*#142.2±24.3*#74.9±12.2△69.2±6.9 OMER-ACT RAMRIS评分(药物治疗前第四周)480.5±70.7*#369.5±45.8*#247.1±27.3*#74.1±12.6△---
表3 药物治疗前观察组与对照组MRI 影像学 OMER-ACT RAMRIS 评分比较
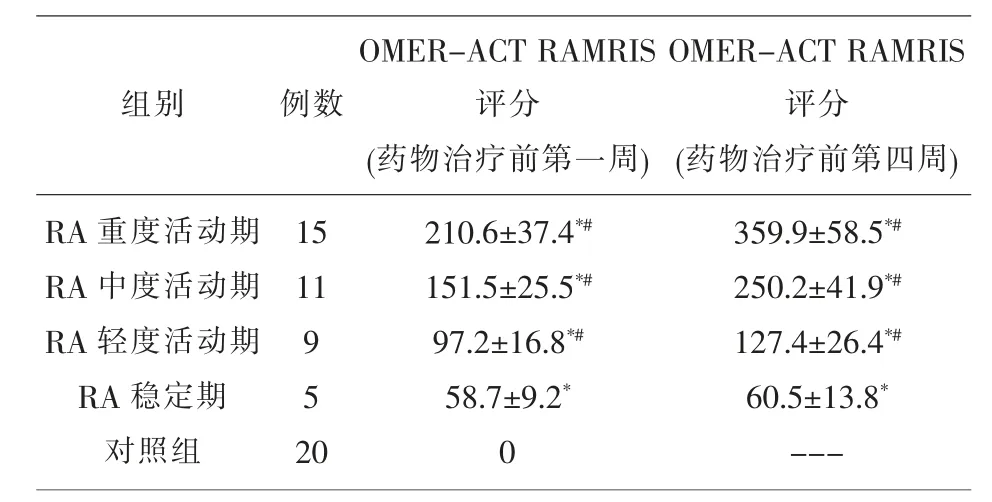
表3 药物治疗前观察组与对照组MRI 影像学 OMER-ACT RAMRIS 评分比较
注:*P<0.05,与对照组比较;#P<0.05,与 RA 稳定期比较;---表示无数据
组别 例数RA 重度活动期RA 中度活动期RA 轻度活动期RA 稳定期对照组15 11 9 5 2 0 OMER-ACT RAMRIS评分(药物治疗前第一周)210.6±37.4*#151.5±25.5*#97.2±16.8*#58.7±9.2*0 OMER-ACT RAMRIS评分(药物治疗前第四周)359.9±58.5*#250.2±41.9*#127.4±26.4*#60.5±13.8*---
2.4 药物治疗前、 后RA 观察组血清MMP-3 水平比较 药物治疗后第一周和第四周RA 轻、 中、重度活动期血清MMP-3 水平显著低于RA 药物治疗前第四周(P<0.05);药物治疗后第一周和第四周RA 稳定期血清MMP-3 水平与RA 药物治疗前第四周比较,差异无统计学意义(P>0.05)。见表 4。
2.5 药物治疗前、 后 RA 观察组 MRI 影像学OMER-ACT RAMRIS 评分比较 药物治疗后第一周RA 轻、中、重度活动期与RA 药物治疗前第四周MRI 影像学OMER-ACT RAMRIS 评分比较,差异无统计学意义(P>0.05);药物治疗后第四周RA轻、中、重度活动期MRI 影像学OMER-ACT RAMRIS 评分明显低于 RA 药物治疗前第四周 (P<0.05);药物治疗后第一、四周RA 稳定期与RA 药物治疗前第四周MRI 影像学OMER-ACT RAMRIS 评分比较,差异无统计学意义(P>0.05)。见表5。
表4 药物治疗前、后RA 观察组血清 MMP-3 水平比较
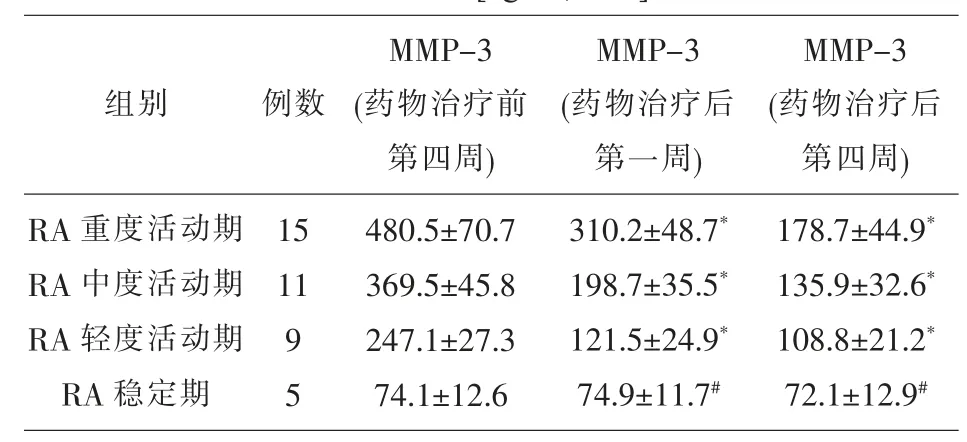
表4 药物治疗前、后RA 观察组血清 MMP-3 水平比较
注:*P<0.05,与 RA 药物治疗前第四周比较;#P>0.05,与 RA 药物治疗前第四周比较
组别 例数MMP-3(药物治疗前第四周)MMP-3(药物治疗后第一周)RA 重度活动期RA 中度活动期RA 轻度活动期RA 稳定期15 11 9 5 480.5±70.7 369.5±45.8 247.1±27.3 74.1±12.6 310.2±48.7*198.7±35.5*121.5±24.9*74.9±11.7#MMP-3(药物治疗后第四周)178.7±44.9*135.9±32.6*108.8±21.2*72.1±12.9#
表5 治疗前、后RA 观察组MRI 影像学OMER-ACT RAMRIS 评分比较
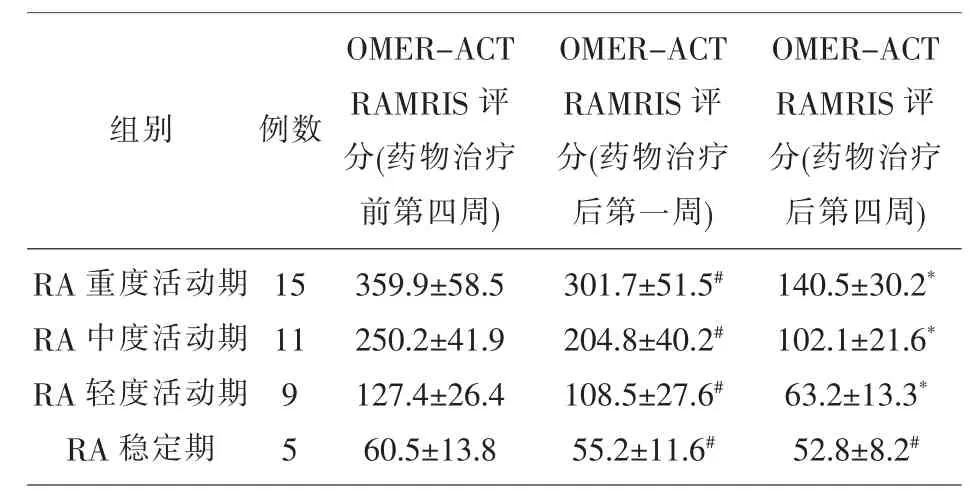
表5 治疗前、后RA 观察组MRI 影像学OMER-ACT RAMRIS 评分比较
注:*P<0.05,与 RA 药物治疗前第四周比较;#P>0.05,与 RA 药物治疗前第四周比较
组别 例数OMER-ACT RAMRIS 评分(药物治疗前第四周)OMER-ACT RAMRIS 评分(药物治疗后第一周)RA 重度活动期RA 中度活动期RA 轻度活动期RA 稳定期15 11 9 5 359.9±58.5 250.2±41.9 127.4±26.4 60.5±13.8 301.7±51.5#204.8±40.2#108.5±27.6#55.2±11.6#OMER-ACT RAMRIS 评分(药物治疗后第四周)140.5±30.2*102.1±21.6*63.2±13.3*52.8±8.2#
3 讨论
基质金属蛋白酶(MMPs)是参与降解软骨和骨基质,引起软骨及骨侵蚀的一组含锌离子的蛋白酶,参与组织形态发生、损伤修复、炎症反应等一系列生理、病理过程[6,7,8]。MMPs 的异常表达可促进RA 的发生和发展,其中以MMP-3 最为重要,由炎症因子IL-1 和TNF-α 刺激滑膜细胞、成纤维细胞和软骨细胞诱导性分泌; 其降解产物可促进T 细胞活化并诱导多种细胞因子的产生,加重关节的炎症反应[9,10,11]。MRI 可以清晰显示软骨、滑膜、血管翳、骨炎及骨质微小侵蚀灶的全部病理改变,是检查RA 滑膜病变的金标准[12,13,14]。
本研究显示, 对照组和RA 稳定期28SJC、28T JC、DAS28、ESR、RF、抗 CCP 抗体显著低于 RA 轻、中、重度活动期(P<0.05),见表 1,这与相关研究相吻合[15]。药物治疗前第一周和第四周RA 轻、中、重度活动期血清MMP-3 水平均逐渐升高, 显著高于RA 稳定期和对照组(P<0.05),见表 2,说明 MMP-3可用于评估RA 的活动度。RA 稳定期由于滑膜处于炎症修复阶段,无软骨和骨基质破坏,骨关节中成纤维细胞未大量分泌MMP-3, 和对照组比较血清 MMP-3 水平无明显差异(P>0.05)。药物治疗前第一周和第四周RA 轻、中、重度活动期MRI 影像学OMER-ACT RAMRIS 评分渐次升高, 均明显高于 RA 稳定期和对照组(P<0.05),见表 3。可能是在RA 进程中,先有滑膜细胞、成纤维细胞和软骨细胞大量分泌MMP-3 酶原, 其被纤溶酶激活为活性MMP -3,直接降解软骨和骨质,MMP-3 还能分解微血管基底膜和间质成分,才能形成侵蚀性滑膜炎血管翳、骨炎、骨侵蚀等MRI 影像学病理改变。
药物治疗后第一周和第四周RA 轻、中、重度活动期血清MMP-3 水平显著低于RA 药物治疗前第四周(P<0.05),见表 4;药物治疗后第一周 RA轻、中、重度活动期MRI 影像学OMER-ACT RAM RIS 评分与RA 药物治疗前,差异无统计学意义(P>0.05),见表5,直至第四周时才显著低于RA 药物治疗前(P<0.05),见表 5。血清 MMP-3 的水平越高,RA 病情活动度越高;治疗后随病情活动度的下降或缓解,血清MMP-3 水平也随之下降[16]。
本研究表明,药物治疗前RA 轻、中、重度活动期血清MMP-3 水平第一周即明显升高, 而药物治疗前MRI 影像学OMER-ACT RAMRIS 评分第四周才明显升高。表明RA 患者中血清MMP-3 水平变化能够显著早于MRI 影像学进展提示骨质损伤或修复。
综上所述,RA 患者药物治疗前、后血清MMP-3 水平变化总是先于MRI 影像学进展,提前预示了RA 患者的骨关节MRI 影像学进展方向,提示骨质损伤或修复。
