龙牙百合组织培养技术体系的优化
2021-01-17陈海霞王登辉王茯苓王建国
陈海霞 王登辉 王茯苓 王建国





摘 要:为降低龙牙百合组培苗生产成本,本试验以其种球鳞片为外植体,研究诱导、不定芽增殖和生根阶段的优化技术方案。结果表明:百合鳞片上端为最佳外植体,不定芽诱导率最高;不定芽初代诱导培养的最佳培养基为MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA,分化率高达到93%,分化系数为7.43;不定芽增殖培养的最佳培养基为MS+1.0 mg·L-1 6-BA +0.1 mg·L-1 NAA,其增殖系数高达到6.7;瓶内生根培养最佳培养基为1/2MS++0.1 mg·L-1 NAA,其生根率达93.33%,瓶外生根培养时发现,采用浓度为300 mg·L-1 NAA溶液处理后,在河沙基质中生根率为100%,平均根系数量高达8.6 ,根长达到5.2 cm。上述结果可为龙牙百合的快速和高效繁殖提供参考依据。
关键词:龙牙百合;组织培养;初代诱导培养;增殖培养;生根培养
中图分类号:S664.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.12.002
Optimization of Tissue Culture Technology System of Lilium brownii var. viridulum
CHEN Haixia1,WANG Denghui1,WANG Fuling1, WANG Jianguo2
(1.College of Horticulture, Hunan Agricultural University,Changsha, Hunan 410128, China; 2. The Planting professional cooperative of Bletilla in Hongjiang, Huaihua, Hunan 418100, China)
Abstract: In order to reduce the production cost of tissue culture seedlings of Lilium brownii var. viridulum, the experiment used bulb scales as explants,and the optimized technical schemes for different cultivation stages were studied. The results showed that the upper end of lily scales was the best explant, and its adventitious bud induction rate was the highest.The optimum medium formula for the primary induction culture of adventitious buds was MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA, which the differentiation rate was up to 93%, and the differentiation coefficient was 7.43.The optimum medium formula for adventitious bud proliferation culture was MS+1.0 mg·L-1 6-BA +0.1 mg·L-1NAA, and its proliferation coefficient was up to 6.7.The optimum medium formula for in-bottle rooting culture was 1/2MS+0.1 mg·L-1 NAA, and its rooting rate reached by 93.33%. When rooting culture outside the bottle,it was found that the rooting rate was 100%, the average growth root coefficient was up to 8.6, and the root length reached by 5.2 cm in the river sand substrate after treatment with 300 mg·L-1 NAA solution. These results could provide a reference for the rapid and efficient reproduction of Lily.
Key words: Lilium brownii var. viridulum; tissue culture; primary induction culture; proliferation culture; rooting culture
龍牙百合(Lilium brownii var. viridulum Baker)是百合科百合属多年生草本球根植物,是我国人工栽培的三大食用百合之一,具有重要的食用、药用和观赏价值[1-2],其鳞茎由二三十瓣重叠在一起,鳞片肥大呈披针形,因形似龙牙而得名[3]。湖南邵阳、隆回县以及江西万载县为龙牙百合的主要产地。龙牙百合病毒病感染严重,多年的无性繁殖造成病毒病积累和品种退化,严重影响食用百合产业的发展。因此,近年来围绕龙牙百合组织培养脱毒技术开展大量研究,并获得无病毒苗。由于生产成本高,食用百合脱病毒技术尚未应用于产业中,本研究拟建立高效率低成本的组培繁育体系,推进无病毒百合种苗的应用。
组培苗生产成本的降低主要从培养基成分、多途径节能降耗、组培过程自动化、加强环境质量等方面着手[4]。张春芬等[5]為降低草莓脱毒组培苗的生产成本,用白砂糖代替蔗糖,用卡拉胶代替琼脂粉,总成本降为原来的32.5%。谢文申等[6]用浅层液体培养与固体培养基相比,可节约成本57.44%,同时减少大量用工。张恒[7]为降低草莓脱毒苗的生产成本,将传统组织培养模式中壮苗培养、生根培养合并为壮苗生根一步,通过组培模式的改进,每株草莓试管苗成本可降低31.9%。早在1994年,日本三菱重工开发出针对百合的鳞茎继代培养开发自动化作业系统,日本Kirin Brewery公司成功应用丛生状组培苗的自动化系统[8]。
本试验开展龙牙百合组织培养技术体系的优化研究,以期为龙牙百合的产业化降低成本,促进无毒百合苗产业的工厂化、规模化和标准化生产。
1 材料和方法
1.1 试验材料
供试材料为龙牙百合(Lilium brownii var. viridulum),2018年7月采集于湖南省怀化市洪江市白芨药材种植专业合作社的龙牙百合生产基地。
1.2 试验方法
1.2.1 外植体消毒与选择 以龙牙百合商品球为外植体,将种球从外至里剥下鳞片,均放在1 L的大烧杯中,自来水下流水冲洗泥土30 min,之后用蒸馏水洗10 min,再投入0.1%HgCl2中消毒10 min,用无菌水冲洗3~5次,每次冲洗5 min,最后使用灭菌的滤纸吸干鳞片表面的水分。将消毒的鳞片从中部切开,分成上下两段,并分别斜插至诱导培养基上,筛选适宜的外植体部品。
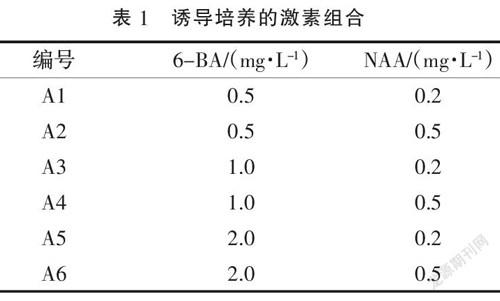
1.2.2 不定芽诱导培养 基本培养基为MS培养基,其中蔗糖30 g·L-1、琼脂7 g·L-1,pH 5.8,加入不同浓度的6-BA及NAA溶液,设计了6种培养基,如表1所示。每个处理接种30瓶,每瓶2个外植体,3次重复。百合组培苗生长的环境条件为每日16 h光/8 h暗培养,光照强度为1 500 lx,温度为(26±2) ℃。30 d后统计分化率。诱导分化率(%)=分化数/外植体数×100;分化系数=不定芽分化总数/分化数。
1.2.3 不定芽增殖培养 经初代培养基诱导分化后,待不定芽高度达到1~2 cm时,将龙牙百合不定芽切割成单个的芽体,接种到增殖培养基上进行培养。基本培养基为MS培养基,其中蔗糖30 g·L-1、琼脂7 g·L-1,pH 5.8,加入不同浓度的6-BA及NAA溶液,设计了6种培养基,如表2所示。每个处理接种30瓶,每瓶2个不定芽,设3次重复,培养条件同1.2.2。30 d后统计增殖情况并做记录。不定芽增殖系数=增殖芽体数/接种芽体数。
1.2.4 瓶内生根培养 待丛生芽高度生长至3 cm时,将长势健壮的芽切下分成单个的小鳞茎,接种于不同NAA浓度的生根培养基上。每个处理接种30瓶,每瓶2个小鳞茎,3次重复,培养条件同1.2.2。30 d后统计生根率及生根系数。基本培养基为1/2MS培养基,添加不同浓度的NAA溶液,分别为0.1,0.2,0.3 mg·L-1 NAA,分别记为C1、C2和C3。
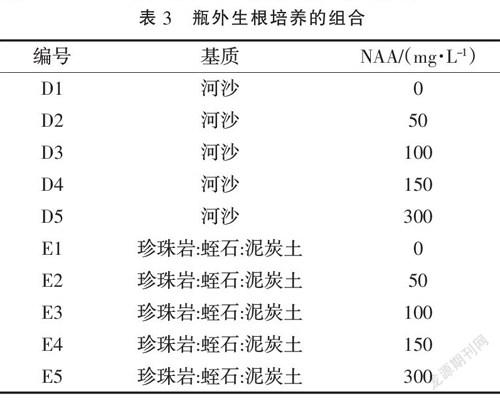
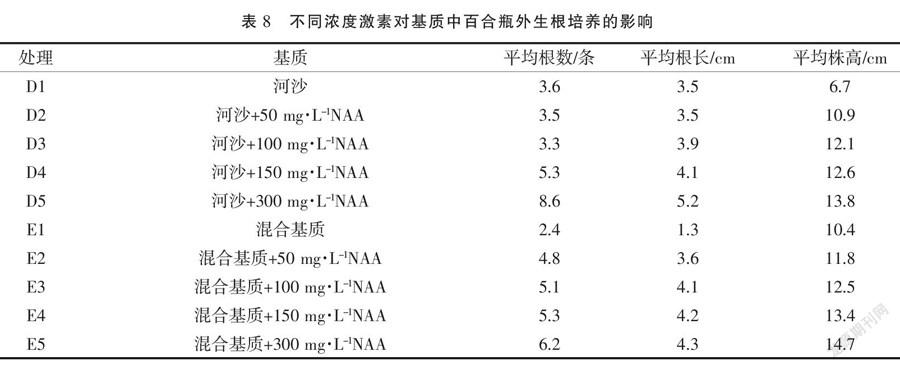
1.2.5 瓶外生根培养 瓶外生根法分别采用河沙和混合基质(珍珠岩∶蛭石∶泥炭土=1∶1∶1),无根苗移栽前,用0.1%~0.2%高锰酸钾溶液对基质进行消毒,种植时表面喷洒多菌灵溶液再次进行消毒,覆膜保持适宜的湿度。当无根苗鳞茎直径大于1 cm时,置于无强烈直射光的炼苗室内进行炼苗。炼苗4 d后,将组培苗从瓶内取出,洗净残留的培养基,在不同浓度的NAA的溶液(表3)中浸泡15 s左右,移栽到基质中。将其置于遮阴处,湿度控制在80%~90%,移栽温度以20~25 ℃为宜。30 d后统计生根情况。
1.3 数据分析
采用Excel 2010进行数据整理,利用SPSS 21.0软件对试验数据进行方差分析,采用单因素方差分析各处理差异以P<0.05表示显著性差异。
2 结果与分析
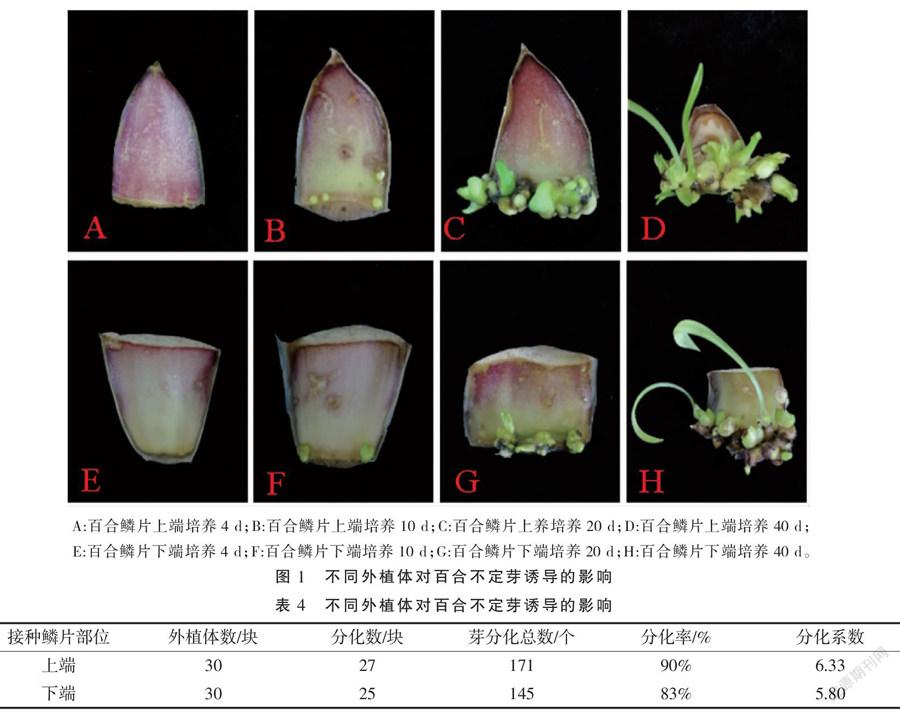
2.1 不同外植体对百合不定芽诱导的影响
由图1-A~D可以看出,取材部位不同,不定芽的诱导率也不同。以上端鳞片为外植体,其不定芽的分化时间早,接种后10~20 d时,上端鳞片的不定芽生长速度快,且不定芽分化数量也多;鳞片接种40 d时,上端鳞片的不定芽发育完成,数量多且生长健壮,并开始抽生新叶。由图1-E~H可以看出,下端鳞片不定芽发育速度慢和数量少,抽生的新叶呈淡绿色,叶片纤细。在同一激素水平下,分析龙牙百合鳞片取材部位与不定芽的分化率和分化系数的关系,结果(表4)表明,龙牙百合上端鳞片的分化率达到90%,分化系数高达6.33,均大于下端鳞片。综合说明龙牙百合上端鳞片适合诱导培养。
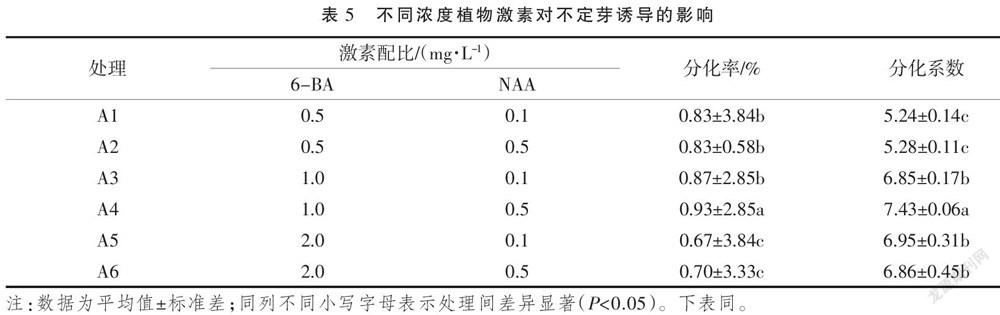
2.2 激素对百合不定芽诱导的影响
激素种类和浓度也影响不定芽的诱导,以2.1筛选的外植体在含不同浓度及其配比NAA和6-BA的培养基中进行不定芽诱导,结果如图2所示。在培养基A2和A6中百合幼苗纤弱,不定芽形成幼叶很快,并在基部长出新根;在A4和A5培养基中分化的不定芽数量最多,形成的小鳞茎鳞片肥厚,幼叶色泽浓绿。分析不同浓度及其配比的NAA和6-BA对龙牙百合不定芽的诱导效果有影响,结果(表5)表明,当NAA激素浓度不变时,随着6-BA浓度的升高,小鳞茎的分化率及分化系数呈现先上升后下降的趋势;当6-BA浓度不变时,高浓度的NAA更有利于不定芽的分化;A4培养基的不定芽诱导最高,分化率达到93%,分化系数为7.43,均显著高于其他培养基。综合说明,A4(MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA)培养基更适合龙牙百合不定芽的诱导。
2.3 不同浓度激素对百合不定芽增殖的影响
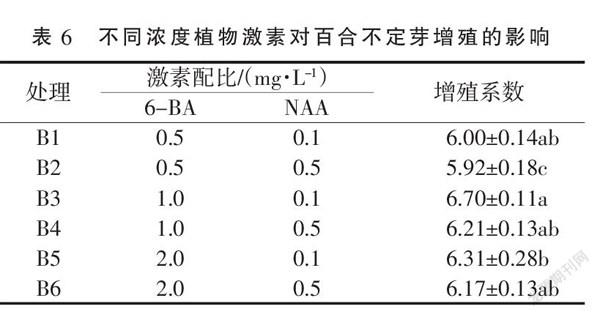
如图3所示,不定芽接种在增殖培养基上40 d时,不同浓度激素对不定芽的增殖的影响表现为:培养基B3、B4、B5和B6中不定芽数量多,长势旺盛;而B1和B2培养基中不定芽数量较少,叶色略有发黄;其中B3培养基中不定芽长势旺盛,叶片宽大。分析不同浓度6-BA与NAA对龙牙百合不定芽增殖率的影响,结果(表6)表明,在相同NAA水平下,随着6-BA浓度的升高,不定芽增殖系数先增加再下降;当6-BA浓度不变时,低浓度的NAA更有利于不定芽的增殖生长;其中B3培养基中龙牙百合不定芽的增殖系数最大为6.7,显著高于除B1和B4外的其他培养基。综合说明,龙牙百合最佳增殖培养基为B3,即MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1。2.4 不同浓度激素对百合生根培养的影响
2.4.1 瓶内生根 培养30 d后,不同培养基中百合组培苗根系生长情况如图4所示,C1培养基中试管苗叶片生长粗壮且颜色翠绿,根系发达粗壮,数量多; C2培养基中百合根系较纤细;C3培养基中百合根系生长不整齐,颜色发黄。分析不同培养基龙牙百合的生根情况,结果(表7)表明,随着培养基中NAA浓度的增加,百合生根数、株高及生根率均降低,根长有增加趋势。综上说明低浓度的NAA溶液(0.1 mg·L-1)有利于百合组培苗根系的生长。
2.4.2 瓶外生根 以河沙为培养基质时(图5),随着NAA溶液浓度的升高,百合根系的长度和新根数量逐步增加,可见河沙基质中NAA溶液有利于龙牙百合无根苗的瓶外生根培养。在混合基质中(图6),随着NAA溶液浓度的升高,百合新根的数量与长度在增长。通过比较两种基质中试管苗的生长情况可知,在河沙中新叶发生数量少,根系生长势强且数量多;在混合基质中,龙牙百合幼苗叶片数量多,且开展,地上部分生长速度明显优于地下部分。
分析基质与激素对百合瓶外生根的影响,结果(表8)表明,以河沙为基质,龙牙百合无根苗生根速度快、根系数量多且粗壮,其表现优于混合基质;对无根苗进行NAA预处理发现,龙牙百合幼苗的根系生长情况与NAA浓度的增加成正比,发根数和新生根的长度均呈上升趋势,当NAA浓度达到300 mg·L-1时,龙牙百合幼苗的根系最发达,根数为8.6条,根长为5.2 cm。
3 结论与讨论
3.1 外植体的类型影响组培苗的生长
在百合离体培养过程中外植体有鳞片、花器官、叶片、茎段、种子等,其中鳞片最常用。潘佑找等[9]以兰州百合的鳞片、叶片、根的不同部位为外植体进行植物组织培养,发现不同外植体分化能力存在差异,其差异由强到弱为:鳞片>根>叶片。罗凤霞等[10]以新铁炮百合叶片、花瓣、花丝、鳞片和种子为外植体进行组织培养再生研究,结果表明分化能力:种子>鳞片>花丝>花瓣>叶片。本试验在前人研究的基础上选择鳞片作为外植体进行诱导,大大的降低了组培的污染率,提高了外植体诱导的成活率,减少了试验材料的浪费;同时,试验过程中发现,以龙牙百合鳞片的上端为外植体时,诱导率高达到90%,分化系數高达6.33,比鳞片下端更优,且分化时间短,不定芽生长健壮。
3.2 植物激素影响百合组培苗的生长
在百合的植物组织培养中,常用激素有NAA、2,4-D、IAA、IBA、BR、6-BA、KT、TDZ等。任峻和宋迎亚[11]研究表明,生长素类化学物质(如NAA、2,4-D等)有利于植物愈伤组织的形成,而细胞分裂素类化学物(6-BA、KT等)主要是促进细胞分裂或不定芽的分化。目前大多数常用的6-BA的浓度为0.4~2.0 mg·L-1,NAA常用浓度为0.1~0.5 mg·L-1[12]。本试验将植物激素浓度设置在在常用浓度范围内,有利于不定芽的分化与增殖。通过不同激素配比试验发现,龙牙百合初代诱导培养基MS+1.0 mg·L-1 6-BA+0.5 mg·L-1NAA对不定芽诱导效果最好,与唐东芹[13]的研究结果相似。龙牙百合不定芽增殖最佳培养基配方为MS+1.0 mg·L-16-BA+0.1 mg·L-1 NAA,与庞新霞[14]的研究结果一致。当6-BA浓度过高 (高于1.0 mg·L-1),芽增殖情况较差,且有大量愈伤组织出现,这与王刚等[15]试验结果一致。在瓶内生根培养过程中,当NAA溶液浓度为0.1 mg·L-1时,百合根系的生长情况最好,这与王宏梅[16]的研究结果相似,即铁炮百合添加NAA的处理其生根率与平均生根条数比添加IAA、IBA的处理都要多, 且NAA浓度为0.1~0.2 mg·L-1时根系生长情况好。
3.3 瓶外生根法降低组培苗的生产成本
瓶外生根法实质就是将无根试管苗直接移植至适宜的基质中培养。本试验分别采用了河沙基质和混合基质,结果发现河沙基质的生根数量和根系长度都优于混合基质。百合适合生长在总孔隙度和通气孔隙度大的土壤中,并且百合的根系属于肉质根,而沙质土壤的透气性、透水性都十分良好,十分适合龙牙百合根系的生长。混合基质的保水性很好,基质的表层出现轻微板结现象,易造成鳞茎腐烂,地下部分无法呼吸,从而导致植物死亡,这与百合扦插繁殖试验结果[17]一致。本试验还采用NAA对龙牙百合进行预处理,结果表明浓度为300 mg·L-1的NAA溶液,促进龙牙百合的生根和根系生长,这与蓝莓组培苗瓶外生根试验结果[18]相似。组培苗瓶外生根技术已在蓝莓、草莓、甘蔗、八仙花、牡丹、栀子和蝴蝶兰等园艺植物上成功运用[19]。有研究表明,瓶内生根法产生的单株试管苗生根成本比瓶外生根法产生的单株试管苗生根成本高51%[20]。究其原因是瓶内生根法操作环节多,对操作技术和环境要求高,且生长周期较长,占用室内空间大,耗能大;而瓶外生根法操作简单,管理粗放。因此,瓶外生根法不仅有利于幼苗生长,而且节省了人力物力,降低生产成本,促进龙牙百合种苗高效、优质和低能耗生产。
参考文献:
[1] 中国科学院中国植物志编辑委员会.中国植物志-第十四卷[M].北京:中国科学出版社,1980:121.
[2] 曾礼. 邵阳龙牙百合生产现状及试管鳞茎诱导和脱毒培养[D]. 长沙: 湖南农业大学, 2010: 2-6.
[3] 罗丽萍, 杨柏云, 蔡奇英, 等. 龙牙百合热处理及茎尖培养技术研究[J]. 江苏农业科学, 2005(1): 72-73, 104.
[4] 陈芝华. 非洲菊组培苗湿润育苗技术与成本控制研究[D]. 南京: 南京农业大学, 2014: 3-10.
[5] 张春芬, 邓舒, 聂园军, 等. 草莓脱毒组培苗低成本快繁技术研究[J]. 山西农业科学, 2019, 47(3): 379-382.
[6] 谢文申, 周恒苍, 付晏昆, 等. 野薄荷脱毒苗低成本组培快繁研究[J]. 安徽农业科学, 2016, 44(9): 174-176.
[7] 张恒. 草莓脱毒苗组培快繁工艺的简化及降低成本研究[J]. 河北农业科学, 2013, 17(1): 68-71.
[8] VASIL I K. Automation of plant propagation[J]. Plant Cell Tissue and Organ Culture, 1994, 39: 105-108.
[9] 潘佑找, 柯尊濤, 赵宇瑛. 不同外植体对兰州百合组织培养的影响[J]. 安徽农学通报, 2007, 13(19): 242-245.
[10] 罗凤霞, 徐桂华, 金丽丽, 等. 新铁炮百合微繁的研究[J]. 沈阳农业大学学报, 2000, 31(3): 254-257.
[11] 任峻, 宋迎亚. 植物生长调节剂对贵州镇远野百合组织培养的影响[J]. 生物化工, 2018, 4(5): 11-14.
[12] 李筱帆, 张启翔. 百合组织培养和植株再生的研究进展[J]. 安徽农业科学, 2009, 37(4): 1479-1482.
[13] 唐东芹, 钱虹妹, 黄丹枫, 等. 百合基因转化直接分化受体系统的建立[J]. 江苏农业科学, 2003(3): 48-51.
[14] 庞新霞, 岑秀芬, 陈国建, 等. 不同激素组合对东方百合鳞茎组培芽增殖的影响[J]. 广西园艺, 2008, 19(2): 3-5, 14.
[15] 王刚, 杜捷, 李桂英, 等. 兰州百合和野百合组织培养及快速繁殖研究[J]. 西北师范大学学报(自然科学版), 2002, 38(1): 69-71.
[16] 王宏梅, 战淑敏, 蒋选利, 等. 铁炮百合继代培养与生根培养技术[J]. 山地农业生物学报, 2007,26(5): 467-470.
[17] 李艾徽. 3种基质对百合鳞片扦插繁殖的影响[J]. 南方园艺, 2014, 25(3): 11-13.
[18] 宗树斌, 王永平, 顾立新, 等. 激素对蓝莓组培苗瓶外生根的影响[J]. 山东林业科技, 2014, 44(6): 40-42, 6.
[19] 陈海霞, 赵红英, 张虓峰. 基质种类对八仙花组培苗瓶外生根的影响[J]. 湖南生态科学学报, 2017, 4(4): 9-13.
[20] 刘红坚, 范业赓, 何为中, 等. 甘蔗试管苗瓶内生根与瓶外生根培养方法比较研究[J]. 广东农业科学, 2013(18): 13-15.
