‘琯溪蜜柚’中乙螨唑、啶虫脒的残留测定及套袋对残留的影响
2021-01-16胡彧娴
胡彧娴
摘要:为评价乙螨唑、啶虫脒在‘琯溪蜜柚’上使用的安全性以及套袋对残留量的影响,对其残留消解动态进行研究。在蜜柚上施药进行田间试验,2种施药剂量分套袋和无套袋处理,QuEChERS结合高效液相色谱-串联质谱进行残留检测。结果表明,乙螨唑和啶虫脒在蜜柚中的残留消解动态均符合一级动力学方程,乙螨唑套袋处理的半衰期(T1/2)为5.30~5.47天,无套袋处理的T1/2为4.34~4.54天;啶虫脒套袋处理的T1/2为3.42~3.80天,无套袋处理的T1/2为3.04~3.70天。乙螨唑套袋处理的半衰期略长于无套袋处理的半衰期,而套袋对啶虫脒的半衰期影响不大。施药后65天在蜜柚中没有检出乙螨唑和啶虫脒残留。
关键词:乙螨唑;啶虫脒;琯溪蜜柚;残留;套袋
中图分类号:S481.8文献标志码:A论文编号:cjas2020-0162
基金项目:2018年漳州市自然科学基金项目“琯溪蜜柚中多残留QuEChERS HPLC-MS/MS检测方法的建立及套袋控残技术研究”(ZZ2018J30)。
Determination of Etoxazole and Acetamiprid Residue in Citrus maxima‘Guanxi miyou’and Effect of Bagging on Residues
Hu Yuxian
(Zhangzhou Agricultural Test and Inspection Centre,Zhangzhou363000,Fujian,China)
Abstract: To evaluate the safety of etoxazole and acetamiprid in Citrus maxima‘Guanxi miyou’and the effect of bagging on residues, a study on the residual degradation dynamics of etoxazole and acetamiprid was carried out. A field experiment was conducted on Citrus maxima‘Guanxi miyou’, two dosages were sprayed in bagging and non-bagging treatments, and then the residue was determined by QuEChERS combining with HPLC- MS/MS. The results showed that the residual degradation dynamics of etoxazole and acetamiprid followed the first-order kinetic equation, the half-life (T1/2) of etoxazole was 5.30-5.47 d in the bagging treatment, and 4.34-4.54 d in the non-bagging. T1/2 of acetamiprid was 3.42-3.80 d in the bagging treatment, and 3.04-3.70 d in the non-bagging. T1/2 of etoxazole was a little longer in the bagging treatment, but the T1/2 of acetamiprid had no obvious difference between the bagging and non- bagging treatment. The residues of etoxazole and acetamiprid in Citrus maxima‘Guanxi miyou’were not detected on the 65thday after spraying.
Keywords: Etoxazole; Acetamiprid; Citrus maxima‘Guanxi miyou’; Residue; Bagging
0引言
乙螨唑屬于噁唑类杀螨剂[1],广泛用于柑桔、棉花、花卉、蔬菜等作物上的叶螨防治[2],具有杀卵、杀幼虫活性[3]。啶虫脒是一种广谱的速效性杀虫剂,具有触杀、胃毒和较强的渗透作用[4],在国内广泛用于防治蔬菜、水果等作物的蚜虫[5],对柑桔蚜虫防治效果尤其突出[6]。‘琯溪蜜柚’是国内柚类主栽良种之一[7],原产于福建省平和县[8],是当地的主要经济作物。由于‘琯溪蜜柚’产生的经济效益较高,近年来种植规模不断扩大,现在平和已成为国内最大的柚类生产基地县和出口基地县[8]。然而,随着单一化种植及农药、化肥的不合理使用,蜜柚上的虫害发生日趋严重,已影响到蜜柚的品质和产量。乙螨唑和啶虫脒作为防治蜜柚虫害的主要农药品种之一,在生产上被广泛使用。
国内对乙螨唑的研究主要集中在药效试验与复配研发方面[9-11],对其检测方法和残留代谢研究报道并不多,仅在枸杞[12]、苹果[13]、柑桔[14]上有相关报道。对啶虫脒的检测方法和残留动态方面已有诸多报道,主要集中在毛叶枣[15]、辣椒[16]、草莓[17]、黄瓜[18]、苹果[19]、开心果[20]等作物上。但乙螨唑和啶虫脒在蜜柚中的残留及消解规律均没有相关研究数据。
目前,果实套袋已成为生产绿色果品的主要栽培技术之一,其具有降低农药残留[21]、减少果实病虫为害及提高果实品质[7,22]等优点。笔者以‘琯溪蜜柚’为试材,建立QuEChERS结合高效液相色谱-串联质谱快速检测方法,研究乙螨唑和啶虫脒在蜜柚中的残留动态,并研究套袋对其残留量的影响,旨在评价农药使用的安全性,为‘琯溪蜜柚’在种植过程中的科学用药及其绿色化发展提供理论依据。
1材料与方法
1.1试验材料与仪器设备
供试‘琯溪蜜柚’为7年生。供试农药为20%乙螨唑悬浮剂(100 mL/瓶,河北威远生物化工有限公司)、 20%啶虫脒可溶粉剂(25 g/袋,江苏龙灯化学有限公司)。
乙螨唑、啶虫脒标准品(100 mg/L,农业部环境保护科研监测所);无水MgSO4和NaCl均为分析纯;N-丙基乙二胺(PSA,德国CNW公司);乙腈、甲酸、甲醇均为色谱纯。
T-18 basic ULTRA TURRAX高速匀浆机(德国IKA公司);3-18K高速离心机(德国Sigma公司);DIONEX Ultimate 3000- Thermo TSQ Quantum Ultra EMR高效液相色谱-串联质谱联用仪(美国ThermoFisher公司)。
1.2田间试验设计
参照《农药残留试验准则》[23],于漳州市平和县小溪镇厝丘村蜜柚园中实施田间试验。试验设4个处理,2种施药剂量,并分套袋和无套袋2种处理。每个处理6株蜜柚,设3个重复;以清水喷雾的无套袋处理为空白对照(表1)。

于2018年7月8日(此时蜜柚已谢花约90天)按常规方法对整株蜜柚进行均匀施药,施药后2天内无降雨,套袋处理待蜜柚表面的药液完全干燥才能进行。采用1次施药多次采样的方法,分别于施药后0(约 2 h,此时果实表面药液已干)、1、3、7、15、30、65天采集蜜柚样品测定残留量。
1.3分析方法
1.3.1提取与净化参考蔡恩兴[24]建立的QuEChERS方法。称取10 g(精确至0.01 g)搅碎成匀浆的蜜柚全果样品于50 mL离心管中,加入20.0 mL乙腈、1.0 g NaCl和4.0 g无水MgSO4,在匀浆机中高速匀浆提取2 min,4500 r/min离心5 min,吸取2.0 mL上清液加到内含0.10 g PSA和0.30 g无水MgSO4的离心管中,涡旋1 min,过0.22μm有机滤膜,待高效液相色谱-串联质谱测定。
1.3.2检测条件
(1)液相色谱条件。色谱柱为Atlantis T3 Column(100 mm×2.1 mm,3μm);流动相为0.1%甲酸(A相)和甲醇(B相);流速为0.25 mL/min;进样体积为2.0μL;乙螨唑保留时间为7.31 min;啶虫脒保留时间为5.28 min;流动相及梯度洗脱程序见表2。

(2)质谱条件。质谱扫描模式为电喷雾正离子扫描(ESI+);离子传输管温度为300℃;喷雾温度为270℃;喷雾电压为4000 V;鞘气(N2)流速为3.62 L/min,辅助气(N2)流速为5.38 L/min,放电电流为4.0μA,SRM检测模式;乙螨唑和啶虫脒质谱检测参数见表3。
2结果与分析
2.1质谱条件的优化
选择ESI+离子源,将1 mg/L的农药标样经注射泵注入质谱,调节合适的注射泵流速及离子源气流、电压、温度等使待测物信号大于106响应,且响应达到稳定状态。通过全扫描确定母离子,选择反应监测(SRM模式)进行二级质谱自动优化,分析质谱图及碰撞能量,最终确定单个农药的质谱检测参数。
2.2线性范围和灵敏度
将蜜柚空白样品按上述QuEChERS方法进行处理,得到空白基质溶液,配制基质匹配系列标准溶液并进样分析,以质量浓度为横坐标、对应的峰面积为纵坐标绘制标准曲线。2种农药在0.5~500μg/L浓度范围内线性关系良好,乙螨唑的线性回归方程如式(1),啶虫脒的线性回归方程如式(2)。

以3倍和10倍信噪比(S/N)计算检出限和定量限,乙螨唑的检出限为0.05μg/kg、定量限为0.17μg/kg,啶虫脒的检出限为0.06μg/kg、定量限为0.20μg/kg。
2.3添加回收试验
在蜜柚空白样品中分别加入2、20和200μg/kg 3个水平的混合标准工作溶液进行添加回收试验,每个水平重复5次。按1.3.1和1.3.2方法进行前处理和上机测定,乙螨唑的回收率为86.6%~97.6%、相对标准偏差(RSD)为2.6%~12.0%,啶虫脒的回收率为80.2%~ 109.4%、RSD为7.2%~9.6%。表明该方法适用于蜜柚中乙螨唑和啶虫脒的残留测定。
2.4残留动态及消解规律
2.4.1残留量与消解率乙螨唑和啶虫脒在蜜柚中的残留消解动态试验结果(表4~5)显示,不同施药剂量处理的原始沉积量存在一定差异。按推荐剂量(5000倍液)处理,乙螨唑和啶虫脒在蜜柚上的原始沉积量分别为0.115~0.121、0.132~0.143 mg/kg,而加倍剂量(2500倍液)处理分别为0.213~0.232、0.241~0.255 mg/kg,说明2种农药的原始沉積量与其施药剂量有关。
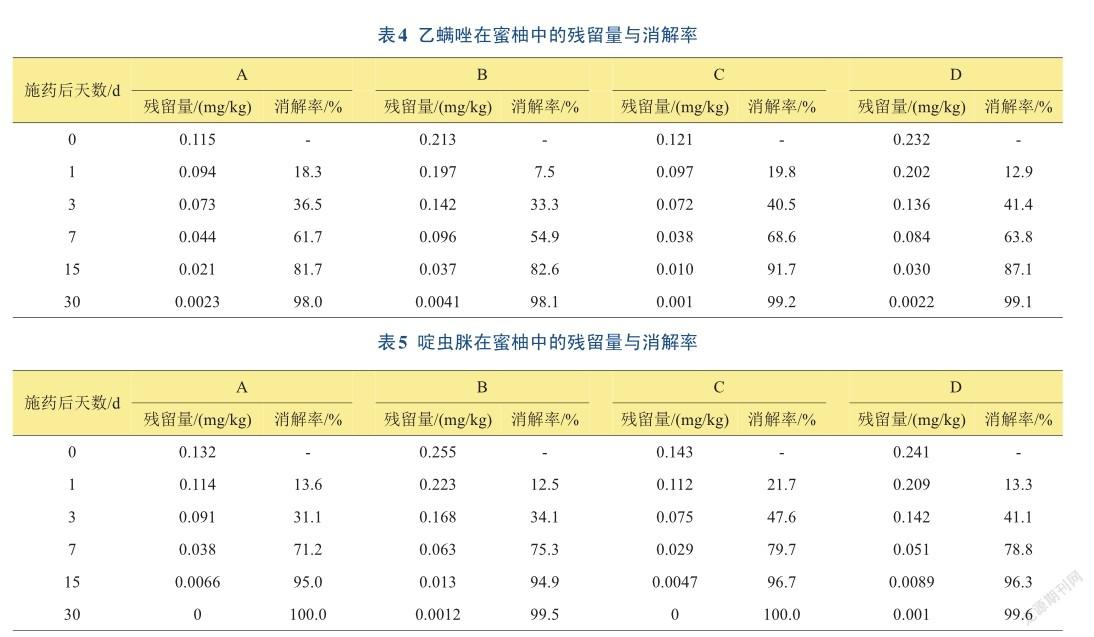
在施药剂量和采样时间相同的条件下,2种农药套袋处理的消解率均略低于无套袋处理,但在施药后30天消解率均大于98%,最终趋于一致。
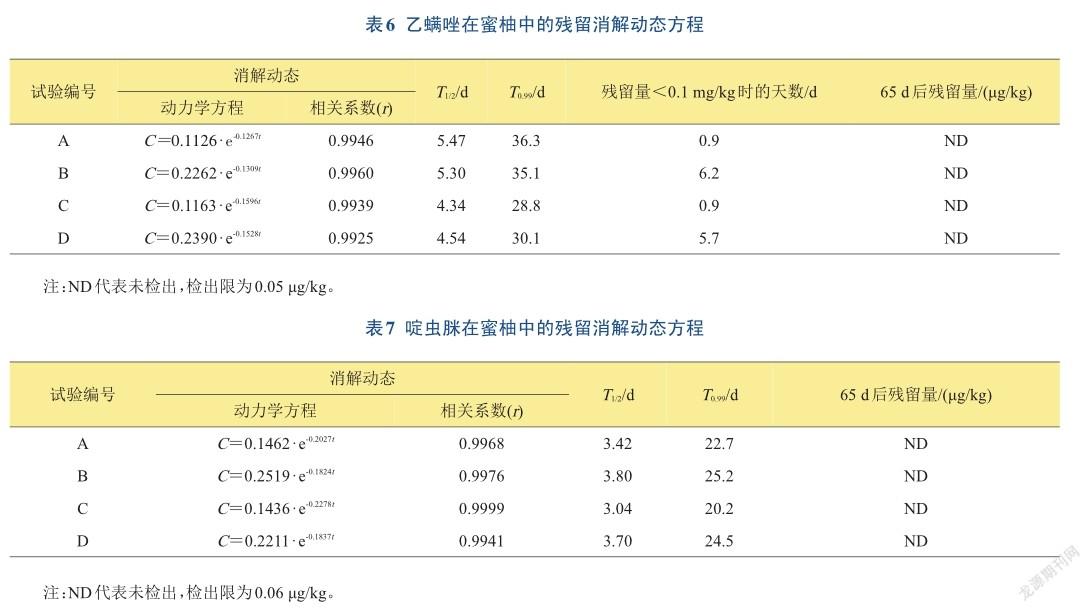
2.4.2残留消解规律及最终残留对2种农药进行回归分析(表6~7),其残留消解动态均符合一级动力学方程。乙螨唑在蜜柚中4种处理的相关系数(r)在0.9925~0.9960之间,消解系数(k)在0.1267~0.1596之间,套袋处理的半衰期(T1/2)为5.30~5.47天,消解99%所需要的时间(T0.99)为35.1~36.3天;无套袋处理的T1/2为4.34~4.54天,T0.99为28.8~30.1天,套袋处理的半衰期略长于无套袋的半衰期。
啶虫脒4种处理的相关系数(r)在0.9941~0.9999之间,消解系数(k)在0.1824~0.2278之间,套袋处理的T1/2为3.42~3.80天,T0.99所需要的时间为22.7~25.2天;无套袋处理的T1/2为3.04~3.70天,T0.99为20.2~24.5天,套袋对啶虫脒的半衰期影响不大。
在蜜柚成熟收获时(施药后65天)进行采样,测定其最终残留量,2种农药的4种处理均未检出其残留。
3讨论
本试验建立了QuEChERS结合高效液相色谱-串联质谱快速检测方法,对蜜柚中乙螨唑和啶虫脒的残留量进行测定。乙螨唑的检出限为0.05μg/kg,定量限为0.17μg/kg,回收率为86.6%~97.6%;啶虫脒的检出限为0.06μg/kg,定量限为0.20μg/kg,回收率为80.2%~ 109.4%。该分析方法操作简单,灵敏度较高,符合农药残留分析的要求。
2种农药在蜜柚中的残留消解动态均符合一级动力学方程,乙螨唑套袋处理的T1/2为5.30~5.47天,无套袋处理的T1/2为4.34~4.54天,套袋处理的半衰期略长于无套袋的半衰期,原因可能是套袋后乙螨唑受光解、雨淋等外界环境因素影响较小,因而消解较慢。而啶虫脒套袋处理的T1/2为3.42~3.80天,无套袋处理的T1/2为3.04~3.70天,套袋对啶虫脒的半衰期影響不大,这可能与啶虫脒具有内吸性有关,在一定程度上受外界因素干扰较少,但有待于进一步研究确认。
目前,在GB 2763—2019[25]中最新规定乙螨唑、啶虫脒在蜜柚上的最大残留限量(MRL)分别为0.1、2 mg/kg,根据残留消解动力学方程测算(表6),乙螨唑套袋处理的安全间隔期分别为0.9、6.2天,无套袋处理的安全间隔期分别为0.9、5.7天,不同的施药剂量对其安全间隔期有较大的影响;而啶虫脒在蜜柚上的MRL值较大,按常规方法进行喷施则无安全间隔期问题。本研究先充分施药再进行套袋,采用1次施药多次采样检测的方法,并在果实成熟后测定其最终残留量,2种农药的4种处理均未检出其残留,表明2种农药在蜜柚上使用具有较好的安全性。对蜜柚进行套袋可以减少农药使用次数,节省生产成本,促进蜜柚产业绿色发展。
参考文献
[1]王飞菲,解维星,吕文东,等.25%乙螨唑·哒螨灵悬浮剂的配方研究与开发[J].中国农药,2019(2):37-40.
[2]王志静,蒋迎春,何利刚,等.乙螨唑对柑桔全爪螨的室内毒力测定[J].中国南方果树,2012,41(4):75-76.
[3]戴炜锷,程志明.新颖杀螨剂——乙螨唑的合成[J].浙江化工, 2009,40(7):7-9.
[4]石贵华.50%啶虫脒水分散粒剂在柑橘和土壤中残留量及消解动态[J].现代农药,2012,11(1):46-49,53.
[5]王骏.HPLC/MS测定啶虫脒在蔬菜、水果中残留量[J].农药,2007, 46(8):535-537.
[6]徐春明,储春荣.啶虫脒防治柑桔蚜虫和潜叶蛾药效试验[J].农药, 2000,39(7):25-26.
[7]赵晓玲,佘文琴,林慧颖.不同套袋处理对琯溪蜜柚果实品质的影响[J].中国南方果树,2012,41(4):62-64.
[8]李发林,曾瑞琴,危天进,等.福建省平和县琯溪蜜柚果园土壤磷环境风险评价研究[J].中国生态农业学报,2018,23(8):1001-1009.
[9]岳建苏,李鸿筠,冉春.乙螨唑及其复配剂对柑桔全爪螨田间药效试验[J].中国南方果树,2013,42(6):54-55.
[10]李戎.乙螨唑水分散粒剂和阿维菌素微乳剂防治柑桔全爪螨药效试验[J].中国南方果树,2015,44(4):21-22.
[11]石丹艳.18%阿维菌素·乙螨唑悬浮剂防治柑橘红蜘蛛田间药效试验初报[J].安徽农学通报,2018,24(9):77-78.
[12]牛艳,陈翔,杨静,等.枸杞中乙螨唑残留量的高效液相色谱测定方法及消解动态[J].农药,2018(12):905-907.
[13]官帅,张树秋,李慧冬,等.气相色谱-质谱法测定乙螨唑在苹果和土壤中的残留及消解动态[J].农药学学报,2015,17(4):480-485.
[14]王蒙岑,吴慧明,刘少颖,等.超高效液相色谱-串联质谱法分析乙螨唑在柑桔和土壤中的残留消解动态[J].农药学学报,2009,11(4): 456-461.
[15]林涛,李泳波,陈兴连,等.毛叶枣中多菌灵、吡虫啉和啶虫脒消解动态研究[J].热带作物学报,2018,39(8):1630-1635.
[16]郇志博,谢德芳.啶虫脒在辣椒上的残留行为研究及膳食风险评估[J].热带作物学报,2014,35(10):2093-2097.
[17]马俊岭,杨宝东,张志勇,等.啶虫脒防治草莓蚜虫的残留动态及膳食风险评估[J].农药,2014,53(5):346-349.
[18]丁悦,孙星,汪佳蕾,等.露地和大棚条件下啶虫脒在黄瓜和土壤中的残留及消解动态[J].农药学学报,2014,16(1):110-114.
[19]刘新刚,董丰收,杨爽,等.啶虫脒在苹果和土壤中的残留及消解动态[J].农药,2007,46(10):693-695.
[20]Faraji M, Noorbakhsh R, Shafieyan H, et al. Determination of acetamiprid, imidacloprid, and spirotetramat and their relevant metabolites in pistachio using modified QuEChERS combined with liquid chromatography-tandemmassspectrometry[J]. Foodchemistry, 2018,240:634-641.
[21]陈合,李祥,李利军.套袋对苹果果实重金属及农药残留的影响[J].农业工程学报,2006,22(1):189-191.
[22]王建武,陈厚彬,周强,等.套袋对荔枝果实质量和农药残留的影响[J].应用生态学报,2003,14(5):710-712.
[23]农业部农药检定所,山西省农药重点实验室.NY/T 788—2004,农药残留试验准则[S].北京:中国农业出版社,2004:2-4.
[24]蔡恩兴.高效液相色谱-串联质谱法测定水果蔬菜中烯肟菌胺残留[J].热带作物学报,2017,38(10):1963-1968.
[25]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2019,食品安全国家标准食品中农药最大残留限量[S].北京:中国农业出版社,2019:72, 266.
