水热法制备参数对MnFe2O4/g-C3N4催化剂催化降解双酚A的影响
2021-01-16陈梅荣王金玉
陈梅荣,王金玉
(1.延安职业技术学院 石油和化学工程系,陕西 延安716000; 2.西南石油大学化学化工学院,四川 成都 610500)
目前,双酚A(BPA)被广泛应用于众多工业领域,因此在全球范围内获得大量生产,也造成了许多污染问题[1-2]。大部分双酚A都是在生产过程或制品使用期间流入水体中,严重危害水体生物的生存环境并对人类健康造成威胁[4-5]。随着双酚A处理工艺的不断发展,已经形成了机械分离法、生物吸附与氧化处理等多种处理方式[6-9]。但上述各类处理技术在消除双酚A过程中都面临着一些不足。其中,机械分离技术无法达到对双酚A的彻底去除;采用生物处理工艺则需要花费很长的时间,并且降解效率偏低。现阶段使用最多的是化学氧化技术,尤其是光催化氧化技术,由于具备高效环保的优势,在去除双酚A方面获得了广泛使用[10-11]。例如有学者采用石墨相氮化碳(g-C3N4)作为光催化剂对一些难以降解的污染物进行可见光条件下催化分解[12-13]。g-C3N4具有稳定性高,不会造成环境污染等优点,但其无法实现对光生载流子的高效分离,同时对太阳光也不能达到高效利用[14]。为克服上述问题,可以采用适当改性或结合使用更加高效的氧化工艺来促进光催化活性的显著提升。此外,还有一些学者运用硫酸根自由基来获得更优的氧化效果,并对相关作用机理进行了分析[15]。本文采用水热处理工艺制备含有 MnFe2O4纳米球的 g-C3N4复合光催化剂,并对催化剂光催化降解双酚A进行研究。
1 实验部分
1.1 催化剂制备
通过热缩聚工艺制备g-C3N4催化剂试样。首先将 5.00 g 三聚氰胺放入坩埚内;然后利用马弗炉对其按5 ℃·min-1的速率升温至550 ℃,保持处理 3 h得到块体;最后把制得的块体研磨成粉末状,待用。
通过水热处理工艺制备MnFe2O4/g-C3N4复合催化剂。首先取40 mL的乙二醇,加入 1 g的PVP充分搅拌,再添加适量的g-C3N4达到均匀混合状态;然后在上述混合液内添加 0.42 g的MnSO4·H2O、2.46 g的NaAc和1.35 g的FeCl3· 6H2O,搅拌处理1 h;最后在不锈钢釜中对溶液进行水热处理,将其升温到 200 ℃并保持 12 h,降至室温用去离子水反复清洗10次,将制得的固体粉末升温到 60 ℃经过8 h烘干,待用。
1.2 催化剂表征
采用X/Pert PRO 型X射线衍射对催化剂结构进行XRD测试;利用VERTEX 70型傅里叶红外光谱仪表征催化剂的各官能团参数;通过SU-8020型扫描电镜与H7500型透射电镜观察催化剂的微观组织结构;利用Hitachi 3010型紫外漫反射光谱仪表征催化剂的光学特性。
1.3 分析方法
配制10 mg · L-1的双 酚 A 溶液100 mL,称取所需量的催化剂加至上述溶液中,磁力搅拌下按照固定间隔时间取样,采用相同质量的甲醇进行淬灭得到 0.2 μm厚的膜层。对其进行乙醇与去离子水清洗后再放入烘箱内 60 ℃下持续烘干5 h。通过Waters2695型高效液相色谱仪对双酚A的含量进行测试,选择 C18型色谱柱并使用紫外测试器。
2 结果与讨论
2.1 催化剂表征结果
图1为MnFe2O4、 g-C3N4以及 MnFe2O4/g-C3N4试样的 XRD图。

图1 MnFe2O4、g-C3N4以及 MnFe2O4 /g-C3N4 试样的XRD图Figure 1 XRD patterns of MnFe2O4,g-C3N4 and MnFe2O4/g-C3N4 samples
图1中 MnFe2O4试样在2θ为 21.8°、28.3°与 54.5°处形成了相应的衍射峰,根据标准卡片可知这些衍射峰都是对应于尖晶石MnFe2O4的衍射峰,表明制得了尖晶石 MnFe2O4颗粒。对 MnFe2O4/g-C3N4的XRD图进行分析可知,分别形成了 g-C3N4与 MnFe2O4对应的衍射峰,没有杂质成分对应的衍射峰,表明在复合催化剂中存在 g-C3N4和 MnFe2O4两种物相成份。
图2为MnFe2O4/g-C3N4催化剂的SEM和TEM照片。从SEM照片可以看出,在g-C3N4纳米片表面形成了球形的 MnFe2O4颗粒。从TEM照片可以发现在层状 g-C3N4纳米片上分布着许多球形小颗粒,可以推断在g-C3N4表面已经负载上了 MnFe2O4纳米颗粒。根据上述分析可知,可以利用水热工艺制备得到MnFe2O4/g-C3N4复合半导体。由于MnFe2O4纳米颗粒已经和 g-C3N4达到紧密结合状态,这为两者交界处的光生载流子传输提供了大量通道,因此 g-C3N4获得了更优的光催化性能。

图2 MnFe2O4/g-C3N4催化剂的 SEM和TEM 照片Figure 2 SEM and TEM images of MnFe2O4/g-C3N4 catalyst
2.2 参数优化
2.2.1 MnFe2O4掺杂量
图3为不同MnFe2O4掺杂量对MnFe2O4/g-C3N4催化剂催化降解双酚A性能的影响。从图3可以看出,掺杂不同含量的MnFe2O4时,MnFe2O4/g-C3N4催化剂对双酚A的去除率发生了较大变化。随着MnFe2O4掺杂量提高,双酚A去除率先升后降,当MnFe2O4掺杂量为30%时,双酚A去除率最高,达到 96.4%。继续提高MnFe2O4掺入量至40%,双酚A去除率下降,变为73%。产生上述现象的原因在于,当在 g-C3N4表面形成更高比例的 MnFe2O4后,可以使g-C3N4表面获得更多的 PMS活化点,两者结合后产生异质结,使 g-C3N4可以对光生载流子进行更高效分离,因此获得更高的双酚A降解效率。随着MnFe2O4掺杂量的继续增加,会影响到双酚A降解活性,导致双酚A去除率的下降。选择MnFe2O4含量为30%进行后续实验。

图3 MnFe2O4掺杂量对双酚A去除率的影响Figure 3 Effect of MnFe2O4 doping amount on BPA removal rate
2.2.2 催化剂用量
图4为MnFe2O4/g-C3N4催化剂用量对双酚A去除率的影响。从图4可以看出,提高催化剂用量后,双酚A去除率先上升再下降。这是因为处于低浓度下,当催化剂含量提高后,形成了更多的活性点,此时在体系内形成了大量活性自由基,使 双酚A发生更快降解。但随着催化剂加入量进一步增高后,溶液透光率减小,阻碍了 g-C3N4的吸光过程,导致无法发挥良好的光催化性能。选择MnFe2O4/g-C3N4催化剂用量为1.0 g·L-1进行后续实验。
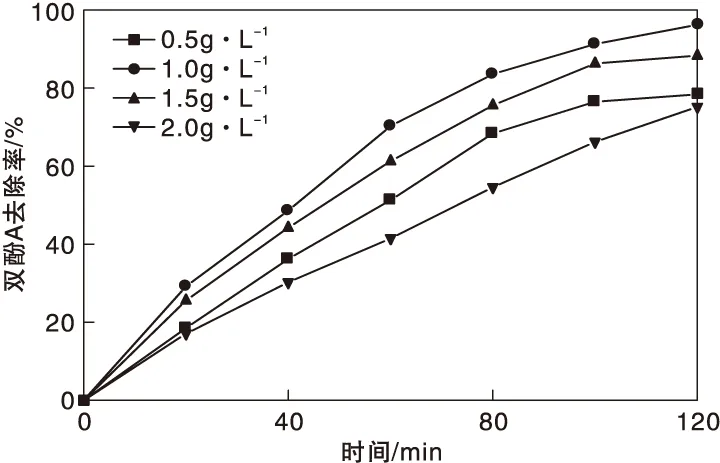
图4 MnFe2O4/g-C3N4催化剂用量对双酚A去除率的影响Figure 4 Effect of MnFe2O4/g-C3N4 catalyst dosage on BPA removal rate
2.2.3 反应溶液 pH值
图5为溶液 pH值对双酚A 去除率的影响。从图5可以看出,改变 pH值后,双酚A基本保持稳定的降解率。pH=9时,双酚A达到了99%的最大去除率; pH=5 时,双酚A去除率发生了减小现象,此时双酚A去除率接近93%。这是因为碱能够对 PMS起到活化作用,使双酚A被快速去除。当处于酸性溶液中时,双酚A 基本都转变为H2SO5,阻碍了催化剂的催化过程,从而减小了双酚A的去除率。

图5 溶液 pH值对双酚A 去除率的影响Figure 5 Effect of solution pH value on BPA removal rate
2.3 不同催化剂体系
表1为不同催化剂体系下双酚A的去除率。根据表1结果可知,处于可见光环境下,各催化体系中都发生了光催化过程。持续光照处理 2 h后,g-C3N4和 MnFe2O4依次使 双酚A降解了18%和13%,而MnFe2O4/g-C3N4体系中双酚A去除率达到了85%,由此表明,采用 MnFe2O4对g-C3N4改性处理后能够达到更高效的催化效果。这主要是因为 MnFe2O4可以对 PMS起到良好的活化效果。

表1 不同催化剂体系下双酚A 去除率Table 1 Removal rates of 双酚A under different catalyst systems
3 结 论
(1)MnFe2O4/g-C3N4催化剂XRD分析结果表明,MnFe2O4/g-C3N4形成了 g-C3N4和MnFe2O4对应的衍射峰。在g-C3N4纳米片层表面形成了球形的 MnFe2O4颗粒,在层状g-C3N4纳米片上分布着许多球形小颗粒,表明可以利用水热工艺制备得到MnFe2O4/g-C3N4复合半导体。
(2)随着MnFeO4掺杂量提高,双酚A 去除率先上升再下降;提高催化剂用量,双酚A去除率先上升再下降;改变 pH值后,双酚A保持基本稳定的去除率,当pH=9时,双酚A去除率最高,达到99%。采用MnFe2O4对g-C3N4改性处理后能够达到更高效双酚A去除效果。
