白细胞介素-17对血管内皮细胞迁移及成管的诱导及紫草素的抑制作用
2021-01-16窦雁鸣于雅洁张晓岚徐媛媛耿龙
窦雁鸣,于雅洁,张晓岚,徐媛媛,耿龙
(中国医科大学附属第一医院,辽宁 沈阳 110001)
紫草素(Alkannin)是提取自中国传统中草药——紫草根部的单体成分。紫草在历史上被用于抗炎,止血,治疗银屑病等[1]。研究证实紫草素有良好的抗肿瘤[2]、抗炎[3]等作用。既往研究发现紫草素可以抑制小鼠体内白细胞介素(IL)-17诱导的血管生成[4]。本实验意在观察IL-17对血管内皮细胞的影响及紫草素的干预作用。
1 材料与方法
1.1 细胞成管实验
1.1.1 细胞株 人脐静脉内皮细胞株(HUVEC)为中国医科大学附属第一医院心内科实验室赠予。
1.1.2 主要试剂 高糖型Dulbecco's Modified Eagle Medium(DMEM)细胞培养基、胎牛血清、青链霉素双抗、胰酶、磷酸缓冲盐溶液(PBS)均来自Biological Industries(BI)公司;高浓度低生长因子型基质胶(Matrigel)购于 Becton,Dickinson and Company(BD)公司;重组人源 IL-17A(Recombinant Human Interleukin-17A)购自 R&D Systems(R&D)公司。
1.1.3 材料准备 HUVEC使用高糖型DMEM培养基(含10%胎牛血清,1%青链霉素双抗)培养,置于含5%CO2的37℃培养箱中。每1~2天换液1次,并于镜下观察,当细胞呈铺路石状长至约80%时使用胰酶消化并传代,每次实验均使用5代以内的细胞。Matrigel于-20℃保存,实验前1天置于4℃冰箱内过夜解冻,将要与之接触的试剂及耗材均需4℃预冷。
1.1.4 实验方法 将Matrigel用高糖型DMEM稀释后(1∶1)加入 96孔板(60 μL/孔)。将板置于 37℃温箱中45 min后取出,HUVEC分为对照(PBS)组和IL-17组,每组3个复孔。对照组每孔加入HUVEC(100 μL,5×105个/mL) 及 PBS;IL-17 组每孔加入HUVEC(100 μL,5×105个/mL)及 IL-17(100 ng/mL)。将板置于37℃孵箱,5 h后取出并于光镜下观察。每孔随机选取3个区域进行拍照(100×)。利用Image J比较各组网状分支长度及网状结构面积差异。
1.2 小鼠体内基质胶栓实验
1.2.1 研究对象 无特定病原体级健康4~6周龄雄性C57BL/6小鼠,购于辽宁长生生物科技有限公司,许可证号:SCXK(辽)2015-0001。
1.2.2 主要试剂 紫草素(≥98%)购自南京广润生物制品有限公司;甲氨喋呤(MTX)、二甲基亚砜(DMSO)购自Sigma公司;重组鼠源IL-17A(Recombinant Mouse IL-17A)购自R&D公司;Anti-CD34兔多克隆抗体(BA3414)、多聚体抗兔 IgG-HRP试剂盒(SV0002)购于博士德生物工程有限公司;Anti-VEGFA兔多克隆抗体(WL00009b)购自万类生物科技有限公司;DAB染色液购自福州迈新生物技术开发有限公司。
1.2.3 材料准备 将Alkannin(50 mg)溶于2.5 mL DMSO 中,混匀为 20 mg/mL 的母液;MTX(50 mg)溶于50 mL PBS中,混匀为1 mg/mL的母液。实验前加入葵花籽油以配置不同工作浓度。IL-17溶解至25 μg/mL,实验时需与Matrigel混匀。
1.2.4 实验方法 将15只4~6周龄雄性C57BL/6小鼠随机分为5组,每组3只:空白对照组,模型组,MTX组,紫草素低剂量及高剂量组。基质胶注射参照Pickens等[5]的实验方法。空白对照组于小鼠右侧腹部皮下注射400 μL Matrigel(PBS),其余各组于小鼠右侧腹部皮下注射400 μL Matrigel(IL-17A,3 μg)。于第 2 d起各组灌胃 1次/d,持续 12 d,空白对照组及模型组予基质油(含2.5%DMSO葵花籽油,200 μL/d),MTX组予MTX[0.5 mg/(kg·d)],紫草素低剂量组予Alkannin[2.5 mg/(kg·d)],紫草素高剂量组予紫草素[5 mg/(kg·d)]。第14天以异氟烷吸入麻醉方式处死小鼠,留取胶栓并拍照,于4%多聚甲醛中过夜后石蜡包埋。HE染色观察病理现象。免疫组化染色观察CD34及血管内皮生长因子(VEGF)表达差异,每个标本随机挑选6处于镜下拍照,利用ImageJ分析阳性表达面积。
2 结果
2.1 细胞成管实验 5 h后,于显微镜下观察2组细胞成管情况。对照组:有明显网状结构形成;IL-17组:有明显网状结构形成,且网状分支长度及网状面积大小均显著高于对照组,差异有统计学意义(P<0.05)。见图 1。
2.2 小鼠体内基质胶栓实验
2.2.1 胶栓照片及HE染色 肉眼观察,空白对照组:胶栓呈透明胶质状,其中未见血管结构;模型组:胶栓可见有明显红色血管形成;MTX组、紫草素低剂量及高剂量组胶栓颜色较浑浊,但肉眼未见明显差异。光镜下观察病理变化,淡粉色为胶栓背景,空白对照组:靠近胶栓边缘有散在圆点状细胞分布;模型组:胶栓内有大量细长型、多角形细胞,且局部聚集呈网状;MTX组:胶栓内散在圆点状及细长型细胞;紫草素低剂量组:胶栓内有少量细长型及多角形细胞,稍有网状结构形成;紫草素高剂量组:靠近胶栓边缘处散在分布圆点状细胞,未见明显网状结构。见图2。
2.2.2 CD34免疫组化染色 空白对照组:胶栓边缘有散在CD34+细胞分布;模型组:与空白对照组相比,胶栓内有大量CD34+细胞且有微血管结构形成;MTX组:与模型组相比,胶栓内有少量CD34+细胞,几乎未见微血管结构;紫草素低剂量组:胶栓内有较多CD34+细胞,少有微血管结构;紫草素高剂量组:与模型组相比,可见胶栓边缘处散在CD34+细胞,几乎未见微血管结构。各组差异均有统计学意义(P<0.05)。见图 3。
2.2.3 VEGF免疫组化染色 空白对照组:胶栓内偶有阳性表达;模型组:与空白对照组相比,几乎所有细胞及其周围均有阳性表达(P<0.001);与模型组相比,MTX组仅有少量细胞周围存在阳性表达(P<0.001);紫草素低剂量组局部存在条带状阳性表达(P<0.01);紫草素高剂量组仅部分细胞周围有阳性表达(P<0.001)。见图 4。
3 讨论

图1 细胞成管实验(×100)
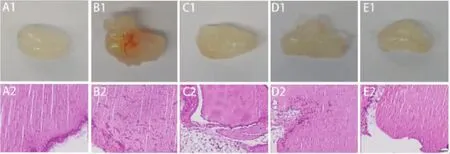
图2 胶栓图片及组织病理图片(HE染色×200)
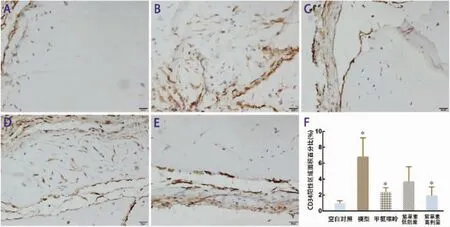
图3 CD34免疫组化染色(×400)
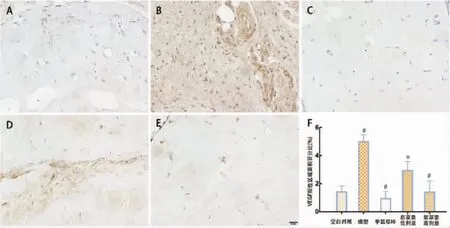
图4 VEGF免疫组化染色(×400)
银屑病是一种在角质形成细胞、树突状细胞及T细胞等作用下,机体固有及适应性免疫系统发生功能紊乱的系统性、炎症性疾病,真皮乳头层有典型的扩张屈曲微血管形成[6]。寻常型银屑病的鳞屑样红斑常伴有Auspitz征(移除表皮鳞屑后发生点状出血的现象)[7],研究发现VEGF升高可刺激血管内皮细胞上的VEGF受体促进血管生成从而加重Auspitz征[6]。
血管生成在银屑病[8]和皮肤肿瘤[9]等皮肤病中起重要作用,其包括由成血管细胞直接形成原始血管以及在现有血管基础上新血管的芽生,是生长发育中必不可少的一步[10]。病理状态下,不断增殖、迁移的血管内皮细胞会加剧新生血管对机体的侵袭[11]。已知血管生成过程受多种因子调控,例如VEGF[12],成纤维细胞生长因子(FGF)[13]等。现有的抗血管治疗尽管取得了良好效果,但仍存在许多药物不良反应的报道[14]。
在银屑病患者皮肤内IL-17常为高表达并且主要由真皮的γδT细胞产生[15]。免疫细胞所分泌的细胞因子也可以影响附近非免疫细胞(如角质形成细胞[16]及血管内皮细胞[17])的增殖和活力,过去通常认为IL-23及CD4+Th17细胞是最主要的促IL-17表达因素,后来发现肥大细胞及中性粒细胞也参与了IL-17的产生[18]。在一些病理状态下,IL-17参与了血管再生的过程:Koga等[19]研究发现在特应性皮炎中,IL-17可以诱导角质形成细胞产生VEGF从而增强血管生成;Numasaki等[20]认为IL-17可以通过促进血管内皮细胞迁移及成血管作用刺激肿瘤生长;Pickens等[5]发现在类风湿性关节炎中,IL-17可以经IL-17受体作用于血管内皮细胞并促进其迁移及成管。本实验发现IL-17可以在体外明显促进HUVEC的成管作用。基质胶在小鼠体内7~10 d即能形成胶栓,可以为新生血管提供与皮下组织相似的生长环境。利用该模型本实验发现IL-17可以在体内促进血管内皮细胞的迁移及成管,也可以显著增强胶栓中血管内皮细胞胞内及胞外VEGF的表达,而紫草素可以抑制IL-17的作用,且一定剂量的紫草素与MTX[21]有相似的抑制血管生成作用。实验结果提示紫草素有潜力成为以IL-17为靶向的抗血管治疗药物并在银屑病的治疗中发挥重要作用,其具体机制仍有待进一步探讨。
