载淫羊藿苷胞外囊泡促成骨作用的体外研究
2021-01-15王一凡张璇李军
王一凡 张璇 李军
淫羊藿苷(Icariin,ICA)是淫羊藿的主要提取物,具有加速细胞周期和促进骨髓干细胞成骨分化的作用[1-5]。近年来,细胞外囊泡(Extracellular Vesicles,EVs)因其独特的生物化学性质备受关注[6-7]。外泌体能负载蛋白质、脂类、核酸和植物提取物,并通过这些功能性物质的转运实现细胞间物质交换和信息传递[8]。本研究选用具有归巢潜能的间充质干细胞作为母细胞,首次将淫羊藿苷负载于外泌体中来实现ICA的缓释,明确ICA-EVs对骨髓间充质干细胞(BMSCs)的成骨分化作用,为ICA的成骨应用提供新思路。
1 材料及方法
1.1 材料
ICA从美国马萨诸塞州沃本市LC实验室购买,小鼠购自广东省医学实验中心。亲脂性荧光染料1,1′-十八烷基-3,3,3′,3′-四甲基吲哚碳菁高氯酸盐(DIL)和分子探针购于美国俄勒冈州尤金市。6-二氨基-2-苯基吲哚二盐酸盐(DAPI)和Triton X-100从Sigma-Aldrich(美国密苏里州圣路易斯市)获得。细胞培养基和胎牛血清(FBS)购自Gibco生命科技公司。荧光聚苯乙烯(荧光最大值G100)来自赛默飞世尔科技公司(美国)。
1.2 EVs分离
从分化的小鼠成骨细胞中分离出EVs。在成骨细胞第6天,更换培养基,并在第7天收集培养基。将培养基分别以300g离心5 min和2×104g离心20 min,去除细胞和较小的细胞碎片。收集的上清液通过聚醚砜膜过滤器(0.22 μm,美国康宁)并以1×105g离心60 min。用PBS冲洗颗粒并重新离心(1×105g离心60 min)。悬浮在无菌PBS中的颗粒在4 ℃下保存,直到进一步使用。
1.3 ICA-EVs的制备
使用超声法将ICA装载到EVs中,将ICA和EVs混合物使用505型超声去膜器进行超声处理,设置如下:20%振幅,6个周期30 s开/关,持续3 min,每个周期之间有2 min的冷却期。超声处理后,ICA-EVs溶液在37 ℃下孵育60 min,以恢复外体膜。使用NAP-10 Sephadex G25柱(通用电气医疗集团,英国)通过大小排阻色谱法从ICA-EVs分离多余的游离药物。
1.4 ICA-EVs的透射电镜观察
为了进行电子显微镜研究,将5 μL等分的ICA-EVs制剂放置在碳涂层的200目铜网格上,在室温下放置20 min。在PBS中用1%戊二醛固定5 min,用2%磷钨酸水溶液复染。使用JEOL-JEM-1400+电子显微镜,在80 kV下检查。
1.5 ICA含量及释放曲线
用高效液相色谱(HPLC)法测定EVs中ICA的含量,即将微离心管中的ICA-EVs(10 100个/mL)放置在设定为75 ℃的加热块上以蒸发溶剂。然后,加入等量乙腈,对混合物进行涡流、超声处理,然后以1.3×104r/min离心10 min。离心后取上清液,通过2 μm滤器过滤,转移到高效液相色谱自动进样瓶中。在高效液相色谱系统(安捷伦1200,美国)中注入20 μL等份。所有分析均采用C18柱(Supelco Nuclosil C18,250 mm×4.6 mm,5 μm,10 nm,Sigma-Aldrich)进行,流动相为H2O∶乙腈(45∶55),30 ℃下流速为1 mL/min。在270 nm处测量吸光度以监测ICA的洗脱。
为了测量ICA释放量,将新制备的ICA-EVs放置于PBS中,在RT条件下进行洗涤并搅拌。在透析管内的时间点取样,并按上述方法用高效液相色谱法进行分析。从ICA-EVs释放的ICA量表示为总ICA的百分比,并绘制为时间的函数。
1.6 细胞培养
所有实验方案均经陕西中医药大学第一临床学院动物护理与实验委员会批准。取4周龄SD大鼠股骨和胫骨的BMSCs。简单地说,股骨中段和胫骨的骨髓被冲洗出来,悬浮在完全培养基中(CM,α-MEM,Gibco,美国),添加10%胎牛血清(FBS,Gibco,美国)和1%青霉素/链霉素(Gibco,美国)。48 h后取出非贴壁细胞。第2代BMSCs用于以下实验。细胞在37 ℃含5%二氧化碳的加湿空气中培养。
1.7 ICA-EVs的成骨作用
培养基中含有20 μmol/L的ICA和ICA-EVs。BMSCs在室内接种,每2 d更换一次培养基,连续4周。诱导成骨后,用ARS测定钙沉积,证实分化。细胞经ARS染色20 min,DW洗涤,光学显微镜成像。随后,在10 mmol/L磷酸钠中加入10%氯化十六烷基吡啶,将溶液在25 ℃下孵育15 min。在562 nm处用微孔板阅读器测量ARS提取。
1.8 ELISA检测 Runx2及β-catenin含量
将ICA,EVs,ICA-EVs 分别接种于含有MSCs的12孔板中,细胞接种方法同上。12孔板分别培育3,7,14 d。应用 ELISA检测试剂盒,酶标仪波长480 nm测定A值。根据标准品浓度及A值,计算实验样本待测蛋白浓度。
1.9 统计学方法
采用SPSS 20.0软件对研究数据进行统计分析。P值为双侧,经Bonferroni校正,P<0.05差异有统计学意义。
2 结果
2.1 ICA-EVs的制备和表征
TEM检测结果显示ICA-EVs囊泡呈圆形,粒径分布较窄,平均粒径为(244.4±4.2)nm,见图1。
2.2 ICA载药量及释放曲线
用紫外可见吸收光谱法在270 nm波长处测量乙腈溶液中ICA的浓度,计算ICA-EVs中ICA的最大载药量为27.83%。如图2所示,ICA-EVs在生理盐水中浸泡10 h后,出现约56.4%的快速释放,随后的ICA-EVs释放行为趋向于平衡。
2.3 ICA-EVs上BMSCs的成骨分化作用
使用含有20 μmol/L的ICA和ICA-EVs培养基诱导BMSCs成骨分化,并在1,2,3周进行ARS染色以评估在有无ICA的EVs上生长的BMSCs的成骨细胞分化。在最初的7 d中,成骨细胞矿化没有明显增加(见图3)。但是在分化两周后,差异是明显的,尤其是在第7天和第14天之间(见图3)。在第14天和第21天,ICA-EVs中的BMSCs向成骨细胞的转化分别比ICA组高120%和160%。
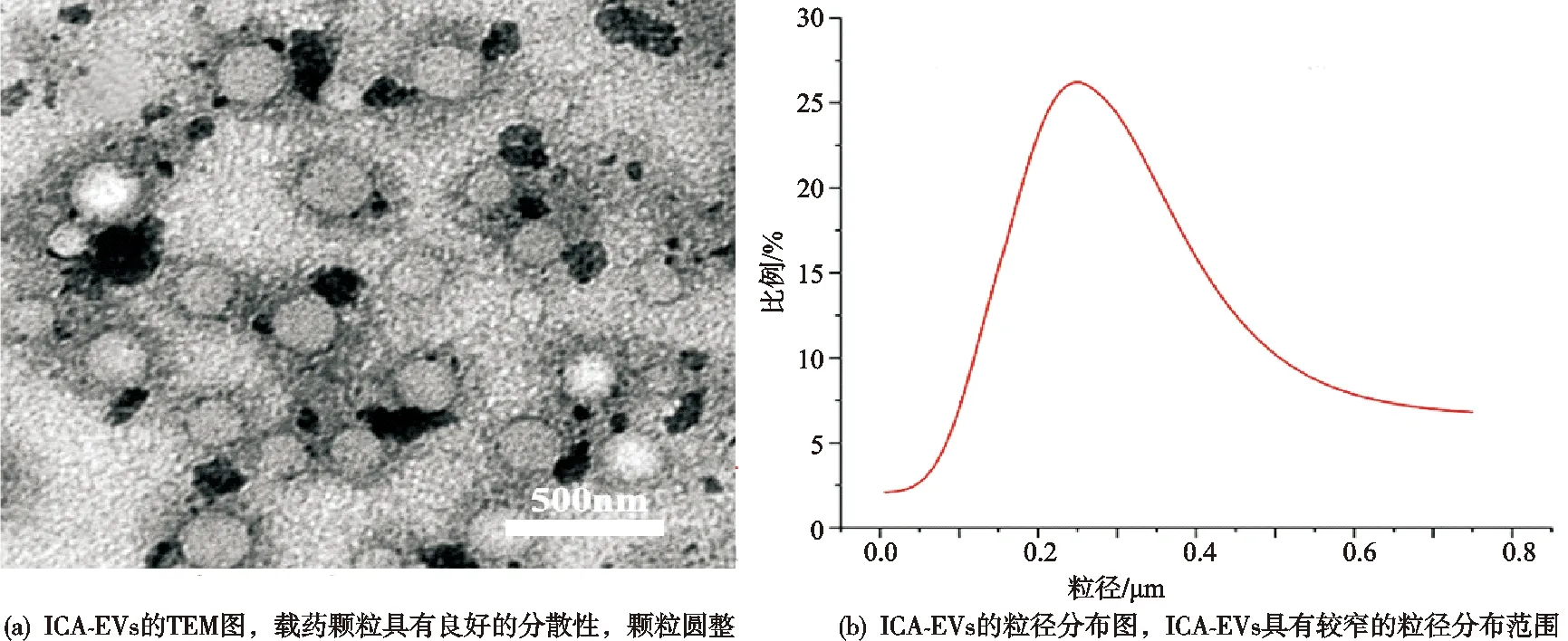
图1ICA-EVs的TEM及粒径分布图

图2ICA在50 h内的释放曲线
2.4 ICA-EVs复合物对ALP mRNA表达量的影响
实验组与空白对照组对ALP mRNA表达的影响差异都有统计学意义(P<0.05) (见表1) 。ALP是BMSCs早期成骨分化的重要标志,在细胞外基质矿化过程中具有重要的作用。本研究对12孔板中培养的BMSCs进行ALP染色,成骨诱导第3,7,14天行ALP染色分析均为阳性。ICA组和ICA-EVs在第7天和第14天显示出高于对照组的表达量,ICA-EVs在第7天其ALP表达量显著高于ICA,EVs未显示出促进ALP表达水平提高的作用。
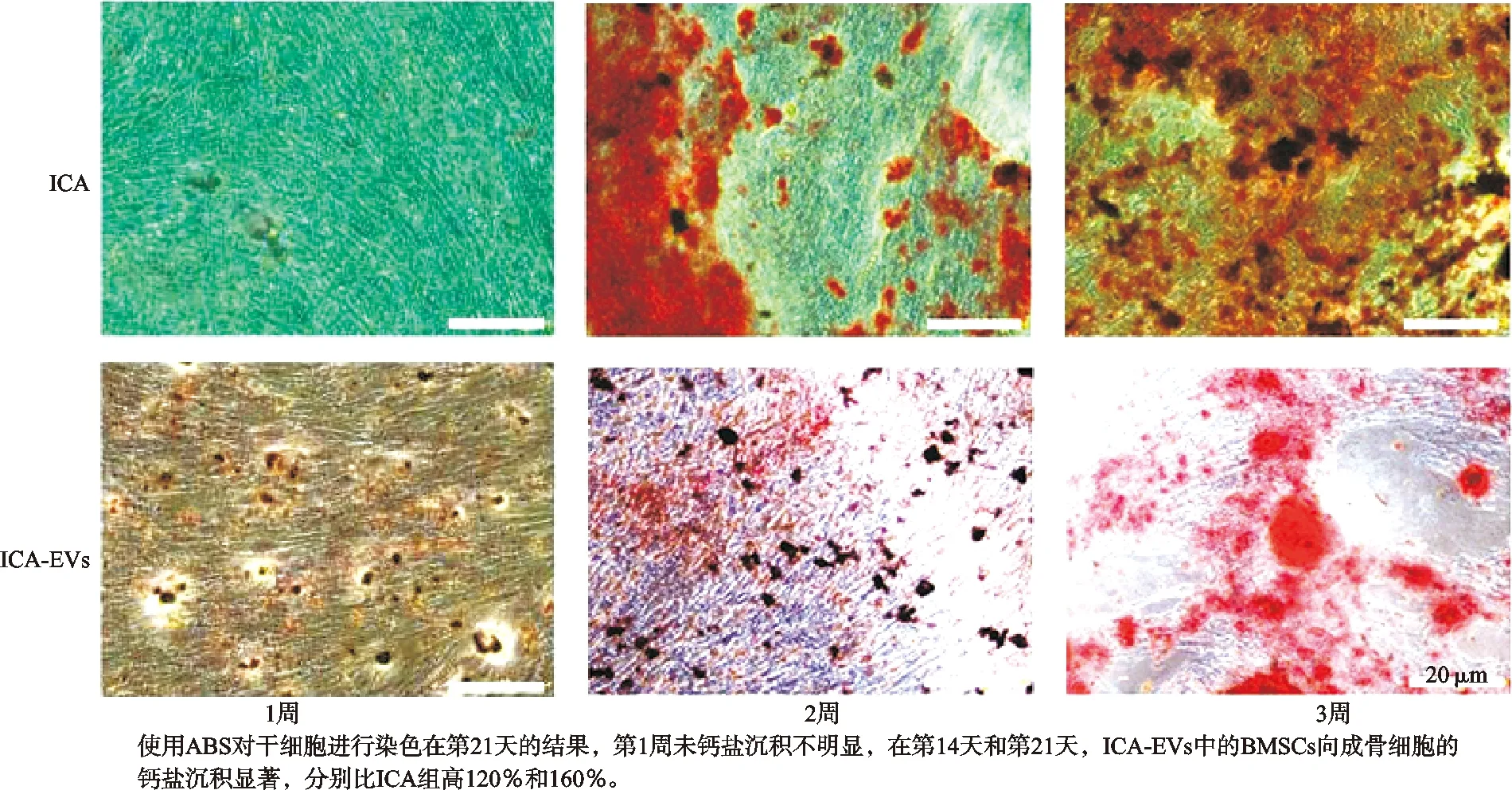
图3ICA-EVs的促成骨分化作用

表1 ICA-EVs复合物对BMSCs ALP表达的影响
2.5 ICA-EVs复合物对BMSCs中β-catenin表达的影响
ICA组仅在第3天时和对照组差异有统计学意义 (见表2),第7天和第14天时与空白对照组和EVs组的差异无统计学意义。
ICA-EVs在第3,7,14天,和对照组相比差异有统计学意义,但是在第3天其β-catenin活性和ICA组差异无统计学意义。

表2 ICA-EVs复合物对BMSCs 中β-catenin表达的影响
2.6 ICA-EVs复合物对BMSCs 细胞Runx2表达的影响
ICA组仅在第3天和第7天时与对照组差异有统计学意义 (见表3),第14天时均未显示出和空白对照组及EVs组的显著差异。ICA-EVs在第3,7,14天和空白对照组、EVs组、ICA组比较,差异均无统计学意义。在第14天其Runx2活性和ICA组差异无统计学意义。

表3 ICA-EVs复合物对BMSCs中Runx2表达的影响
3 讨论
外泌体兼具细胞基药物递送和纳米结构的优点,能有效突破各种生物屏障实现药物的高效转运[9]。在本研究中,笔者利用温和的超声处理制备载药体系,得到载药量较高的纳米复合物。这可能由于超声处理降低了外体膜的刚性,从而允许ICA进入脂质双层,从而提高了载药量。虽然超声波能显著减低外体膜的微粘度[10]。但不排除在外显体表面也有大量ICA黏附的可能,这是前10 h观察到ICA突释的原因。当外泌体膜与细胞或内体膜融合时,其管腔内的ICA可释放到靶细胞的胞浆中。其次,ICA-EVs制剂的稳定性对其临床应用至关重要。本研究制备的ICA-EVs制剂可以在25 ℃稳定存储超过1个月,和此前关于外泌体稳定性的研究相符[11]。
在骨质疏松症患者中,由于BMSCs的增殖和成骨分化减少,骨形成和降解平衡被破坏,导致骨再生能力有限。植物中提取的黄酮类化合物,如淫羊藿苷、染料木素和大豆黄酮,被证明能刺激骨骼形成[12]。由于淫羊藿苷在体外24 h对成骨细胞分化和矿化的促进作用强于染料木素,本研究选择淫羊藿苷作为骨修复剂,观察其骨修复作用。本研究制备的ICA-EVs制剂可以诱导BMSCs的成骨分化。在纳米制剂中生长的BMSCs在第14~21天之间显示出增加的成骨矿化能力,比游离ICA高1.2倍,显示加速干细胞成骨的潜力。
ALP是BMSCs细胞外基质成熟的早期标志物,该酶的活性高低可以用来检测早期成骨细胞的含量及分化程度[13],β-catenin主要在骨细胞增殖期表达,二者的表达在一定程度上反映了骨形成进程,是BMSCs分化成熟的重要标志。Runx2基因位于人类常染色体6p21位点,属于Runt域基因家族的转录因子之一。研究证实,Runx2能够激活骨钙素、骨桥蛋白等成骨相关基因的表达,诱导骨髓间充质干细胞向成骨细胞分化[14],进一步的研究发现,在小鼠在胚胎发育期内可见颅骨、躯干骨和四肢骨的骨髓间充质干细胞存在Runx2表达,而在已分化的骨和软骨细胞中检测不到[15]。故Runx2属于Runx蛋白家族,是一种能诱导骨髓间充质干细胞向成软骨细胞和成骨细胞分化、成熟的关键转录因子,在骨修复与重建中发挥重要作用[16-17]本实验通过检测ALP及β-catenin,Runx2的表达,研究 ICA-EVs复合物对BMSCs分化的影响,与空白对照组相比,ICA-EVS复合物在各检测时间点ALP活性增高,β-catenin及Runx2表达增加,说明 ICA-EVs复合物对BMSCs的成熟分化有促进作用并且这种作用可以维持到第14天甚至更长。ICA-EVs复合物对ALP,β-catenin,Runx2的促进作用优于ICA。
与空白对照组和EVs组相比,其余各组ALP表达均有增加,ICA-EVs复合物在第3,7,14天,BMSCs,Runx2,β-catenin的表达均显著高于对照组,促进BMSCs分化方面其效果显著优于ICA组。结果证明ICA-EVs在引导BMSCs成骨诱导方面的优越性,对于干细胞疗法及骨组织改建具有重要意义。
ICA-EVs在干细胞研究中显示出巨大的发展前景,基于笔者的研究结果,EVs还可以通过结合不同类型的纳米材料(如聚苯乙烯珠、玻璃珠)和肽(环RGD肽、iRGD肽)来改善平台。其他类型的干细胞,如多能干细胞和脂肪干细胞,也可用于研究ICA-EVs的成骨诱导潜力。利用EVs复合物作为培养制剂,从不同的干细胞系中获得所需的细胞类型,将有助于临床研究,特别是用于人体器官/组织损伤部位的再生。综上所述,课题组制备的ICA-EVs有望在干细胞骨再生医学领域做出贡献。
