维生素D及其受体介导microRNA的抗癌作用机制研究进展
2021-01-15郭苗苗路宏朝王珊珊
张 强, 郭苗苗, 张 涛, 路宏朝, 王珊珊, 王 令
(陕西理工大学 生物科学与工程学院, 陕西 汉中723000)
维生素D (Vitamin D, VD) 是一种脂溶性类固醇激素,其与VD受体 (Vitamin D receptor, VDR)特异性结合形成VD/VDR复合体介导基因转录,调控细胞增殖、分化和凋亡等。大量研究表明VD的缺乏与肿瘤发生发展相关,充足的VD可降低多种肿瘤的发生率,达到抗肿瘤的效果。microRNA是一类非编码RNA,部分microRNA受VD/VDR复合物调控而发挥抗肿瘤作用,并成为肿瘤治疗的新靶点。但是VD/VDR复合物如何介导microRNA的抗肿瘤分子机制仍未解析。
在癌症治疗过程中,CANARA等[1]研究发现活性维生素D(VD)的血清含量与患癌风险及癌症治疗有关。维生素D除维持血清中钙、磷平衡稳态、调节骨代谢等传统功能外,近年来大量流行病学与临床前研究表明维生素D的活性代谢产物——VD及其类似物在癌症预防和治疗中发挥重要作用,包括抑制炎症,抑制癌细胞入侵和转移,促进癌细胞凋亡与分化等[2]。micoRNA(miRNA)是一类非编码小分子RNA,通过直接降解目标mRNA或抑制靶基因翻译,降低靶基因表达水平。研究发现VD与维生素D受体结合形成复合物,调控特异microRNA的表达,从而发挥抗癌作用[3-4]。本文总结维生素D的作用通路以及通过调控microRNA表达水平而发挥的抗癌作用,以期为临床诊疗及科学研究提供新思路。
1 维生素D代谢过程与作用通路
维生素D属于脂溶性类固醇激素,通过与VDR结合调控靶基因的表达来发挥生物学功能。人体皮肤上皮细胞内的胆固醇经紫外线照射后氧化形成VD前体——7-脱氢胆固醇,运输至肝脏经25-羟化酶催化形成25(OH)D3,25(OH)D3经血液运送至肾脏,在1-羟化酶作用下形成具有生物活性的VD——1,25(OH)2D3[5-8]。VDR基因位于人2号染色体长臂,基因长度为75 kb,含11个外显子与10个内含子,属于类固醇激素核受体超家族成员[9]。1,25(OH)2D3在VD转运蛋白(VD binding protein, VDBP)作用下进入靶细胞,并与VDR结合后发挥其生物学作用 (图1)。最初,VD与VDR结合,维甲酸X受体(RXR)介导自身与VD二聚化形成复合体,该复合体结合靶基因启动子区域的VDR结合元件(VDRE)[10],随后聚集转录复合调节因子(Compound-mode, Co-mod)[11],在RNA聚合酶Ⅱ的作用下,调节靶基因的转录,从而发挥相应生物学功能[12]。
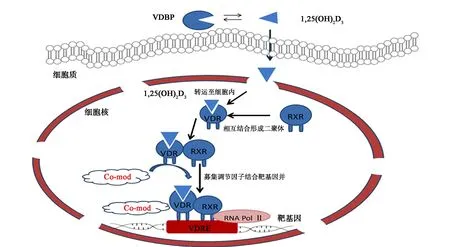
图1 VD调控靶基因表达示意图
2 维生素D抗肿瘤的主要途径
近20年的研究发现VD在几种慢性非传染性疾病,如心血管疾病、糖尿病或癌症的发病、进展和预后具有保护作用。关于癌症的发生,临床前和流行病学证据都表明VD及VDR具有致癌保护作用[13],VD及VDR介导的致癌保护或抑制肿瘤作用主要包括以下6个途径。
2.1 介导细胞凋亡
1,25(OH)2D3通过诱导凋亡的内在机制来促进肿瘤细胞凋亡,尤其是通过抑制抗凋亡基因BCL2,激活促凋亡基因BAX的表达,以此激活细胞凋亡系统[14-15]。此外,已有研究发现在VDR敲除鼠的乳腺上皮细胞的凋亡延迟,而1,25(OH)2D3介导野生小鼠乳腺上皮细胞生理性凋亡[16]。
2.2 抑制细胞增殖
周期蛋白依赖性激酶 (CDK) 在调节细胞周期过程中发挥重要作用,因此CDK抑制子可作为潜在的肿瘤抑制剂[17-18]。1,25(OH)2D3促进CDK抑制子p21、p27表达上调,并降低CDK活性,因此可诱导成视网膜细胞瘤蛋白去磷酸化,最终导致肿瘤细胞停滞于G0/G1期。1,25(OH)2D3促进细胞生长因子结合蛋白3、表皮生长因子、细胞生长抑制子,如转化生长因子-β的表达活性来抑制有丝分裂信号的传导[19-20],从而抑制细胞增殖。
2.3 抗炎症
炎症促进了许多肿瘤细胞的恶化,而1,25(OH)2D3在一些肿瘤细胞内显示出良好的抗炎症作用[21]。1,25(OH)2D3通过抑制环氧化酶2的表达来抑制前列腺素的合成,并增强15-羟基前列腺素脱氢酶的活性,降低前列素素受体的表达,从而抑制前列腺素作用通路,以此共同发挥抗炎症作用[22-23]。此外,上调MAPK磷酸酶5的活性和下调促炎性因子的产生而抑制p38应激激酶的信号通路,从而发挥抗炎症作用[24]。
2.4 抑制血管生成
1,25(OH)2D3通过抑制NF-kB信号通路内细胞白介素-8,低氧诱导因子1α的生成来抑制血管内皮生长因子的表达,从而共同抑制肿瘤环境内血管的生成[25-26],发挥抗癌作用。在VDR敲除鼠中,缺乏1,25(OH)2D3可增强促血管生成因子的表达,如促凋亡因子(HIF1α)、血管生成素1和血小板转化生长因子,表明这些促血管生成因子受控于VD/VDR复合物的调控[27]。此外,前列腺素E2可通过增强HIF1α的合成来促进血管的生成,1,25(OH)2D3可通过降低环氧化酶2的活性来减少前列腺素E2的产生,从而间接抑制血管生成[28-29]。
2.5 抑制肿瘤侵袭与转移
恶性肿瘤细胞转移是肿瘤病人死亡的主要原因之一[30]。血纤维蛋白溶酶原激活系统和基质金属蛋白酶是肿瘤细胞转移与入侵的重要激活因子[31]。已有研究表明1,25(OH)2D3可调控上述两种激活子从而抑制肿瘤细胞的侵袭与转移[32]。细胞粘合素C是一种细胞外基质蛋白,可增强肿瘤环境血管的生成并促进肿瘤细胞的侵袭,1,25(OH)2D3在转录水平通过下调细胞粘合素C而抑制肿瘤细胞的侵袭与转移。基质金属蛋白酶9结合细胞外基质发挥作用,以促进肿瘤细胞的入侵,1,25(OH)2D3通过抑制金属蛋白酶9的活性,上调金属蛋白酶1组织抑制剂的表达来抑制肿瘤细胞的侵袭与转移[33-34]。E-钙粘素是一种肿瘤抑制因子,与肿瘤的转移呈负相关,1,25(OH)2D3可通过增强E-钙粘素的表达来抑制肿瘤的转移[35]。
2.6 促进细胞分化
1,25(OH)2D3处理部分肿瘤细胞后,其恶性程度下降并表现出其他正常且成熟的细胞表型,暗示1,25(OH)2D3具有促进肿瘤细胞分化成正常细胞的作用[36-37]。1,25(OH)2D3通过增强p21的表达而诱导人类骨髓白血病细胞终末分化成单核细胞或巨噬细胞[17]。在乳腺癌细胞中,1,25(OH)2D3介导酪蛋白、脂质和粘着蛋白的表达,从而提高肿瘤细胞分化水平,恶性程度下降,获得更加成熟表型[25]。在前列腺癌细胞中,1,25(OH)2D3上调前列腺特异性抗原E-钙粘素和骨形态生成蛋白6的表达增强前列腺癌细胞的分化水平,降低其恶性程度。此外,1,25(OH)2D3还可通过β-catenin信号通路,PI3K以及NF-kB信号通路调控细胞特异性分化[10]。
3 VD调控microRNA表达及其抑癌分子机制
microRNA是内源基因在复杂的多重控制下转录形成的一类功能非编码RNA,能直接结合靶基因mRNA的3′或5′UTR区域,介导目标mRNA的降解或抑制翻译,从而降低靶基因表达水平[38-39]。根据预测,microRNA调控哺乳动物约30%基因的表达水平。研究资料表明,细胞内microRNA异常表达而诱发癌症的概率远高于正常表达的组织。所以,揭示microRNA影响肿瘤发生的机制是肿瘤研究领域重要方向之一,其为诊断、治疗和预防肿瘤提供新思路。
VD与受体VDR结合形成转录调控因子,作用于靶基因启动子区的VDRE,从而调控目标microRNA的转录[40]。在多种肿瘤细胞中,VD在转录水平调节microRNA的表达,进一步通过microRNA调控相应靶基因表达,产生抑制癌细胞增殖或促进癌细胞凋亡等一系列致癌保护效应。表1展示了多种癌细胞中VD调控的microRNA及其靶基因表达水平。
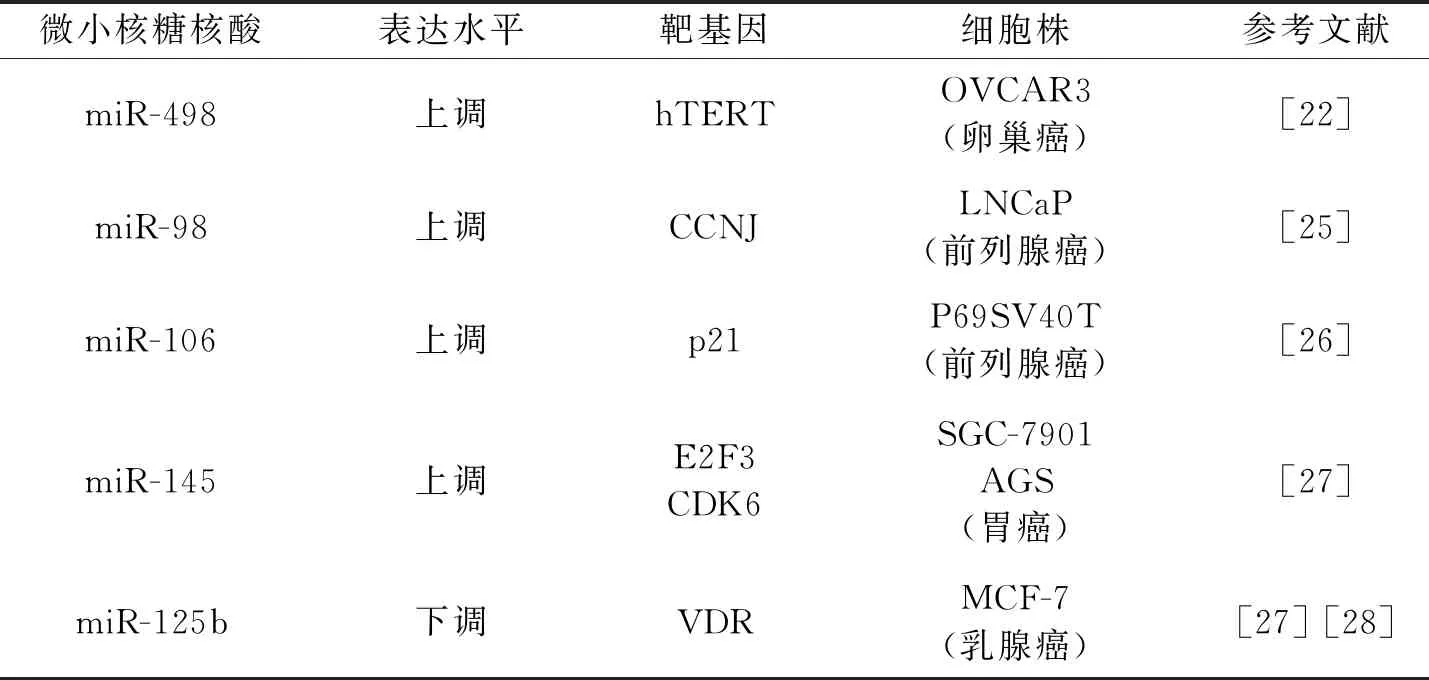
表1 VD调控不同癌细胞microRNA表达水平
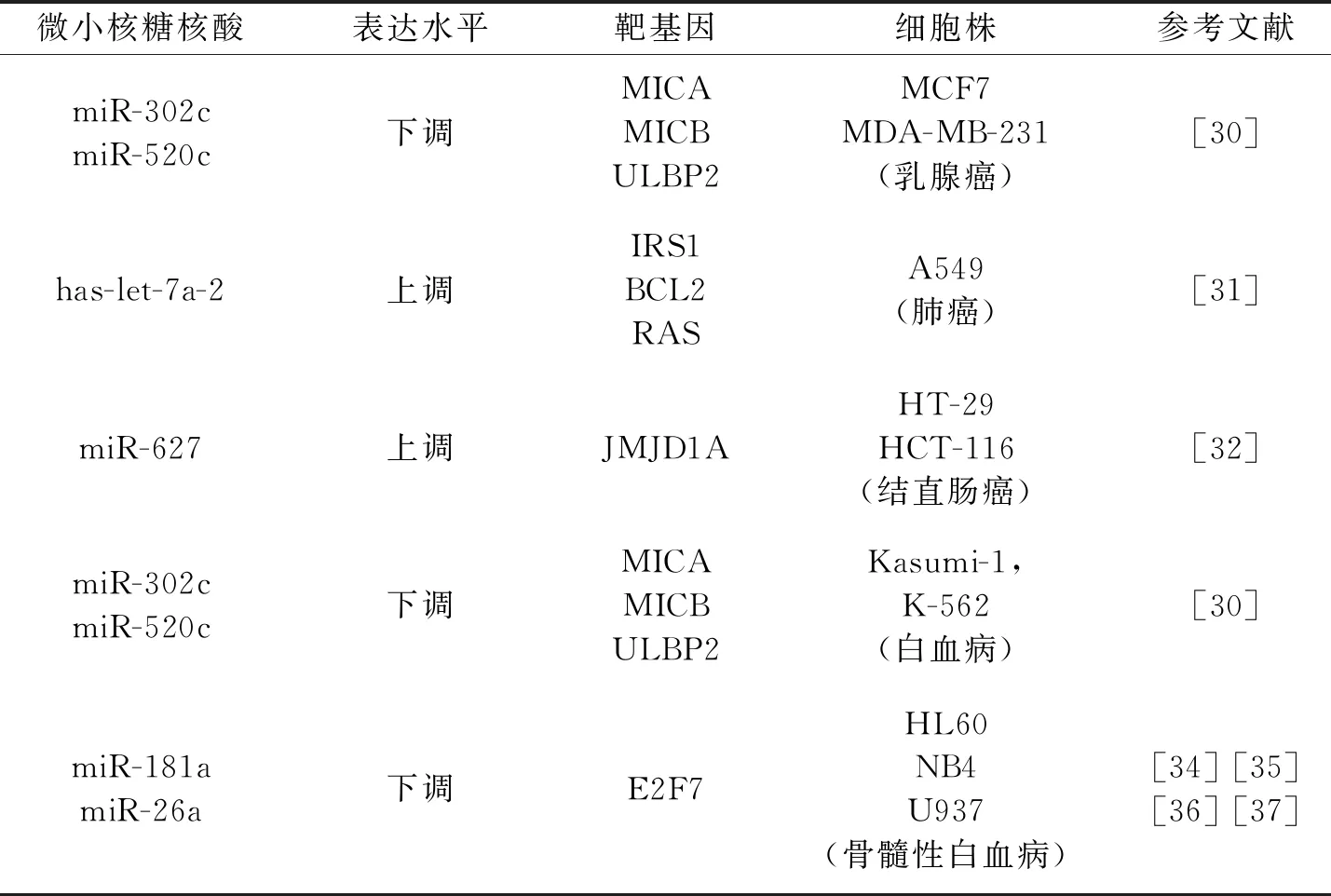
续表
3.1 卵巢癌
Kasiappan等[41]发现在人卵巢癌细胞OVCAR3中VD通过上调miR-498的表达来抑制人体端粒酶逆转录酶( hTRET )的表达,从而抑制癌细胞增殖。当用低浓度的VD处理OVCAR3 细胞24小时,miR-498首先产生应答,表明miR-498是对VD敏感的早期基因,且随着VD浓度的升高,miR-498表达水平呈浓度依赖性上调。进一步应用染色体免疫共沉淀实验发现,VDR-RXR异源二聚体结合于miR-498基因上游调控区的VDRE序,并募集共激活因子,增强miR-498表达水平。随后miR-498靶向结合hTRET 的mRNA 3′UTR,降解其mRNA。所以,在卵巢癌细胞中VD的抗癌作用主要通过上调miR-498表达,特异性降低hTRET表达水平,从而抑制癌细胞增殖。而且,miR-498介导的hTERT表达下调是降钙三醇在女性雌激素敏感肿瘤中抗瘦素活性的关键。
3.2 宫颈癌
González-Duarte 等[42]利用VD分别处理宫颈癌细胞SiHa,Hela和c33A ,24小时和48小时后,SiHa细胞内Dicer的表达水平在两个时间点都发生上调;在Hela细胞中,仅在药物作用48小时后 Dicer的表达水平增加,而在VDR表达阴性的c33A细胞,未发现Dicer 基因表达变化。此外,VD处理后SiHa细胞有大量microRNA上调,且miR-22, miR-2963p, miR-29c, miR-342-5p, miR-4455, miR-4462和miR-4656在两个时间段都发生了上调。随后利用凝胶电泳迁移实验与矩阵模型分析证明在Dicer基因启动子区有VDRE存在。综上,VD/VDR共同作用于Dicer酶基因启动子区的VDRE,促进酶的表达从而加速microRNA的加工过程,进而调控microRNA靶基因的表达水平,从而发挥抗癌作用。
3.3 前列腺癌
Ting等[43]发现在人类前列腺癌细胞LNCaP内,miR-98呈VDR依赖性表达。miR-98通过下调细胞周期素J (cyclin J, CCNJ )的表达,使细胞周期停滞于G2/M期而发挥抗癌作用。染色质免疫共沉淀结果显示,VD/VDR复合物募集共激活因子结合于microRNA-98编码基因HUWE1的VDRE,促进miR-98的表达上调。此外,VD通过抑制microRNA加工蛋白LIN28的表达来间接调控miR-98上调。最后利用荧光素酶报告系统证实miR-98作用于CCNJ mRNA的3′UTR区,降解其mRNA而降低表达水平。综上,在前列腺癌细胞程中,VD 通过直接和间接方式促进miR-98的表达上调,抑制CCNJ活性,使细胞停滞于G2/M期从而抑制癌细胞增殖。
Thorne等[44]发现用100 nmol/L VD 处理人类前列腺癌细胞P69SV40T 24小时后,发现细胞生长周期阻滞于S期。研究在微小染色体维持蛋白(MCM7)启动子区存在VDRE,随后VD通过结合VDR共同作用于VDRE从而上调 MCM7基因的表达,而miR-106位于MCM7基因内含子中,故VD通过上调MCM7从而促进miR-106的表达。随后发现细胞周期蛋白依赖性激酶抑制剂p21是miR-106的靶基因,miR-106可特异性降解p21,从而阻碍细胞生长。综上,在P69SV40T细胞中,VD 通过与VDR结合后共同作用于MCM7基因启动子区VDRE,从而上调MCM7基因的表达,以此促进miR-106的表达,抑制其靶基因p21,从而发挥抑制癌细胞增值的功能。
3.4 胃癌
Chang等[45]发现在胃癌细胞SGC-7901、AGS中,VD通过上调miR-145的表达抑制转录调节因子E2F3和细胞周期素依赖性激酶6的表达使细胞周期停滞于S/G2期,进而抑制细胞增殖。染色质免疫共沉淀实验证实VD与VDR作用后结合在miR-145基因上游调节区的VDRE, 并募集共激活因子,增强miR-145表达水平,呈现VD/VDR计量依赖性上调。随后进一步通过荧光素酶实验证实miR-145作用于E2F3和CDK6的mRNA 3′UTR,降解其mRNA而降低表达水平。此外,与正常胃细胞相比,胃癌细胞内miR-145表达水平较低,表明miR-145是一种潜在的胃癌抑制子。综上,在胃癌细胞中,VD的抗癌作用主要是通过上调miR-145的表达,特异性降低E2F3和CDK6表达水平,从而抑制癌细胞增殖。
3.5 乳腺癌
乳腺癌作为肿瘤中控制水平最高的癌症之一,其发生与发展符合慢性疾病特征。在其发生过程中,肿瘤易感的乳腺细胞,通过特殊的表观遗传学通路,引发肿瘤祖细胞的形成,成为乳腺癌发生的始动因素,该过程不仅涉及众多原癌基因和抑制基因,还涉及肿瘤微环境microRNA的改变。RORIO率先发现miR125-b是浸润性乳腺癌细胞中常见的表达失调microRNA之一[46],其在人与线虫细胞中均有表达,且高度保守。研究表明miR125-b存在两个前体miR125-b-1和miR125-b-2,分别由染色体11q24.1和21q21.1转录而来。乳腺癌中VDR高表达亦可改善预后甚至降低死亡风险。但此观点存在争议,有学者发现VDR在一些肿瘤细胞内亦高表达,并认为VDR高表达是促进癌细胞增殖的因素之一。有文献报道在乳腺癌或者甲状腺癌中VDR表达水平呈上升趋势。在乳腺癌细胞MCF-7中,miR125-b表达下调并靶向调节的VDR表达水平上升[47],以此诱导癌细胞的发生与发展。这种矛盾的结果可能与肿瘤类型和microRNA靶点复杂多变有关,从而双向调控肿瘤细胞增殖,最终发挥何种作用取决于综合效应,而肿瘤类型与细胞表型决定了净效应的产生。事实上,miR-125b的表达与人类乳腺癌细胞MCF-7关系并未完全阐明清晰,需进一步细致深入研究。
此外Min等[48]研究发现,在乳腺癌细胞MCF-7与MDA-MB-231中,VD可增强癌细胞对自然杀伤细胞的敏感性,从而发挥抑制癌细胞增殖的功能。NKG2D是免疫系统中重要的激活性受体,它通过识别靶细胞表面诱导产生的配体来传递活化信号并激活免疫系统,从而对靶细胞发挥杀伤作用。研究发现在乳腺癌细胞表面存在NKG2D的配体MICA/B与ULBPs。利用microRNA测序发现,MCF-7与MDA-MB-231经VD处理后,miR-302c和miR-520c显著下调,双荧光素酶实验发现miR-302c与miR-520c通过与MICA/B和 ULBP2的mRNA3′UTR端结合从而负向调控基因表达。随后超表达MICA/B和ULBP2基因后,自然杀伤细胞对MCF-7与MDA-MB-231的杀伤作用显著增强。综上, VD 通过抑制miR-302c和miR-520c的表达而正向调控MICA/B、ULBPs,激活肿瘤细胞对自然杀伤细胞的敏感性,以此发挥抗肿瘤作用。
3.6 肺癌
has-let-7a microRNA是一种肿瘤抑制子,通过靶向抑制胰岛素受体底物1(IRS1),BCL2及致癌基因RAS的表达,发挥抗肿瘤细胞增殖的功能[49]。在人类肺癌细胞A549中,VD通过增强has-let-7a的表达而抑制细胞增殖。荧光素酶报告系统和染色质免疫共沉淀实验结果证明,VD与VDR复合物结合于let-7a-2基因上游调节区的VDRE,促进let-7a-2的表达。综上,VD /VDR直接作用let-7a-2基因启动子,正向调控let-7a-2表达,随后靶向抑制IRS1、BCL2和RAS基因的表达从而抑制肿瘤细胞增值。
3.7 结直肠癌
流行病学显示人体内低水平VD可能提高患癌症的风险,临床研究已证实VD的抗癌作用可应用于多种癌症[10]。对于人类结肠癌,临床研究证实血清中VD浓度大于82 ng/mL可降低50%患癌风险。Padi等[50]用VD处理结直肠癌细胞 (HT-29、HCT-116) 24小时后miR-627表达水平显著上升。miR-627位于人类第15号染色体,VDR-RXR二聚体与VD结合形成复合物共同作用于miR-627启动子区域,调节miR-627的表达上调,miR-627靶向抑制组蛋白去甲基化酶JMJD1A活性[51]。所以,在结直肠癌细胞中VD的抗癌作用主要通过上调miR-627,抑制JMJD1A活性相关信号通路实现。
3.8 白血病
Wang等[52]发现,VD介导的microRNA表达可阻止白血病细胞增殖。用VD处理HL-60,NB4和U937细胞,miR-26a表达上调,C-myc基因表达下调,从而抑制细胞增值。低浓度VD处理早幼粒白血病细胞HL-60和U937后,miR-181a表达水平显著下降,P27表达水平上调,使细胞周期停滞于G1/S期[53-54]。此外,miR-26a也可直接靶向E2F7转录抑制子,促进P27蛋白表达上调,导致细胞停滞于G1/S期。因此, VD通过下调miR-181a或上调miR-26a表达抑制肿瘤细胞增殖。
此外Gocek等[55]用VD处理HL-60和U937后发现miR-32表达上调,促凋亡基因BIM在转录水平受到抑制。干扰Drosha和Dicer基因后,VD诱导的miR-32表达上调消失,而超表达miR-32可导致BIM基因表达下调,细胞存活数目显著增多,BIM可能是miR-32的靶基因。因此,miR-32作为治疗人类骨髓样白血病的潜在靶基因,开发靶向抑制miR-32的药物为白血病治疗提供新方案。
Min等[48]研究表明VD处理人类急性白血病细胞 (Kasumi) 和K-562细胞24小时后,可增强该细胞对自然杀伤细胞(NK92)的敏感性。不同浓度VD处理细胞后,miR-302C和miR-520c在Kasumi和NK92中表达下调,进一步研究表明miR-302C和miR-520c通过直接靶向结合并降解MICA、MICB和ULBP2 mRNA3′UTR,负向调节NKG2D配体通路。所以,在白血病细胞Kasumi和K-562中,VD通过下调miR-302C和miR-520c,特异性降低MICA、MICB和ULBP2表达水平,从而实现抑制肿瘤细胞增殖的目的。
4 结语与展望
研究表明活性VD及其受体VDR在抗癌过程中发挥越来越重要的作用,因此进一步深入理解VD/VDR的抗癌作用机制,解析VD与肿瘤发生的关系对肿瘤预防与治疗至关重要[10,56]。活性VD在不同类型肿瘤细胞中通过调节microRNA表达而发挥抗癌作用,同时microRNA亦可调控VD及其受体的信号通路,表现出特异生物学现象。若使用活性VD 作为治疗肿瘤的药物,其潜在问题是无法准确控制发挥理想生物学效应的剂量,以及可能出现的毒副作用。因此,现阶段研究结果表明,利用VD作为抗癌药物还为时尚早。在细胞水平的研究中,很容易控制VD的摄入量,易于检测特殊microRNA表达水平的改变。然而,在人体中并非如此,因为不同饮食成分会发生协同或对立的作用,这增大了研究VD在人体作用机制的难度。因此,应该深入了解活性VD介导microRNA调控癌细胞增殖或侵袭的分子机制,为后续开发VD及其衍生物作为新型抗癌药物提供理论支撑。
