CYP2C9-1075 A/C和VKORC1-1639 G/A基因多态性对心房颤动射频消融术后患者抗凝治疗和临床结局的影响
2021-01-15王吴婉范静波高鹏方全陈连凤林雪方理刚
王吴婉 范静波 高鹏 方全 陈连凤 林雪 方理刚
100730 中国医学科学院 北京协和医学院 北京协和医院心内科
心房颤动(简称“房颤”)是临床常见的心律失常,可引起多种心血管、神经系统的不良事件。射频消融术可减少房颤复发并缓解症状[1],但术后患者血栓栓塞风险增加[2],使得术后抗凝治疗至关重要,尤其是CHA2DS2-VASc≥2分的患者应长期抗凝[3]。尽管因剂量固定、无须持续监测抗凝指标等优点,目前指南优先推荐新型口服抗凝药,不过出于药物经济学考虑我国大部分地区患者仍选择华法林抗凝[4-5],但同时其维持剂量受多种遗传和临床因素的影响。既往研究在基因多态性对华法林抗凝和出血事件影响结果中存在争议[6-7]。本研究旨在探讨细胞色素P450亚家族ⅡC多肽9(CYP2C9-1075)和维生素K环氧化物还原酶复合体1(VKORC1-1639)基因多态性对房颤患者射频消融术后华法林抗凝和相关临床事件的影响。
1 对象和方法
1.1 研究对象
本研究为前瞻性队列研究。选取2011年10月至2016年2月于北京协和医院心血管内科行射频消融术的房颤患者为研究对象。入选标准:(1)年龄18周岁以上,确诊为房颤(心电图)并行射频消融术;(2)治疗期间避免服用影响华法林的药物和食物,配合临床随访观察。排除标准:(1)存在服用华法林禁忌者;(2)近期有外科手术或出血现象者;(3)需长期服用影响华法林体内代谢和药效的药物者;(4)配合度欠佳者。本研究已通过医院伦理委员会审核标准(伦理批件号:B051),并取得所有受试对象知情同意。
1.2 研究方法
记录入选患者基线资料,包括年龄、性别、体质指数、房颤类型、血压、心率、超声心动图检测指标、血栓和出血风险评分、既往史、既往服用药物史,并根据CYP2C9-1075 A/C和VKORC1-1639 G/A基因多态性检测结果将其分为突变组和非突变组(AC基因型和AA基因型;GG+GA基因型和AA基因型)。
入组时间为患者行射频消融术后第1天,根据患者血栓风险、出血风险评分等情况及患者意愿选择抗凝方案,患者出院后于心律失常门诊进行规范化管理,每隔3~6个月随访1次,随访内容包括患者的病史信息、华法林维持剂量、国际标准化比值(international normalized ratio,INR)达标情况(INR值为2~3时为达标),以及随访过程中的出血、血栓等相关临床事件。随访主要终点为患者的生存率、房颤复发率;次要终点为出血、栓塞等不良反应。
出血事件分为严重出血事件(致命性出血,需要住院输血200 ml以上或颅内出血、脊髓腔出血等)和轻微出血事件(皮肤黏膜出血、牙龈出血、血尿等,非危及生命的出血事件);血栓事件包括缺血性脑卒中(脑动脉栓塞)和外周血栓栓塞(肠系膜动脉、肾小动脉、脾动脉栓塞等)[8]。
1.3 统计学方法
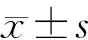
2 结果
2.1 入组患者的基本特征和基因突变率
本研究共纳入130例患者,年龄23~81岁,平均(61.6±11.3)岁,其中男性83例(63.8%)。入组患者的基线资料如表1所示,选用华法林抗凝的患者用药情况和临床结局如表2所示。本组患者中CYP2C9-1075 A/C基因检测结果显示,AC和AA基因型频率分别为9.2%和90.8%;VKORC1-1639 G/A基因检测结果显示,AA、GA和GG基因型频率分别为80.0%、19.2%和0.8%,且该基因型突变率与年龄、性别无关。
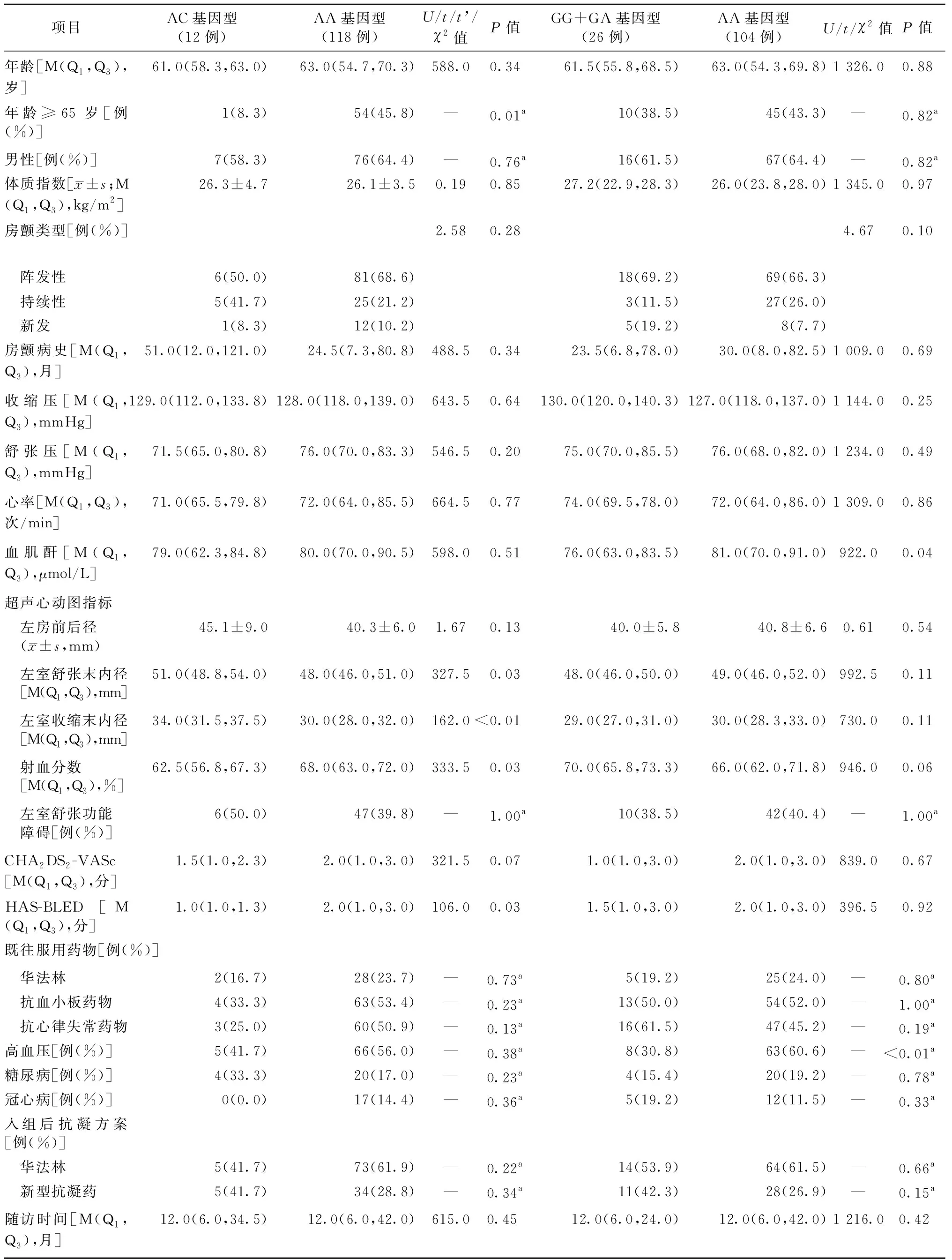
表1 所有入组患者的基线资料
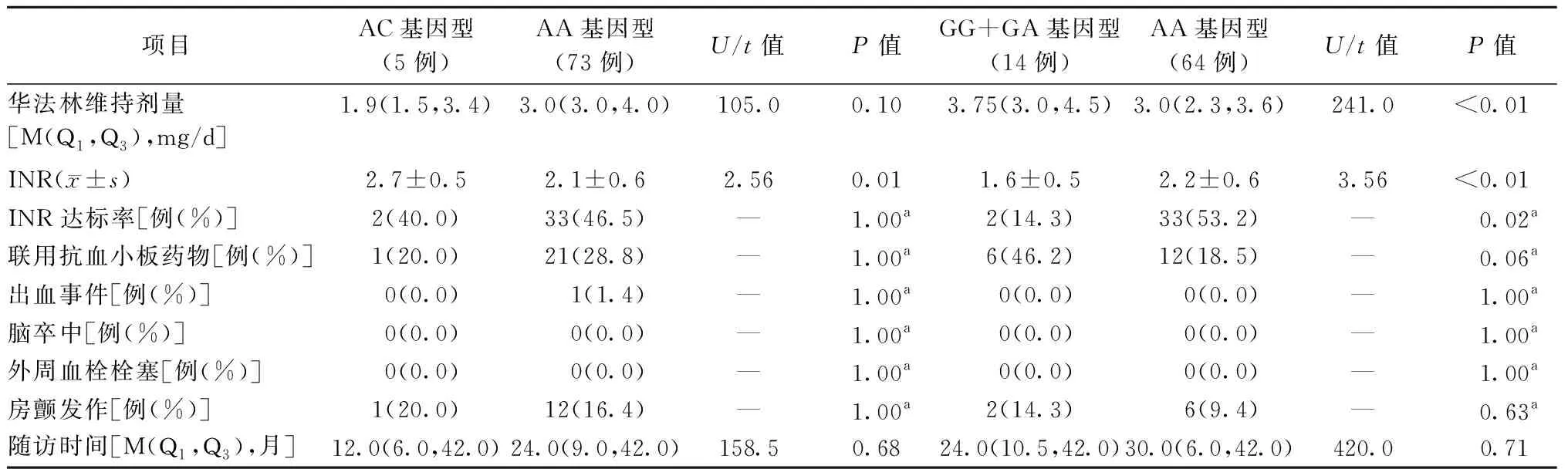
表2 入组后服用华法林患者的服药情况和临床结局
2.2 入组时患者基线和抗凝治疗情况
两种基因型的突变组与非突变组在病史、用药情况、随访时间等基线资料上基本无差异。在射频消融术后使用华法林抗凝的房颤患者中,CYP2C9-1075 A/C基因突变组(AC型)在华法林用药后INR显著高于非突变组(AA型)(2.7±0.5比2.1±0.6,t=2.56,P=0.01),但两组华法林维持剂量和INR达标率均无统计学差异。VKORC1-1639 G/A携带G等位基因组(GG+GA型)的华法林维持剂量高于非携带G等位基因组(AA型)[3.75(3.0,4.5) mg/d比3.0(2.3,3.6) mg/d,U=241.0,P<0.01];前者使用华法林抗凝后INR显著低于后者(1.6±0.5比2.2±0.6,t=3.56,P<0.01),两组INR达标率也有显著差异。
2.3 随访情况
本研究整体随访时间3~54个月,中位随访时间12个月,其中26人失访。随访过程中,仅有1例患者服用华法林后出现隐匿性出血事件(表2),尽管在不同基因突变患者中存在药物剂量等差别,但两种基因型突变在随访过程中的出血事件、脑卒中、外周血栓栓塞和房颤复发等临床事件上并无统计学差异。
3 讨论
本研究结果表明,CYP2C9-1075 A/C基因突变组(AC型)患者使用华法林后INR显著高于非突变组(AA型),但两组华法林维持剂量和INR达标率无明显差异;VKORC1-1639 G/A携带G等位基因组的华法林维持剂量显著高于非携带G等位基因组,两组INR和INR达标率也有显著差异。两种基因型突变在随访过程中的出血、血栓等临床事件并无差别。
华法林是目前房颤抗凝的常用药物,其治疗窗窄、种族差异大[9],受多种因素的影响,其中非基因因素包括年龄、性别、体质指数、疾病状态及合并用药情况等,基因因素主要包括影响华法林剂量需求的VKORC1和CYP2C9基因[10],其突变率不断增加[11]。既往研究发现,中国汉族人群以CYP2C9*3突变为主[12];本研究中,我们检测到CYP2C9-1075 A/C主要以野生纯合型(AA型)为主(90.8%),与文献报道一致[13]。华法林为VKORC1特异性抑制剂,VKORC1在其启动子区存在1639 G/A位点多态性,且与华法林剂量的个体差异有密切关系。在中国人群中,VKORC1主要以1639 AA纯合型为主,既往研究显示亚洲人群VKORC1-1639 AA、GA和GG基因型频率分别为80.4%、18.3%和1.3%;本研究中VKORC1-1639 G/A基因结果显示,AA、GA和GG基因型频率分别为80.0%、19.2%和0.8%,与文献报道相似[9]。
既往有关华法林基因多态性指导临床用药及对临床不良结局影响的研究仍较少。CYP2C9*3突变可导致患者对华法林的需求剂量较低[13],然而也有研究并未发现两者有相关性[14],这一点与本研究结果一致。尽管两组在华法林剂量上无差别,但我们观察到两组INR存在显著差异,可能与该基因突变对代谢酶结构的改变导致华法林的代谢能力减弱有关。此外,我们检测到了在VKORC1-1639 G/A携带G等位基因组中华法林维持剂量更高,其机制是G基因的VKORC1启动子活性比A基因的启动子活性高,引起VKORC活性增高,因此需要较高剂量的华法林才能达到抗凝效果。既往有研究发现VKORC1突变对华法林维持剂量有显著影响[13],Poopak等[15]还发现VCORC1突变与华法林敏感性和并发症有相当大的相关性。国际指南中对于华法林抗凝治疗达标的INR控制范围在2~3[2],但本研究结果显示INR总体达标率并不理想,可能是由于携带G等位基因组中华法林维持剂量较高,且更多患者使用抗血小板药(尽管未达统计学意义),门诊医生通常较保守,未轻易提高华法林剂量,使患者INR数值处于低水平1.6左右,后期随访结果也提示患者临床出血事件未增加。
既往研究发现,CYP2C9*3基因突变患者易出现出血等并发症,VKORC1-1639携带等位基因A的患者更容易获得理想的INR,并降低出血率[14,16]。一项中国的回顾性研究报道了VKORC1-1639 AA型患者的出血发生率及过度抗凝(INR>4)比例高于G等位基因携带者[17]。而本研究发现,两种基因型突变在随访过程中的出血、血栓和房颤复发等临床事件上并无统计学差异,这一发现与部分既往研究结果一致[18],这可能与前面提到的随访过程中INR维持在偏低水平避免了严重出血有关。
本研究存在一定的局限性。一方面,随访过程中存在部分缺失数据及失访,且通过患者主诉评定出血事件易被低估,从而产生偏倚;另一方面,本研究患者样本量相对较小,同时缺乏健康人群对照组,给研究结果造成一定影响。
综上所述,华法林基因多态性对于房颤射频消融术后患者的临床个体化抗凝方案有一定指导意义,但在临床结局中未检出差异,本研究结论尚需更多大样本、长期随访的随机对照试验来验证。
利益冲突:无
