超声引导下经皮非接触式联合接触式射频消融治疗肝包膜下小肝细胞癌
2021-01-15
上海中医药大学附属曙光医院超声医学科,上海 201203
目前,原发性肝癌是中国第4位常见恶性肿瘤,第2位肿瘤致死病因,严重威胁人们的生命和健康[1-2]。以往外科手术切除和肝移植术是肝癌患者获得长期生存的重要手段,随着肝癌治疗领域的迅速发展,以及临床多方法、多学科合作治疗理念的提出,局部消融术越来越广泛地运用于肝癌的治疗。射频消融术可以有效地对肿瘤组织进行灭活,具有高效、便捷、实时、创伤小、恢复快等优点,使部分不适合手术切除的肝癌患者也可以获得根治机会,从而改善生存质量,且其有效性及安全性也已经过大量临床研究得以证实[3-5]。但对肝包膜下肝癌行局部消融治疗,存在直接穿刺肿瘤导致出血和潜在的肿瘤肝外播散的风险,同时还容易造成肿瘤消融不完全和消融灶周边复发,因此此类病灶被认为是经皮局部消融治疗的相对禁忌证[6]。本文主要观察分析非接触式联合接触式射频消融治疗肝包膜下小肝癌的临床疗效和安全性,旨在探讨其有效性和可行性。
1 资料和方法
1.1 临床资料
回顾并分析2015年1月—2019年1月在上海中医药大学附属曙光医院超声医学科接受治疗的32例肝癌患者的临床资料。入组标准:① 经临床或病理学检查证实为肝细胞癌。② 经超声或其他影像学检查明确肝癌病灶位于肝包膜下(癌灶与肝包膜最小距离<0.5 cm)。③ 单个肿瘤最大直径≤3 cm;或肿瘤结节不超过2个,最大直径总和≤3 cm,无血管、胆管和邻近器官侵犯以及远处转移。④ 肝功能Child-Pugh A或B级。排除标准:① 术前接受过放疗、化疗、靶向治疗或免疫治疗者;② 合并其他恶性肿瘤者;③ 存在心、肺等重要脏器功能障碍者;④ 局部热消融术后未按时行增强CT/磁共振成像(magnetic resonance imaging,MRI)检查和随访的患者。本组32例患者,男性24例,女性8例。年龄36~82岁,平均年龄(58.0±10.1)岁。其中7例有2个病灶,共39个病灶。肿瘤最大径0.80~2.95 cm,平均直径(1.84±0.53)cm。肝功能Child-Pugh A级29例,B级3例。本研究获得医院伦理委员会批准,患者均已签署知情同意书,本研究操作符合医学伦理学规定。
1.2 仪器
采用意大利Esaote公司的Mylab Twice、Esaote classic彩色多普勒超声诊断仪,凸阵探头频率为1~8 MHz。采用韩国STARmed公司的VIVA RF Generator射频消融治疗系统,型号VRS01,频率为480 kHz,使用15 G可调裸露端射频消融针,裸露端长度为3.0~3.5 cm,带冷循环系统并内置测温,可监测温度、阻抗,输出功率设为最大(200 W),每针消融时间12 min。
1.3 治疗方法
所有患者术前行肝脏常规超声及超声造影检查,另行肝脏增强MRI或增强CT检查,术前完善血常规、肝肾功能、凝血功能、相关肿瘤标志物检测、心电图、胸片等检查。术前根据病灶具体位置,选择合适体位,确定穿刺点和进针路径。所有患者采用喉罩或气管插管全身麻醉,在超声引导下行经皮经肝射频消融术,射频功率设定为200 W。对于存在明确供瘤血管的病灶先经正常肝组织穿刺至供瘤血管进行消融阻断,再进行肝肿瘤消融。行肿瘤消融时,消融针先穿刺至距病灶深部边缘约0.5 cm处正常肝组织内,且消融针针尖超过肿瘤远端边缘约0.5 cm,进行消融,然后下一针穿刺方向与前一针平行,且穿刺经过前一次消融坏死区的浅面,照此布针方式进行消融,直至达到全肿瘤消融。术中采用实时超声造影即刻评估消融疗效,以及判断有无出血等并发症,如发现病灶残留则即刻行补充消融,如发现活动性出血则对出血点进行消融止血。如病灶邻近肺脏,采用人工胸腔积液以保护肺脏和提高病灶显示清晰度。病灶邻近胃肠道或胆囊,采用人工腹腔积液以保护胃肠道和胆囊。术后患者卧床休息24 h,给予补液、保肝、药物止血等对症处理。
1.4 观察指标及随访
对比分析32例患者术前、术后的肝功能以及相关肿瘤指标情况。所有患者消融术后3 d内行超声检查以评估手术并发症情况,术后1个月行超声造影、肝脏增强MRI或增强CT检查以评估消融效果。病灶区域经动态增强CT或MRI扫描,或者是超声造影检查:如消融灶动脉期未见强化,为消融完全;肿瘤消融病灶内动脉期局部如有强化,为消融不完全。术后每2~3个月复查,评估消融效果,观察有无并发症的发生、以及有无复发等情况。
2 结 果
32例患者,共39个病灶,均成功行超声引导下射频消融术(图1),术中采用人工胸腔积液3例,人工腹腔积液18例,人工胸、腹腔积液2例,无辅助手段9例。患者随访时间为12~48个月。术后并发肝脓肿伴胆汁瘤1例,发热6例,其中2例体温>38 ℃。术中及术后未出现膈肌损伤、胃肠道损伤穿孔、胆囊损伤、腹壁和皮肤烫伤、消化道出血、腹腔内出血、腹膜炎及肝功能衰竭等严重并发症。
所有患者术后1个月均行肝脏的超声造影检查及增强MRI或增强CT检查,39个病灶均完全灭活,未发现病灶残留,完全消融率为100%,1年生存率100%,2年生存率97%,1年局部复发率3%,2年局部复发率6%。随访过程中4例患者出现肝内其他段肿瘤复发,但未发现肝周及腹腔肿瘤种植转移。
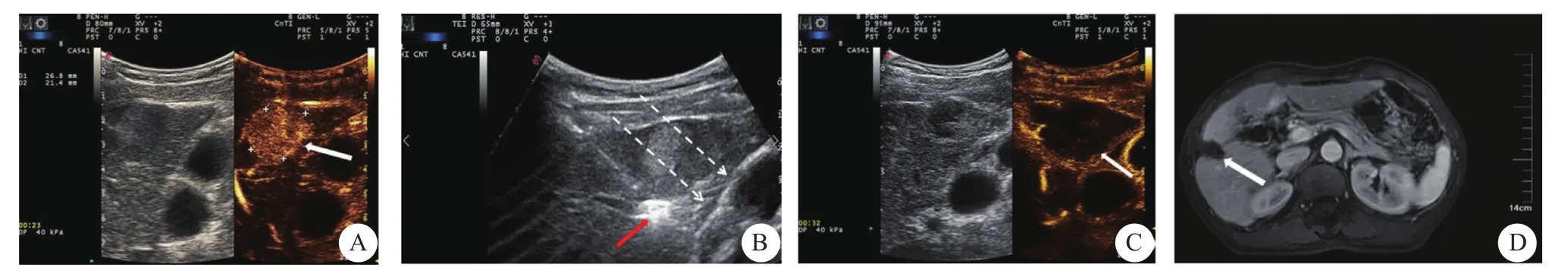
图1 肝包膜下小肝癌患者行经皮非接触式联合接触式射频消融治疗过程影像
3 讨 论
肝细胞肝癌(hepatocellular carcinoma,HCC)与乙型肝炎病毒感染及肝硬化直接相关,全球每年约有88.7万人死于乙型肝炎病毒感染相关疾病,HCC占45%[7],严重威胁人类的生命和健康。近年来,随着中国卫生健康事业的发展及医学影像学诊断技术水平提高,肝癌的诊断比例逐年增高,肝癌的预防及治疗成为全球公共卫生热点。目前肝癌治疗有多种方法,合理的治疗方案的选择至关重要。影响肝癌患者的预后因素较多,包括肿瘤因素、患者一般情况及肝功能等情况。对于HCC的诊疗,必须重视多学科诊疗团队模式。
随着微创治疗技术的进步与发展,射频消融成为中国肝癌的主要治疗方法之一,在临床得到较广泛的应用[8]。射频消融适用于肝功能Child A或B级的小肝癌,具有创伤小、疗效确切、可重复性好,以及可以保存较多的正常肝组织等特点,使一些不能耐受手术或不愿意接受手术治疗的患者获得根治机会。然而,对于包膜下的肝癌热消融治疗,因在各个方向获得足够长度的消融边缘是困难的,其效果和安全性如何仍存在较多争议[9-12]。国内外肝癌治疗指南[13-15]认为,肝包膜下或外凸型肝癌的热消融治疗存在较高的并发症和出血、肿瘤肝外播散等风险。据文献[16]报道,包膜下肝癌患者局部热消融术中针道种植转移的发生率高达12.5%,因此射频消融通常不是包膜下肿瘤的首选治疗方法。研究[17]表明,冷冻消融术适合治疗高危风险位置的肝癌,对于直径小于3.5 cm肝癌具有较好的安全性和有效性。但冷冻消融可导致肝细胞膜破坏以及激活机体炎症反应,使肝功能受损,其对肝功能的远期影响需要进一步研究[18]。冷冻消融使肿瘤细胞膜破裂,细胞死亡,坏死的肿瘤细胞吸收后形成大量肿瘤特异性抗原,可激活机体产生抗肿瘤免疫作用,但也可能引发机体免疫抑制,影响预后。冷冻消融对机体抗肿瘤免疫影响的具体机制,尚需进一步研究[19]。
有研究[20]认为,对于肝包膜下肿瘤,消融针从肿瘤周围正常组织进针,对肿瘤深部进行消融,并行充分的针道消融,可以达到非包膜下肿瘤治疗相似效果。本研究采用先“非接触”消融治疗,先从肿瘤旁正常肝组织开始消融,使肿瘤边缘局部先灭活,第一针消融区不能完全达到全肿瘤灭活的范围,需要行再一次消融,下一次消融是将消融针置入被消融坏死的肿瘤区内,行接触式消融,其优点在于通过“非接触”消融,使得肿瘤部分区域先坏死,避免后一针穿刺直接接触存活肿瘤组织,从而减少穿刺过程中肿瘤出血以及针道种植转移的可能。其不足之处在于由于原本选取的病灶较小,第一针消融后可能导致病灶在常规超声上的图像显示变得模糊不清,增加了后一针穿刺进针精准性的难度;其次,消融手术时间有所延长。术中即时超声造影可有效地提示肿瘤位置及判断非接触式消融的区域和范围及效果。
本组32例患者术中及术后穿刺部位未发生活动性出血,未发生气胸、种植转移等严重并发症。1例患者术后第14天出现肝脓肿,穿刺抽脓后,形成胆汁瘤,其可能原因是其旁有肝内胆管受肿瘤压迫,伴肿瘤旁的远端肝内胆管增粗、扩张,以致消融区域并发感染、化脓,抽脓液后局部形成胆汁瘤,留置引流管,同时受压段肝内胆管放置支架,非完全性梗阻改善后,胆汁瘤逐渐缩小至消失。6例发热患者中2例体温>38℃者考虑为合并感染,其余4例低热考虑为消融后改变,经对症处理后,均得以改善。本研究中,射频消融对肝包膜下小肝癌的完全消融率为100%(39/39),疗效确切。
本研究表明邻近肝包膜下的小肝癌,可在人工辅助技术协助下实施超声引导下经皮非接触式联合接触式射频消融,可以达到有效、安全的治疗目的,值得进一步研究及运用。
