流水对克氏原螯虾分布、生长、摄食和几种免疫相关酶活性的影响
2021-01-15濮雪寅孟祥龙王彭越黄成
濮雪寅,孟祥龙,王彭越,黄成
(1.南京大学生命科学学院,江苏 南京 210023;2.江苏省淡水水产研究所,江苏 南京 210017)
克氏原螯虾Procambarus clarkii 原产于北美洲,现已广布我国各地,成为一种重要的淡水养殖对象。生物和非生物(如阳光、温度和水等)生态因子显著影响克氏原螯虾的行为、生长和发育。邓慧芳[1]研究了不同光照条件对克氏原螯虾生长发育的影响;Suzanne 等[2]研究了5 种温度下螯虾的摄食及营养吸收的差异;李庭古[3]发现,盐度为0~6 时,螯虾成活率较高,生长较快,饵料系数较低。但目前有关水流对克氏原螯虾行为和生长发育的影响却罕见报道。戴习林等[4]研究发现,静水环境不利于凡纳滨对虾Litopenaeus vannamei 的增长、增重和存活,水平水流促进了对虾生长和存活。王茂林等[5]研究发现,水流刺激影响三疣梭子蟹Portunus trituberculatus 幼蟹的运动行为和代谢。本试验通过研究静水和流水对克氏原螯虾生长、摄食以及几种免疫相关酶活性的影响,试图探究这两种环境下克氏原螯虾的分布规律,以丰富克氏原螯虾行为学内容。
1 材料与方法
1.1 材料
本试验用240 尾克氏原螯虾,平均体质量(22.44±4.41)g,平均体长(7.9±0.5)cm,来自江苏省淡水水产研究所。试验用水引自河道排灌水,水温28.3℃,pH7.6,溶解氧含量为6.4 mg/L,饲料为虾蟹配合饲料,产品编号Q31/0117000178C001-2015。试验用水泵功率20 W,扬程1.2 m,流量1200 L/H。试验池为2 m×2 m 的正方形水泥池(图1),池深约1.3 m,平均水深18 cm,坡度4%。池正中用240 mm×115 mm×53 mm 的标准砖块围成约1.44 m×1.44 m 的正方形区域(I-Inside 区),外围则为O 区(O-Outside 区),角落处留出足够螯虾自由进出的空隙。
1.2 方法
本试验于2018 年8 月13 日—9 月5 日在江苏省淡水水产研究所扬中基地进行,共计24 d。试验池分为两组:试验组在水泥池对角位置各放置一台潜水泵,形成顺时针流水(F 组),对照组为静水(S组)。每组6 个水泥池,3 个池为雌虾,3 个池为雄虾,每池20 尾螯虾。水泥池中的O 区和I 区各放置一个直径110 mm、高15 mm 的圆形饵料台。每个饵料台中投放10 g 饲料,每2 d 的下午2 点收集饵料台中的残饵,重新投放饵料。将残饵统一放置阴凉通风处晾干24 h 后称重。每天8:30、12:30、14:30 和20:30 采用点取样法(point sampling)观察记录每个水泥池内螯虾的分布情况。

图1 试验用水泥池示意图Fig.1 Schematic diagram of a cement pond during the experiment
1.3 数据处理
各组克氏原螯虾的分布情况用分布概率差(DDR)表示,计算公式如下:
内外分布率差(%)=(Ni-No)/(Ni-No)×100,
其中,Ni为I 区内螯虾的数量,No为O 区内螯虾的数量。
相对体质量增长率(%)=[Wt-W0]/W0×100,
相对体长生长率(%)=[Lt-L0]/L0×100,
肥满度(%)=W/L3,
其中,W 为螯虾体质量,L 为螯虾体长,Wt为螯虾初始体质量,W0为螯虾末体质量,单位均为g;Lt为螯虾初始体长,L0为螯虾末体长,单位均为cm。
摄食量(g)=20-20×[(Wc-Ww)/Wc],
其中Wc为对照组饵料台中剩余饵料重量,Ww为试验组饵料台中剩余饵料重量,单位均为g。
试验结束时,将螯虾送至南京建成生物工程研究所检测:肝胰腺和血清中的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性及丙二醛含量(MDA);肠道中胰蛋白酶(Trypsin)、脂肪酶(LPS)和淀粉酶(AMS)活性。
使用SPSS24.0 统计软件对数据进行方差分析和多重比较。其中内外分布概率差组内检验采用配对T 检验分析显著性,组间检验采用独立样本T 检验进行显著性分析;其余数据则均用独立样本T 检验分析显著性。显著水平为0.05,极显著水平为0.01。
2 结果与分析
2.1 克氏原螯虾的存活率和时空分布
不同时间克氏原螯虾在I 区和O 区的分布率概率差见表1。两组螯虾的存活数和死亡数的2×2列联表的卡方检验结果见表2。
由表1 可知,两组螯虾白天均极显著地选择O区,夜晚均极显著地选择I 区。8:30 和20:30 时两组螯虾组间的分布不同:8:30 时F 组O 区内螯虾分布率显著低于S 组,20:30 时F 组O 区内螯虾分布率极显著低于S 组,即无论早或晚,克氏原螯虾在流水外围空间分布均显著低于对应的静水的外围空间。由表2 可见,F 组螯虾存活率显著小于S 组,即流水显著降低了螯虾的存活率。
2.2 克氏原螯虾体质量和体长绝对增长、摄食量及饵料系数
由表3 可知,两组克氏原螯虾的体质量和体长绝对增长、摄食量以及饵料系数之间无显著差异(P>0.05),即流水环境对于螯虾的生长没有显著影响。由表4 可知,虽然两组螯虾的平均体质量、平均体长、体质量增加率和体长增长率之间并没有差异,但F 组克氏原螯虾的体质量和体长变异系数均小于S 组,饵料系数显著小于S 组,即流水环境下螯虾的规格更加整齐,同样摄食量下增长的体质量更多。
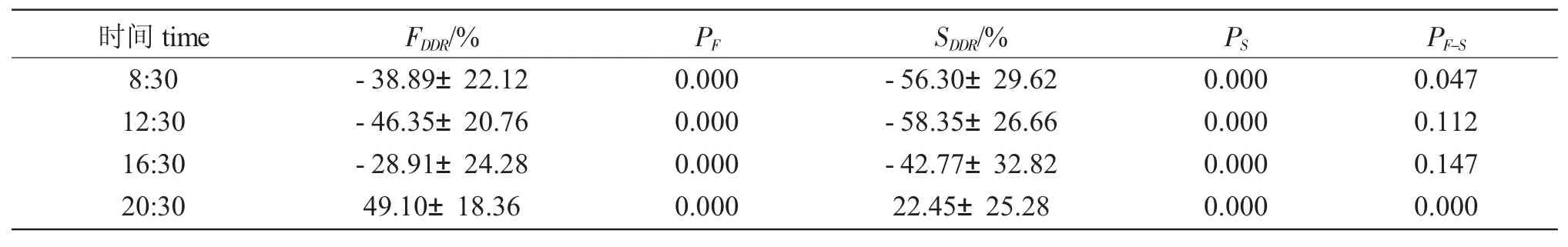
表1 两组克氏原螯虾在不同时间点内外分布率差(DDR)及显著性检验Tab.1 Distribution difference(DDR)and significance test of red swamp crayfish in the two groups at different sampling time

表2 两组克氏原螯虾存活数的2×2 列联表卡方检验结果Tab.2 Chi-square test results of 2 × 2 contingency table for survival of red swamp crayfish Procambarus clarkii in the two groups
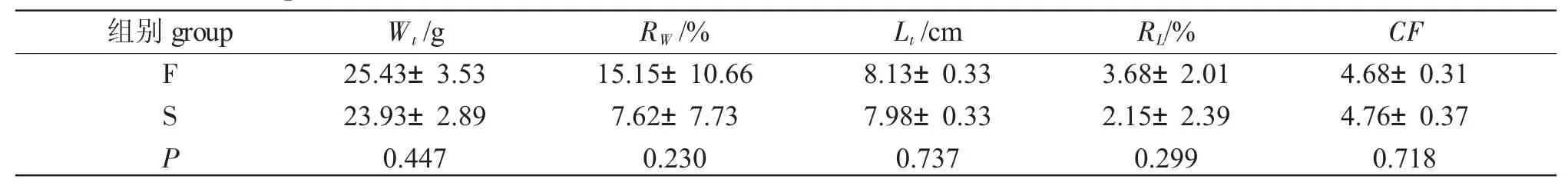
表3 试验末两组克氏原螯虾平均体质量(Wt)、平均体长(Lt)、体质量增加率(RW)、体长增长率(RL)、肥满度()以其及显著性检验Tab.3 Mean body weight(Wt),mean body length(Lt),body weight gain rate(RW),growth rate in body length(RL),and condition factor(CF),and significance test in red swamp crayfish Procambarus clarkii in the two groups at the end of the experiment
2.3 克氏原螯虾生理生化指标
由表5 可知,F 组螯虾肝脏内超氧化物歧化酶的活性显著高于S 组(P<0.05),过氧化氢酶活性极显著高于S 组(P<0.01),F 组螯虾血清内CAT 活性显著高于S 组(P<0.05),丙二醛的含量显著低于S组(P<0.05),即流水环境下螯虾的抗氧化还原能力提高,减少了代谢废物的产生。由表6 可知,F 组螯虾肠道内的脂肪酶活性极显著高于S 组(P<0.01),即流水环境可以提高螯虾体内脂肪酶的活力。
3 讨论
3.1 流水环境对克氏原螯虾分布格局的作用与意义
本试验中,两组螯虾白天均显著分布于O 区,可能与光照有关。水泥池有一定的深度,O 区一直存在阴影。观察发现,不论哪个区域的螯虾都几乎全部处于阴影中,可见光照对螯虾分布的影响作用远大于流水。克氏原螯虾有趋触习性。Lamprea 等[6]研究发现,大小螯虾均选择阴影加上趋触信号。黄成等[7]的研究同样发现,阴影可减少克氏原螯虾之间的损伤,体质量增长速度加快。而早晚时刻(8:30和20:30)弱光或无光,此时流水的影响开始体现,克氏原螯虾在流水的影响下趋于静水区域,这与谢文星等[8]的研究发现克氏原螯虾具有趋水性结果相反,可能是本试验中的流水为顺时针的循环流水,与自然界中的单向流水不同,水中所包含的化学信号的丰富度也有差别所导致。
螯虾之间互相识别的机制包括视觉信号、触觉信号、化学信号。Francesca 等[9]研究表明:美洲螯龙虾Homarus americanus 通过视觉识别同类,认出相对熟悉的同类。Zulandt 等[10]试验发现:尿液是克氏原螯虾之间传递信息的一种重要的化学信号。水作为一种环境因子,不仅直接影响克氏原螯虾的行为和生长发育,还通过流动形式改变水中化学信号的分布,影响克氏原螯虾之间的社会行为。F 组螯虾存活率显著低于S 组,有可能是水流冲击应激,亦有可能是流水改变了克氏原螯虾用于标记领域而释放的尿液分布,使O 区长期处于混乱无秩序的状态,从而在早晚无光和弱光时间内流水组螯虾在I区的密度大于静水组,间接压缩了螯虾的生存空间,增加了竞争强度,导致存活率下降。

表4 两组克氏原螯虾平均总摄食量(AFC)、体质量增加量(△W)、体长增长量(△L)、变异系数(CV)以及饵料系数(FC)的显著性检验Tab.4 Total food consumption(AFC),weight gain(△W),body length increase(△L),coefficient of variation(CV)and food conversion ratio(FC)and significance test in red swamp crayfish Procambarus clarkii in the two groups

表5 两组克氏原螯虾肝胰腺(H)和血清(S)的理化指标及显著性检验Tab.5 Analysis and significance test of physical and chemical indices in hepatopancreas and serum of red swamp crayfish Procambarus clarkii in the two groups

表6 两组克氏原螯虾肠道(I)的理化指标及显著性检验Tab.6 Analysis and significance test of physicochemical indicators in intestinal tract(I)of red swamp crayfish Procambarus clarkii in the two groups
3.2 流水环境对克氏原螯虾生长发育的影响
不同环境因素影响克氏原螯虾的生长发育。戴习林等[4]研究表明,水平流速在2.78 mm/s 时,体长1~3 cm 的凡纳滨对虾生长速率和体质量增重率最大。肖鹤鸣等[11]研究发现,随着养殖密度的增大,克氏原螯虾的终末体质量逐渐减少。马太效应是指“强者愈强,弱者愈弱”的现象[12]。本试验中,流水环境对螯虾的生长没有显著影响,但流水组螯虾的变异系数小于静水组,这是因为流水改变了水中固有的领域空间资源分布,使其相对均匀化,避免了马太效应的产生。王陈路等[13]发现,克氏原螯虾也存在领域所有权现象。流水环境下没有明确的领域划分,每只螯虾获得的资源相对均等,增长率也相对均一。综上可知,流水有利于养殖出规格齐整的螯虾;流水组螯虾的饵料系数显著小于静水组,即流水环境下幸存螯虾增长同样的体质量所消耗的饵料更少,经济效益更高。
3.3 流水环境对克氏原螯虾生理生化指标的影响
肝胰腺具有类似于脊椎动物肝脏、胰腺和肠道的许多功能[14]。正常血液指标值能反映物种的属性和正常生理状态[15]。SOD、CAT、MDA 均是用于衡量动物机体内抗氧化功能的代表性指标,其中SOD 作为生物体内清除活性氧反应的第一个抗氧化酶,与水生生物的免疫水平密切相关,对于增强吞噬细胞防御能力和整个机体的免疫功能具有重要作用[16],常被用于环境因子胁迫的潜在指标[17,18]。CAT 能将H2O2转化成水,是动物体内重要的抗氧化酶,能减轻活性氧自由基对机体细胞的氧化损伤[19]。克氏原螯虾组织中脂质过氧化物MDA 含量可以反映机体内脂质过氧化的程度,间接反映出细胞损伤状况和程度[20,21]。本试验中,流水组螯虾的肝胰腺SOD、CAT及血清CAT 活性均显著高于静水组螯虾,且血清MDA 含量也显著低于静水组,意味着流水环境能够淘汰相对较弱的螯虾,增强幸存者的免疫力;肝胰腺的指标也从侧面证明流水环境下幸存螯虾消化能力更强,解释了饵料系数低的原因。
甲壳动物体内碳水化合物含量很少,一般不作为能量物质,主要以脂肪为能源物质[22,23]。流水组螯虾肠道内AMS 和Trypsin 活性与静水组无显著差异,但LPS 活性极显著高于静水组(P<0.01),即流水环境下螯虾能量消耗量高于静水组螯虾,刺激了其脂肪酶活力上升。
本试验仅对两种环境因子做了研究,而未设计不同梯度来研究最适流速,尚需进一步探究。
