鲤食物转化率相关候选基因ffar3 序列与表达分析
2021-01-15张晓峰栾培贤户国
张晓峰,栾培贤,户国
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,黑龙江 哈尔滨 150070)
鲤Cyprinus carpio L.在我国分布最广,养殖量在水产养殖业中占很大的比重[1],是最重要的淡水鱼类之一。近年来,我国开展了大量鲤遗传改良的分子遗传学研究,生长和食物转化率作为鱼类遗传改良的两个主要的生产性能,已取得很多有价值的研究进展[2-7]。
据统计,饲料费用约占总产值的65%~75%[8-10],食物转化率是水产养殖业最重要的经济性状之一,迫切需要改良现有水产养殖种类的食物转化效率,节约饲料费用。食物转化率是复杂的数量性状,受多种因素影响,但遗传基础即基因起决定性作用[11-14]。找到重要经济性状相关的标记或基因,对此进行分子遗传改良,将增强对数量性状的遗传操控能力,使数量性状的优良基因在育种中有目的地聚合或替代,提高育种效率。但水产动物的个体食物转化率性状难于测量,很多水产养殖种都没有开展相关的分子育种工作,仅在鲤中有少量报道[7,15,16]。近年来,本研究团队利用遗传连锁图谱QTL 定位分析和关联分析,获得了食物转化率相关的QTL 和候选基因[17,18],但是,鲤食物转化率候选基因的相关机理研究仍然没有开展。
明确解析鲤摄食和食物转化率的调控机理对其养殖业意义重大,随着高密度遗传连锁图谱的构建和QTL 精细定位,使得候选基因精确定位成为可能。本文利用高密度遗传连锁图谱通过QTL 精细定位获得了食物转化率相关候选基因(Free fatty acids receptor 3,ffar3)。本研究通过鉴定分析该基因的序列和结构,探究鲤ffar3 基因组织特异性表达模式及摄食对该基因mRNA 表达水平的影响,为阐明ffar3基因的作用机理和作用通路,探讨这些基因在鲤摄食调控中的作用,提供客观证据和研究基础,更好地应用于鲤食物转化率和生长性状的选择育种。
1 材料与方法
1.1 实验鱼
实验用健康1 龄鲤,体质量约200 g,采自黑龙江水产研究所呼兰试验站;摄食实验在黑龙江水产研究所实验室进行。将40 尾实验鱼(试验需20 尾)在40 个水族箱中饲养2 周,每天上、下午投喂2次。2 周后,正常投喂后开始采样(投喂后10 min 之内),进食0 h(对照组)、2 h、4 h 和6 h 分别取样5尾,用MS-222 麻醉后,解剖取适量脑、肠、肝脏和肌肉等新鲜组织,迅速投入RNAlater(Qiagen)中,置于-20 ℃冰箱中保存备用。
1.2 鲤总RNA 的提取
采用RNeasy Lipid Tissue Mini Kit 组织提取试剂盒(Qiagen),参照标准流程提取试验样本的RNA。提取后的RNA 经Nanodrop8000 检测RNA 纯度及浓度,1%的琼脂糖凝胶检测其完整性符合质量要求后,置于-80 ℃保存备用。
1.3 基因生物信息学分析
利用核酸序列在线分析工具Expasy(https://web.expasy.org/translate/)预测基因的开放阅读框及氨基酸序列;利用Expasy 在线工具中的ProtParam程序(https://web.expasy.org/protparam/)计算预测蛋白质的理论等电点和分子量信息;利用在线工具SignalP 5.0(http:// www.cbs.dtu.dk/services/SignalP/)预测信号肽序列;利用cluster x1.83 软件进行序列多重比对,分析氨基酸同源性;利用SMART 在线分析软件[19](http://smart.embl.de/smart/)分析蛋白结构和功能。应用MEGA 4.0 软件进行1 000 次bootstraps 值验证,构建系统发育树。用MEGA 4.0[20]中的Neighbor-Joining 法构建,重复10 000 次。
1.4 基因表达的定量分析
1.4.1 第一链cDNA 的合成
用SuperScript III First-Strand Synthesis System for RT-PCR 试剂盒(Invitrogen)合成第一链cDNA,每个反应反转录1 μg 总RNA,按照试剂盒的操作说明进行,合成的cDNA 置于-20 ℃保存备用。
1.4.2 引物设计与合成
根据ffar3 基因的mRNA 序列,利用软件Primer 5.0,综合考虑荧光定量PCR 引物的设计原则,结合鲤全基因组比对分析,设计1 对特异性引物用于定量PCR 扩增,内参基因为鲤β-actin(表1)。引物由金唯智生物科技有限公司合成。
1.4.3 基因组织表达的定量分析方法
首先进行普通PCR 检测,确保PCR 产物条带单一,无引物二聚体,并将引物扩增片段回收、测序,以确保所扩增的目的片段为鲤ffar3 基因,再用荧光定量试剂盒进行PCR 扩增。定量PCR 试剂盒为One Step SYBRPrime ScriptTMRT-PCR Kit II(TaKaRa),按照操作说明步骤,使用ABI 7500 实时荧光定量PCR 仪(ABI)进行Real-Time PCR 反应。反应体系20 μL,包括SYBR Premix Ex Taq TM(2×)10 μL,正向及反向引物(10 μmol/L)各0.4 μL,ROX Reference Dye Ⅱ0.4 mL,模板cDNA 1 μL,用ddH2O补足至20 μL。反应条件为两步法程序:95 ℃预变性10 s;扩增40 个循环,每个循环95 ℃变性5 s、58℃退火34 s。反应结束后,溶解曲线的反应条件为:95 ℃持续15 s,58 ℃持续1 min,95 ℃持续15 s。每个样品重复实验3 次取均值,PCR 反应结束后,使用ABI 7500 荧光定量PCR 仪自带软件包分析溶解曲线,计算△CT 值,以对照样组样品为参照子(calibrator)计算相应的△△CT。最后计算目标基因表达差异相对于内参因子基因表达的倍数[21]。所得数据采用SPSS17.0 软件进行数据统计分析和显著性检验(P<0.05)。
2 结果与分析
2.1 ffar3 基因的cDNA 序列分析和推导的氨基酸序列
鲤ffar3 基因(KTG39201.1;鲤ID:CAFS_CommonC_G_004020,V2.0)位于鲤全基因组装配图谱scaffold290 上,全长序列为3 318 bp,具有一个长度为990 bp 的完整开放式阅读框(457~1 446 bp),编码329 个氨基酸。其N 末端有一个长22 残基的预测信号肽,信号肽序列MAWTVSLSNLVLAVYGF TLITG(1~22 aa)(图1)。预测FFAR3 编码蛋白的分子量约为37.83 kD、理论等电点(PI)为9.10。TMHMMServer v2.0 预测结果显示,该基因含有7 个跨膜螺旋结构区域,分别为TM1(10~32 bp)、TM2(45~67 bp)、TM3(82~104 bp)、TM4(125~147 bp)、TM5(184~206 bp)、TM6(219~241 bp)和TM7(256~278 bp)(图2)。不稳定系数为47.03,提示该蛋白为不稳定蛋白。脂肪系数为101.91,亲水性系数为0.462,预测该蛋白为疏水性蛋白。
2.2 鲤ffar3 基因与其他物种的序列比对与系统进化树分析
利用鲤ffar3 序列在NCBI 中BLAST 获得已知其他物种的ffar3 基因的同源序列,包括人(Homo sapiens,XP_011525160.1)、牛(Bos taurus,XP_015313546.1)、小鼠(Mus musculus,NP_001028488.1)、大鼠(Rattus norvegicus,XP_017444965.1)、鲸(Globicephala melas,XP_030730408.1)、黑猩猩(Pan troglodytes,XP_001159667.1)鸡(Gallus gallus,XP_025002082.1)、猪(Sus scrofa,NP_001302530.1)、非洲爪蟾(Xenopus tropicalis,XP_002938261.3)、江豚(Neophocaena asiaeorientalis,XP_024589790.1)、斑点叉尾(Ictalurus punctatus,XP_017308220.1)、斑马鱼(Danio rerio,XP_017206922.1)、半滑舌鳎(Cynoglossus semilaevis,XP_008321219.1)、牙鲆(Paralichthys olivaceus,XP_019964450.1)、青鳉(Oryzias melastigma,XP_024151711.1)、剑尾鱼(Xiphophorus couchianus,XP_027869468.1)、虹鳟(Oncorhynchus mykiss,XP_021427435.1)和大刺鳅(Mastacembelus armatu,XP_026156454.1)等共18 个基因的蛋白序列。同时下载尼罗罗非鱼(Oreochromis niloticu,XP_019219832.1)ffar2(free fatty acid receptor 2-like)基因作为构建进化树的外类群(outgroup)。
用Cluster W 软件对多物种FFAR3 氨基酸序列的同源性比对结果表明,7 个跨膜螺旋区同源性较高,其他部分序列差异较大。本研究获得的鲤ffar3基因蛋白序列与斑马鱼的序列相似性最高,同源性达94.19%;与人类、小鼠、半滑舌鳎、虹鳟、斑点叉尾、牙鲆、大刺鳅及青鳉等物种相似性差异不大,同源性介于70.37%~78.46%之间;与鲸和江豚相似性最低,分别为65.99%和66.41%。除去四种哺乳动物(人、小鼠、鲸和江豚),其他鱼类之间氨基酸序列的多重比对结果表明,少数几个相似性在80%以上,其他均介于66%~80%之间,物种间相似度相差不大(表2)。

图1 鲤ffar3 基因的DNA 全长序列及氨基酸推导序列Fig.1 The full-length DNA and deduced amino acids of ffar3 in common carp Cyprinus carpio
基于9 种硬骨鱼类、8 种哺乳动物、鸡及非洲爪蟾等19 个ffar3 的氨基酸序列,用罗非鱼ffar2 基因作为外类群(outgroup),使用MEGA 6.0 软件构建ffar3 基因的系统进化树(图3)。由图3 可知,所有硬骨鱼类ffar3 基因与哺乳动物的ffar3 基因分属于系统进化树的2 个分支。硬骨鱼类分支中,不同物种形成两个亚支。鲤ffar3 基因聚在斑马鱼、剑尾鱼、半滑舌鳎和斑点叉尾的ffar3 基因的分支中,而鲤和斑马鱼ffar3 基因亲缘关系最近,聚在一起。牙鲆、青鳉和大刺鳅聚在一起。鸡和非洲爪蟾的ffar3 基因单独呈一支。

图2 ffar3 基因编码蛋白的二级结构Fig.2 Secondary structure of protein deduced by the ffar3 gene
2.3 鲤ffar3 基因的组织表达分析
荧光定量RT-PCR 结果显示,摄食后鲤脑、肠和肌肉中ffar3 基因mRNA 表达水平均有显著变化,而肝脏中变化不显著;鲤摄食2 h 时,该基因在脑中表达量最高,在进食后6 h 时小肠中表达量最高。纵观四种组织,ffar3 基因在肠组织中表达量最高,肌肉和脑次之,而在肝表达量最小。基因表达量差异显著的三种组织在进食后不同时间表达量差异显著。脑组织中,进食2 h 时基因表达量最高,随着时间的推移,4 h 和6 h 基因表达量递减。而肠和肌肉中,进食后2~6 h 基因表达量升高,在6 h 时表达量最高。在肌肉中的情况与肠相似,也是随着进食时间的推移,表达量上升,只是表达量升高的幅度较肠小(图4)。
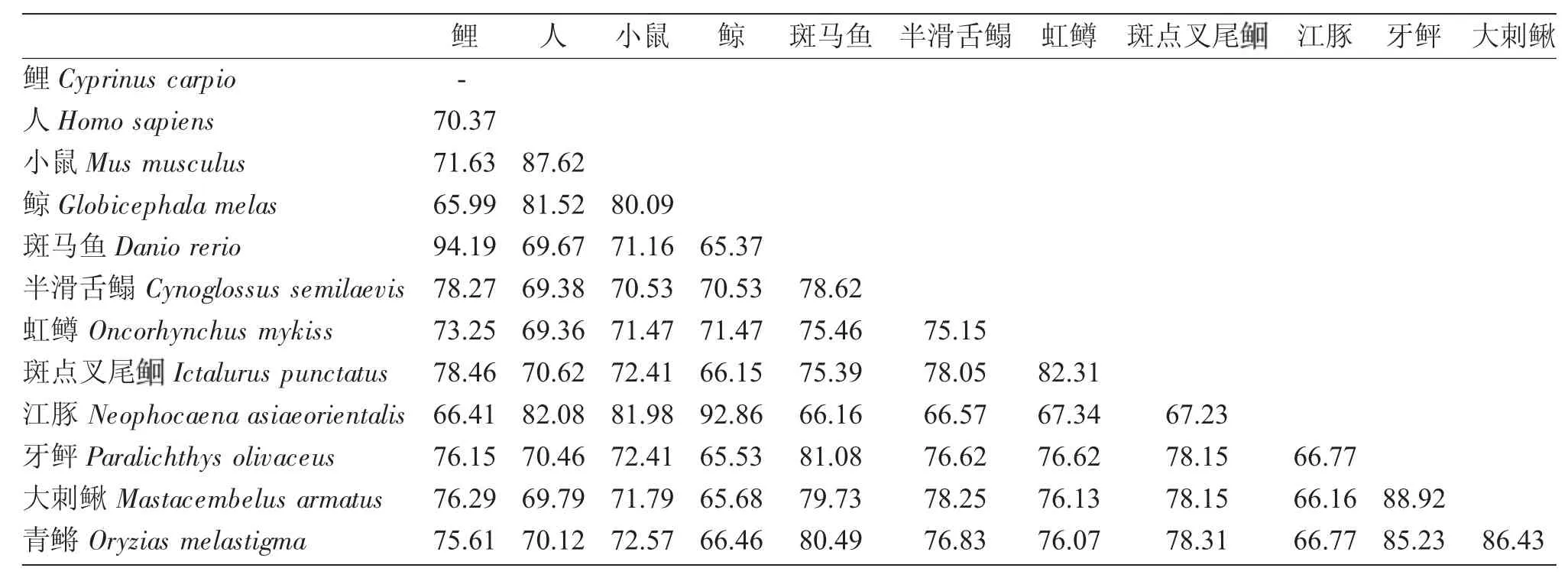
表2 鱼类和其他物种FFAR3 氨基酸序列比对(%)Tab.2 Comparison of the identities and divergence of the FFAR3 amino acid sequences between the fish and other species
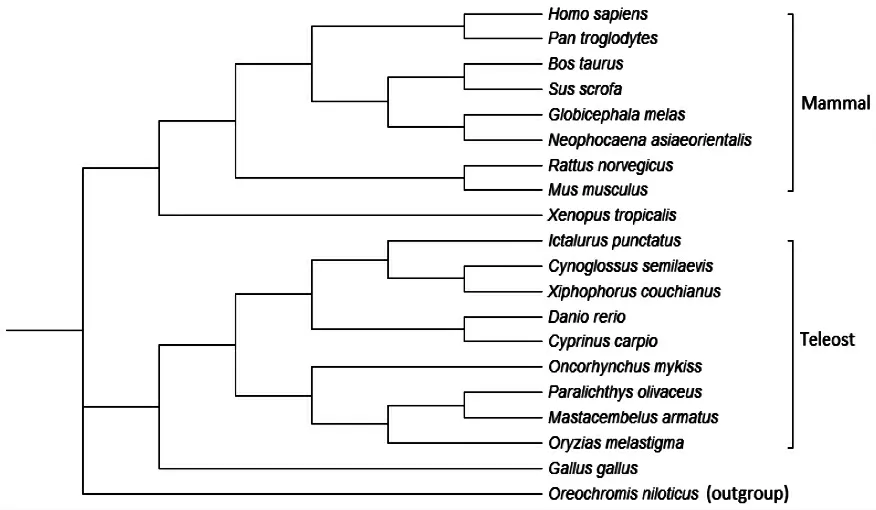
图3 鲤ffar3 氨基酸进化树Fig.3 Phylogenetic tree of deduced amino acid sequence of the ffar3 gene in common carp Cyprinus carpio

图4 ffar3 基因在鲤不同组织中的mRNA 表达水平Fig.4 Expression levels of mRNA ffar3 gene in different tissues of common carp Cyprinus carpio
3 讨论
自由脂肪酸受体FFAR3 也被称为G 蛋白偶联受体(G protein-Coupled Receptor 41,GPR41),首先被发现于动物肠道中[23,24]。营养物质吸收调控的关键步骤是营养物质的感知,G 蛋白偶联受体FFAR3具有这一功能。FFAR3 为脂肪酸感受器,可以感知来自消化腔的短链脂肪酸,如乙酸、丙酸和丁酸等,由肠道微生物发酵膳食纤维和前肠未消化的碳水化合物生成,是动物体内一种重要的能量来源[25]。FFAR3 作为一种重要的信号分子可调控脂类代谢、肠道对营养物质的吸收以及与细胞的分化和增殖密切相关的生理过程[23-25]。Samuel 等[25]研究表明:ffar3 基因敲除,小鼠肠道食糜通过肠道时间延长,短链脂肪酸吸收减少。Solima 等[26]的研究发现,敲除ffar3 基因后,短链脂肪酸减少,采食量和能量消耗增加,体重减轻。一些研究还发现,ffar3 基因具有调节机体内脂肪形成的作用。Meza-Cuenca 等[27]发现,肥胖大鼠腹部脂肪细胞中ffar3 基因的mRNA 的表达量较对照组显著增加,说明其在脂肪形成过程中发挥重要作用。Zaibi 等[28]在小鼠中也得出了相似的结论。
近年来,ffar3 基因的功能在家畜中也有一些研究报道。Inoue 等[29]研究发现,FFAR3 等短链脂肪酸能为反刍动物提供75%的能量,可激活FFAR3 调节脂肪代谢。郝军等[30]在研究牦牛ffar3 基因对生长性状的关联时发现,ffar3 基因不同基因型对牦牛体质量和体高有显著作用。李根来等[31]研究表明,猪ffar3 在不同组织、不同发育阶段表达量呈明显的时间特异性,揭示其可能在不同发育阶段和不同组织中发挥重要的生理功能。在家畜中,还有较多研究集中在组织表达特异性方面[32-35]。
但ffar3 基因在鱼类中尚未见报道。本研究通过前期高密度遗传连锁图谱精细定位获得的候选基因,定位了ffar3 为食物转化率相关的候选基因,通过鲤全基因组物理图谱和转录组图谱获得了该基因的全长序列。鲤ffar3 基因全长序列为3 318 bp,具有一个长度为990 bp 的完整开放式阅读框(457~1 446 bp),编码329 个氨基酸,与斑马鱼(编码327 个氨基酸)、斑点叉尾(编码325 个氨基酸)、牙鲆(编码325 个氨基酸)等基本一致,可判断其cDNA 的完整性。多个物种的氨基酸同源性分析表明,鲤ffar3 基因与其他鱼类同源性较高,其中与斑马鱼ffar3 基因的同源性最高,达94.19%。尤其是7 个跨膜螺旋区域同源性更高,表明ffar3 基因相对保守,这与Wang 等[36]的研究结果一致。系统进化分析结果显示,鱼类ffar3 基因亲缘关系较近,所有硬骨鱼类ffar3 基因聚在一支,而哺乳动物则聚在另一支。
本文通过实时荧光定量PCR 分析,检测到鲤ffar3在脑、肠、肌肉和肝脏中均有表达,肠中表达量最高,这与前人在ffar3 在人[36]、猪[31]、山羊[34]和奶牛[38]等组织的表达结果一致。本研究还发现,随着进食后时间的不同,除了肝脏外,其他三种组织mRNA表达水平呈现明显差异。脑中在进食后2 h 基因表达量达到最高值,随后在进食后4 h 和6 h 呈下降趋势。而在肠中则随着进食时间的延迟,基因表达量逐渐升高,在进食6 h 达到最高。肌肉的表达趋势与肠一致,但基因表达量升高的幅度小于肠组织。这些结果表明:ffar3 基因与摄食相关,暗示该基因可能参与了食物转化和吸收相关的生理过程。本研究仅在四种组织中探究了基因的表达情况,还需在多种组织中进一步验证。由于食物转化率性状是一个多基因控制的性状,单独研究一个基因还远远不够,需要不断挖掘更多的相关候选基因来分析表达差异,建立起基因功能的调控网络,以用于提高鱼的食物转化效率,促进鱼类快速生长。
