女性生殖道菌群改变与人乳头瘤病毒持续感染的相关性研究
2021-01-14毕庆庆朱婕张磊牟晓峰
毕庆庆,朱婕,张磊,牟晓峰
根据Global Cancer Statistics 2018的统计,全世界范围内每年约有57万例新增宫颈癌患者,宫颈癌致死的患者约为31.1万例[1]。在全球范围内,宫颈癌的发病率和病死率均排在所有女性肿瘤的第四位[1]。而在宫颈癌筛查措施相对欠缺的发展中国家女性中,宫颈癌的发病率和病死率均排在第二位,仅次于乳腺癌[1]。一种或多种高危型人乳头瘤病毒(HPV)的持续感染是导致宫颈瘤变的必要和高危因素[2]。宫颈上皮内瘤变(CIN)是宫颈恶性病变的前兆,病理分级从低到高依次为CIN1级、CIN2级和CIN3级。高危型HPV感染出现在90%以上的宫颈癌和60%以上的CIN患者中[3]。
生殖道内正常的定植菌群、宿主免疫调节以及宫颈阴道解剖结构之间构成动态平衡的微生态系统,保持着生殖道的健康状态[4]。近年来,越来越丰富的研究证据显示,生殖道的菌群环境和菌群结构改变与HPV感染、持续感染和黏膜局部免疫以及CIN进展关系紧密[5]。本研究分析了HPV持续感染患者、HPV一过性感染患者及健康体检者的生殖道菌群情况,发现了一些与HPV持续感染相关的菌群,这将为更早地将HPV持续感染和一过性感染患者区分提供帮助,甚至提早干预、逆转持续感染,进而有效地降低宫颈癌发病率,具有重要的临床意义。
本研究价值:
本研究分析了人乳头瘤病毒(HPV)持续感染者和HPV一过性感染者的生殖道菌群特征,找出了与高危型HPV持续感染密切相关的生殖道定植菌属,为差异菌种成为潜在的宫颈恶性病变生物标志物提供了数据支持,为宫颈恶性病变的预防提供了新策略、新技术,具有理论与临床意义。
1 对象与方法
1.1 研究对象 选取2018年1—6月于青岛市中心医院妇科体检或诊治的女性15例,根据HPV感染情况共分为HPV持续感染组6例、HPV一过性感染组4例、HPV阴性组5例,均为健康体检者。根据文献报道,将同一型别HPV感染持续12个月以上定义为HPV持续感染者,12个月内HPV感染清除定义为HPV一过性感染者[6]。
纳入标准:年龄21~65岁,有性生活史,48 h内无阴道冲洗,3 d内无性生活史、阴道上药史,1个月内未系统性使用抗生素或抗真菌药物。排除标准:有流产史且目前妊娠,子宫全切手术史,有其他基础性疾病。本研究经青岛市中心医院伦理委员会审查通过;研究对象均知情同意。
1.2 方法
1.2.1 样本采集 宫颈脱落细胞标本由妇科医生采集:通过窥阴器暴露宫颈,拭去宫颈口及周边分泌物,使用细胞刷刮取宫颈管上皮,在宫颈管内旋转360°并停留5 s后取出。每例患者收集两份宫颈标本,分别用于HPV基因分型分析和16s rRNA测序。采集宫颈标本后使用专用采集管储存、送检。
1.2.2 基因型分析 HPV基因分型分析采用PCR反向点杂交法。对样本进行核酸提取后进行PCR扩增,将扩增产物加入全自动核酸杂交仪进行杂交反应。阴性结果判读标准:仅内质控点(Internal Control)显色;阳性结果判读标准:内质控点显色且相应基因型处显色视为特定基因型阳性。
1.2.3 生殖道样本的16s rRNA测序 16s rRNA测序流程如下:第一步:DNA提取与检测,采用CTAB法提取样本基因组DNA,利用琼脂糖凝胶电泳检测DNA纯度和浓度,取适量样品于离心管中,使用无菌水稀释样品至1 ng/μl。第二步:PCR扩增,以稀释后的基因组DNA为模板,采用正向引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和反向引物806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增16s rRNA基因的V4区域。PCR反应采用Phusion®高保真PCR Master Mix (New England Biolabs)进行。反应程序:98 ℃预变性1 min;30个循环(98 ℃,10 s;50 ℃,30 s;72 ℃,30 s);72 ℃,5 min。第三步:PCR产物纯化,将等量的1X缓冲液(含SYB green)与PCR产物混合,在2%琼脂糖凝胶上进行电泳,使用Gene JETTM凝胶提取试剂盒(Thermo Scientific)对混合PCR产物进行纯化。第四步:文库制备及上机测序,使用Ion Plus Fragment Library Kit 48 rxns(Thermo Scientific)生成测序文库,通过Qubit@ 2.0荧光计(Thermo Scientific)进行文库质量评估。最后在Ion S5TM XL平台上对文库进行测序。
1.2.4 数据分析 第一步:对原始数据进行拼接、过滤,获得有效数据(Clean Data)。第二步:基于有效数据进行OTUs(Operational Taxonomic Units)聚类分析和物种分类分析。第三步:对每个OTUs的序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况;对OTUs进行物种丰度、Alpha多样性分析。第四步:对OTUs进行多序列比对并构建系统发生树,探究不同样本或组别间微生物群结构的差异。第三、四步均基于OTUs聚类分析结果进行。第五步:采用t检验、Wilcox检验、LEfSe等统计分析方法对不同组别样本的物种组成和菌群结构进行差异性分析。
1.3 统计学方法 采用SPSS 22.0软件进行统计学分析,计量资料以(±s)表示,组间比较采用成组t检验;计数资料以率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组生殖道菌群特征 选取每个样本和三组在门水平上最大丰度排名前10名的物种,以反映物种的相对丰度。HPV阴性组和HPV一过性感染组的生殖道菌群结构相对单一,厚壁菌门占据主要地位;而HPV持续感染组的生殖道菌群结构呈现复杂化趋势,变形菌门和拟杆菌门的丰度较高(见图1)。
2.2 样品Alpha多样性分析 HPV持续感染组丰度、Shannon指数高于HPV一过性感染组和HPV阴性组,差异有统计学意义(P=0.006 6、0.024 6;P=0.004 6、0.001 8);HPV一过性感染组和HPV阴性组丰度、Shannon指数比较,差异无统计学意义(P=0.419 1、0.806 1,见图2)。
2.3 物种显著性差异分析 HPV持续感染组和HPV一过性感染组厚壁菌门、变形菌门和拟杆菌门平均物种丰度比较,差异有统计学意义(P<0.05,见表1)。对组间的物种丰度数据通过秩和检验分析组间的差异物种,并通过线性判别分析(Linear Discriminant Analysis,LDA)进行降维分析,从而评估和计算差异显著物种对群落的影响大小,即得到LDA score,发现LDA score>4的Biomarker共有36个(见图3A)。根据整体上展示差异物种在不同组别间分布情况的Heatmap图,具有显著性差异的菌属主要包括不动杆菌属、普雷沃菌属、假单胞菌属和鞘氨醇单胞菌属等(见图3B)。
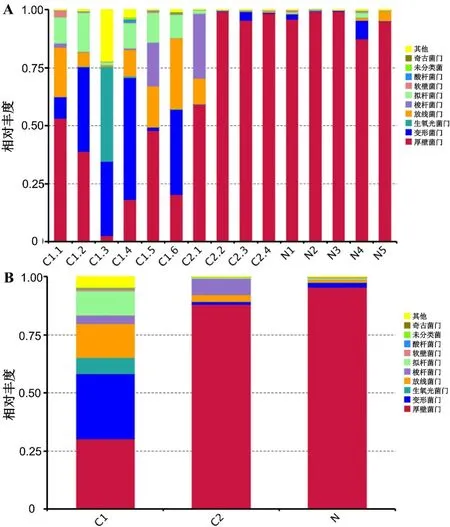
图1 三组物种相对丰度分布Figure 1 Taxonomy relative abundance at phylum level
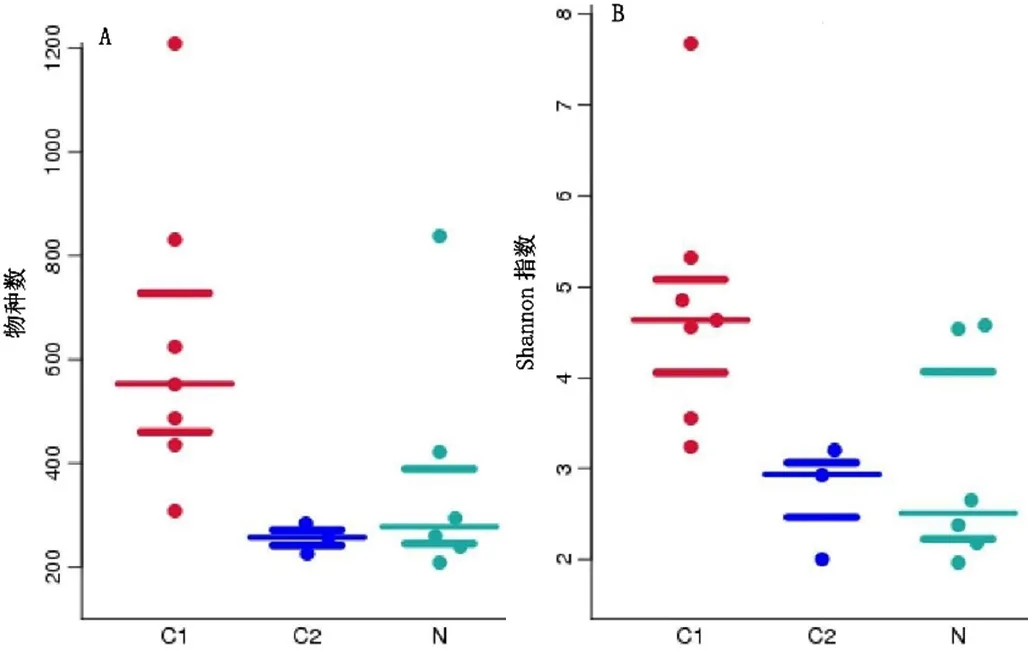
图2 三组Alpha多样性Figure 2 Alpha diversity
表1 HPV持续感染组和HPV一过性感染组的差异菌门( ±s)Table 1 Bacteria phylum differences between persistent and transient HPV infection groups
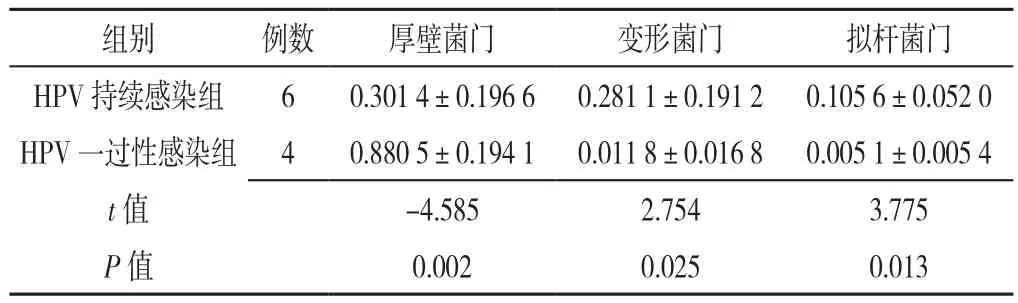
表1 HPV持续感染组和HPV一过性感染组的差异菌门( ±s)Table 1 Bacteria phylum differences between persistent and transient HPV infection groups
注:HPV=人乳头瘤病毒
组别 例数 厚壁菌门 变形菌门 拟杆菌门HPV持续感染组 6 0.301 4±0.196 6 0.281 1±0.191 2 0.105 6±0.052 0 HPV一过性感染组 4 0.880 5±0.194 1 0.011 8±0.016 8 0.005 1±0.005 4 t值 -4.585 2.754 3.775 P值 0.002 0.025 0.013
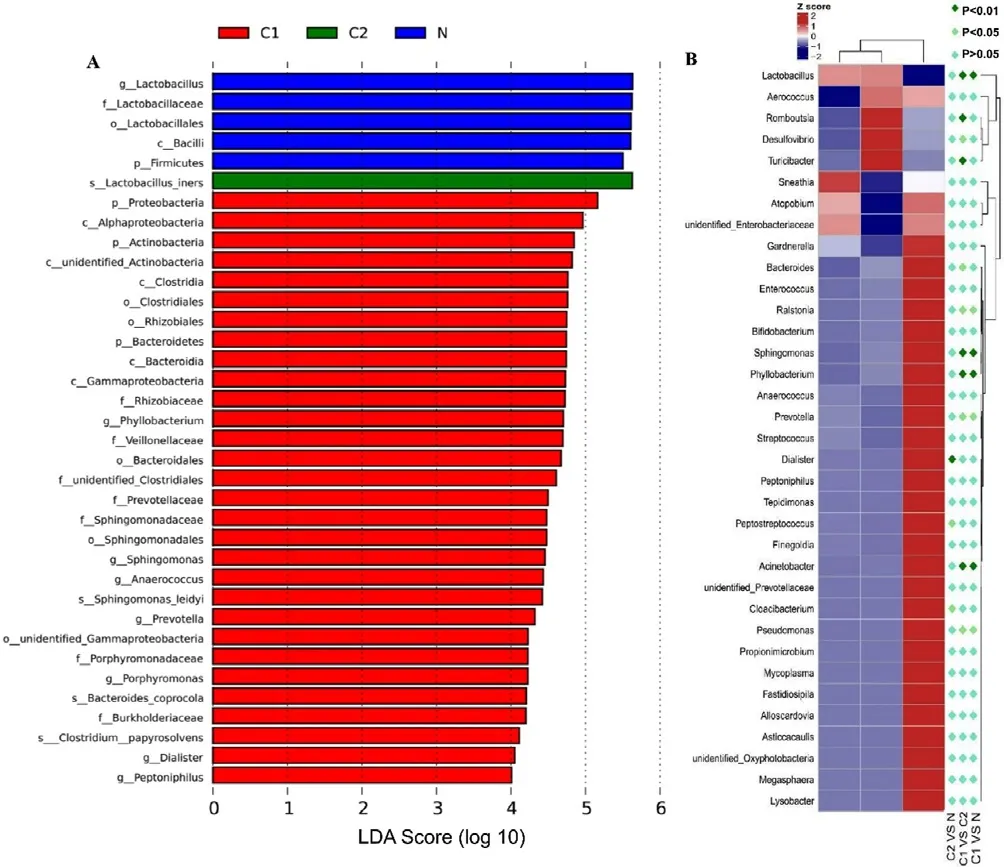
图3 LEfSe分析结果Figure 3 Results of LEfSe analysis
3 讨论
近年来,有研究证实宫颈恶性病变的发生与高危型HPV的持续感染相关[7],一般认为高危型HPV感染持续12个月以上未清除即为持续感染[6]。HPV持续感染导致宫颈局部微环境变化,随之而来的是免疫抑制、细胞增殖、血管形成及组织分化等,这一系列过程中任何调控因子的改变均可能会引起宫颈细胞的癌变。因此,早期区分HPV持续感染和HPV一过性感染是宫颈癌临床研究中亟待解决的问题之一,且该问题的解决将为宫颈癌的早期干预、持续感染的逆转提供依据,对降低宫颈癌的发病率具有重要的临床意义。
系统性的生殖道菌群研究在近几年逐渐兴起,2011年PNAS杂志上的一项研究首次提出将阴道菌群分为5个类群(community state types,CST),其中CSTⅠ、Ⅱ、Ⅲ和Ⅴ型分别代表了以卷曲乳杆菌、加氏乳杆菌、惰性乳杆菌和詹氏乳杆菌为优势的类型,CSTⅣ型以厌氧菌为优势菌群、乳杆菌明显减少[8]。CSTⅠ、Ⅱ、Ⅴ型的阴道菌群一般代表正常的阴道菌群类型,而CSTⅣ型代表的是菌群多样性显著增加的异常阴道菌群类型。值得注意的是,以惰性乳杆菌为代表的CSTⅢ型代表了阴道菌群的亚健康状态,该类菌群最容易向CSTⅣ型转化并诱发疾病[9]。另外,上述研究大多基于北美白种女性,也提及女性生殖道菌群特征在不同人种中具有显著差异[8]。在健康女性中,有80%的亚洲女性和60%的西班牙裔女性生殖道菌群以乳杆菌占优势,在黑人女性中这一数值则低至37%~40%[10]。因此,了解特定人群健康与疾病生殖道菌群特征对进一步理解其与宿主免疫系统的相互作用、引发疾病的机制具有重要意义。
本研究结果显示,本地区HPV阴性的健康女性的宫颈菌群结构相对单一,以乳杆菌为主;而在高危型HPV持续感染者中,宫颈菌群多样性明显增加,且菌群组成中厌氧菌的比例显著上升,这和中国西北地区和南方地区的高危型HPV感染与微生物组成相关性分析结果一致[11-12]。此外,在HPV持续感染的患者中,包含乳杆菌属的厚壁菌门的丰度显著降低,而变形菌门和拟杆菌门的丰度则显著增高,这或与HPV持续感染相关,是HPV持续感染的高危因素。
目前国内的类似研究多将研究对象确定为宫颈癌患者、HPV阳性患者或阴性就诊者,较少关注持续感染这一更常见的临床表现,本研究以HPV持续感染者和HPV一过性感染者为研究对象,进行16s rDNA测序,进一步利用统计分析方法寻找到36个在组间有显著差异的物种,其中具有显著性差异的代表性菌属包括不动杆菌属、普雷沃菌属、假单胞菌属和鞘氨醇单胞菌属等,这为区分HPV持续感染和HPV一过性感染患者提供了有效的方式,有着更直接的临床意义。之前的一项研究表明,对于普雷沃菌属和假单胞菌属丰度较高的女性,HPV清除更为困难,且更容易发展为持续感染[13]。另外,本研究还发现鞘氨醇单胞菌属与HPV持续感染相关,但在已发表文献中尚未报道,而差异菌属与HPV和宿主免疫之间的相互作用需要进一步研究。总之,上述结果将为区分HPV持续感染和HPV一过性感染提供一种有效的方法,具有一定的临床意义。
虽然本研究结果提示生殖道菌群改变与HPV持续感染相关,但是以目前的研究结果无法判断是菌群结构的改变导致了HPV持续感染,还是HPV持续感染引起了菌群结构的改变。进一步的研究应当关注整个生殖道微环境,研究生殖道菌群、HPV感染和宿主免疫系统的相互作用在宫颈癌前病变发生发展中的作用。此外,本研究样本量偏少,应进一步扩大样本检测量,找到HPV持续感染相关的特定菌属,还可使用单分子测序技术(single molecule real time,SMRT)检测样本,而将差异菌注释到种水平则有更显著的临床意义。
作者贡献:毕庆庆、张磊、牟晓峰进行文章的构思与设计,结果的分析与解释,文章的撰写及审校;毕庆庆、朱婕、张磊进行研究的可行性分析与具体实施,包括数据采集、整理、分析;毕庆庆、张磊进行统计学处理;牟晓峰进行论文的修订,对文章整体负责,监督管理。
本文无利益冲突。
