铁死亡相关机制与其在肝脏相关疾病中作用的研究进展
2021-01-14张颖婷
贺 明,魏 倩,张颖婷
上海交通大学基础医学院病理生理学系,细胞分化与凋亡教育部重点实验室,上海200025
与其他典型的调节性细胞死亡方式(如细胞凋亡、细胞坏死等)不同,铁死亡(ferroptosis)是近年来被提出的一种与细胞代谢密切相关的铁依赖性的新型细胞程序性死亡方式。一直以来,肝脏铁超载被认为是多种肝脏疾病加重的主要诱因之一[1]。最新的研究结果[1]表明,铁死亡可在酒精性肝病(alcoholic liver disease,ALD)、非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、自身免疫性肝炎(autoimmune hepatitis,AIH)、肝纤维化及肝癌等多种肝脏疾病中发挥重要作用,但其确切的机制仍不清楚。本文整理了铁死亡在不同肝脏疾病中的作用机制,以期为肝脏疾病的预防和治疗提供新 思路。
1 铁死亡概述
1.1 铁死亡的概念和特征
铁死亡由Brent R. Stockwell 博士于2012 年命名,是一种铁依赖性的由脂质过氧化产物和活性氧(reactive oxygen species,ROS)堆积而导致的细胞调节性死亡方式[2]。铁死亡在形态学、生化特征和调控机制上与其他细胞死亡方式(如凋亡、坏死等)有所不同(表1)[3]:① 形态学方面。细胞凋亡时表现为细胞膜无破裂,胞内出现典型的凋亡小体。细胞坏死时表现为细胞肿胀,细胞核浓缩、碎裂、溶解,染色质染色变淡、呈絮状,细胞器膨大或碎裂。铁死亡则无典型的细胞凋亡和坏死表现,主要为细胞膜破裂和出泡,线粒体萎缩,膜密度增加、嵴减少,细胞核缺乏染色质凝集等。②生化特征和调控机制方面。细胞凋亡过程主要依赖含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase),凋亡发生时胞浆Ca2+和pH 水平升高,核酸内切酶被激活导致核DNA 片段化,细胞膜磷脂酰丝氨酸外翻,线粒体膜电位降低,通透性增强。细胞坏死会引起局部严重的炎症反应,与受体相互作用蛋白激酶3(receptor interacting protein kinase 3,RIPK3)等多种信号通路有关。而铁死亡时,细胞内Fe2+发生聚集,脂质过氧化水平显著升高、ROS 增加,细胞半胱氨酸摄取减少、谷胱甘肽(glutathione,GSH)耗竭并释放花生四烯酸等介导因子等[4];铁死亡的实质是Fe2+累积和细胞氧化还原代谢发生紊乱,即细胞抗氧化能力下降,ROS 和脂质过氧化产物在细胞内得不到还原而大量累积,进而诱导细胞死亡;其与细胞凋亡和坏死发生机制间均不存在交叉,抑制细胞凋亡、坏死的小分子对铁死亡无抑制作用[5]。
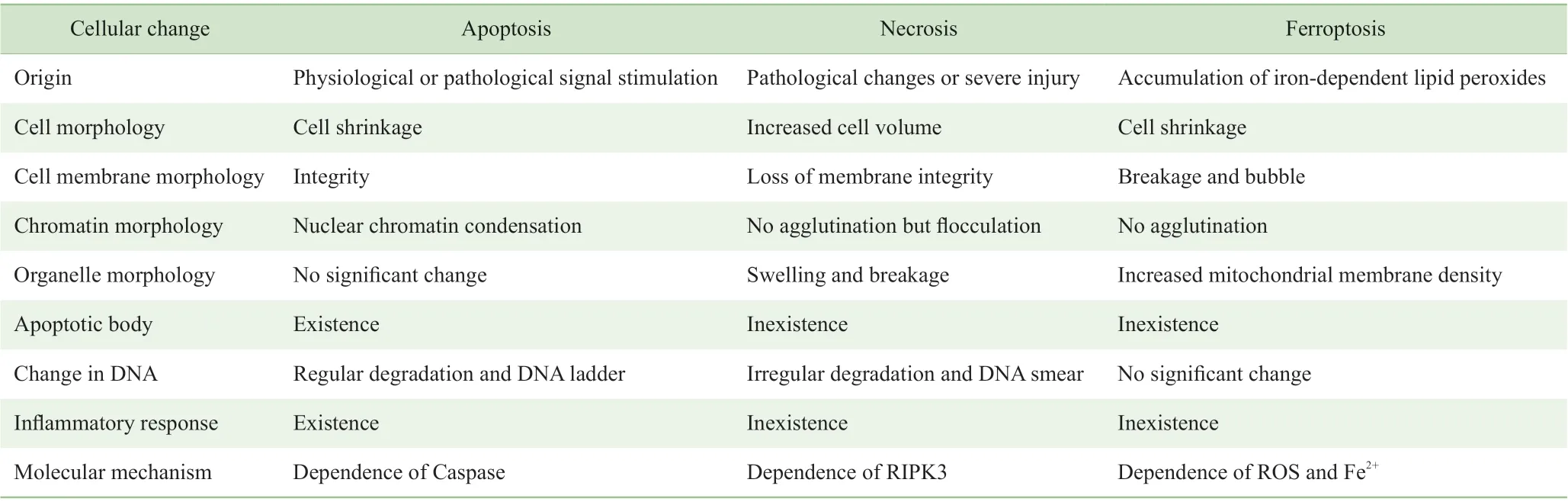
表1 3 种细胞死亡方式的比较Tab 1 Comparison of three types of cell death
1.2 铁死亡的发生机制
越来越多的研究证明,铁代谢紊乱和ROS 累积是不同病理生理情况下铁死亡的重要启动因素。其二者具体的触发机制,总结如下。
1.2.1 铁代谢紊乱 细胞代谢过程中积累的ROS 主要为超氧自由基阴离子(O2.-)和过氧化氢(H2O2)。在游离Fe2+的作用下其会转化为羟基自由基(HO-),进一步对大分子特别是脂质分子如多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)、聚不饱和脂肪酸等进行氧化,生成脂质过氧化物。这些涉及铁并生成羟基或烷氧基自由基(RO-)的反应被称为芬顿反应(Fenton 反应)[6]。细胞内的脂质过氧化产物一旦被大量累积且不能被及时清除,就会对DNA、蛋白质和细胞膜造成氧化损伤,最终导致细胞铁死亡。
同时有研究[2]显示,外源性Fe2+的摄入可以加剧由铁死亡诱导剂erastin 诱发的铁死亡,而其他二价金属离子并不能加剧该效果。Dixon 等[2]发现铁反应元件结合蛋白2 [iron responsive element binding protein 2,IREB2;又名 铁 调 节 蛋 白2(iron regulatory protein 2,IRP2) ],主要 通 过IRE-IRP(iron responsive element-iron regulatory protein)系统转录后调控铁代谢相关基因,是介导erastin导致人纤维肉瘤细胞HT-1080 和Calu-1 发生铁死亡的重要蛋白。此外,Yang 等[7]发现磷酸化酶激酶催化亚基γ2(phosphorylase kinase catalytic subunit γ2,PHKG2)可 通过调节游离Fe2+的含量正向调节铁死亡,而抑制PHKG2表达则可起到铁螯合的作用。但有关PHKG2 调控铁代谢的作用机制尚不清楚,需做进一步研究。
1.2.2 ROS 累积 正常情况下,脂氧合酶(lipoxygenases,LOXs)可通过催化膜脂PUFAs 的双加氧反应生成脂肪酸过氧化物[7],然后在谷胱甘肽过氧化物酶4(glutathione peroxidase,GPX4)的介导下转化为脂肪酸醇。但当GPX4 失活时上述过程被阻断,细胞内大量的ROS 则可与膜脂PUFAs 发生Fenton 反应,导致细胞膜损伤从而触发铁死亡。因此,脂质ROS 的大量累积是驱动铁死亡的重要因素之一。而有研究[8]发现,抑制5-LOX 可抑制铁死亡的发生,还可减轻由谷氨酸诱导的神经系统氧化损伤。另有研究[9]发现,细胞可通过胱氨酸/谷氨酸反向转运体(the cystine/glutamate antiporter system,system)从胞外摄取胱氨酸生成半胱氨酸进而合成GSH,而GPX4 可在GSH 的存在下发挥磷脂过氧化物酶活性以催化脂质过氧化物发生还原;因此,小分子抑制system Xc-可导致GSH 耗竭,间接使GPX4 失活,从而使ROS 水平升高,最终导致脂质过氧化产物积累并触发铁死亡。另外,也有文献[9]指出GPX4 过表达可明显抑制细胞铁死亡 的发生。
此外,作为细胞质和线粒体之间转运离子和代谢物的跨膜通道,位于线粒体外膜的电压依赖性阴离子通道(voltage-dependent anion channels,VDACs)在铁死亡中也发挥了重要的调控作用[10]。研究[11]发现,erastin 可作为VDACs 微管蛋白的拮抗剂以解除微管蛋白对VDACs 的抑制作用,从而促使大量氧化物释放,引发ROS 依赖的线粒体功能障碍、生物能量衰竭和铁死亡,而VDAC2/3 基因敲低可减少由erastin 诱导的铁死亡的发生。在黑色素瘤细胞的erastin 诱导铁死亡的过程中,上调并激活E3-连接酶Nedd4 可促进VDAC2/3 的泛素化降解,从而抑制铁死亡。由此发现,Nedd4-VDAC2/3 是erastin 诱导铁死亡过程中的重要负反馈信号通路。
1.3 铁死亡的诱导剂和抑制剂
由于铁代谢和脂质过氧化是铁死亡的中心环节,因此影响铁代谢和脂质过氧化从而引起ROS 积累的分子可被认为是铁死亡的诱导剂或抑制剂。研究[5,12]显示,铁死亡的诱导剂包括间接抑制GPX4 的system Xc-抑制剂,如erastin、sulfasalazine、sorafenib 和L-glutamate, 以 及 直接抑制GPX4 的RAS 选择性致死蛋白3(RAS-selective lethality protein 3,RSL3)、ML162(molecular libraries 162)、altretamine 和FIN56 等。最近的一项研究[13]指出,铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)是泛醌(CoQ10)抗氧化系统的关键组分,因此FSP1 的小分子抑制剂也能通过抑制脂质过氧化反应诱导铁死亡的发生。常见的铁死亡抑制剂包括抑制ROS 的ferrostatin-1(Fer-1), 抑 制Fenton 反 应 的 去 铁 胺(deferoxamine,DFO),激活system Xc-的β-巯基乙醇和细胞内铁螯合剂环匹罗司[5,12]。此外,另有研究[3,14]发现,在铁死亡的过程中酰基辅酶A 合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)、溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)和LOXs 等参与脂肪酸代谢反应,催化PUFAs发生双加氧反应,在GPX4 失活诱导的铁死亡中也发挥了重要作用。
2 铁死亡在肝脏疾病中的作用机制
长期以来,肝脏铁超载一直被认为是不同肝脏疾病的主要诱因之一。新近研究[1]表明,作为新的非典型细胞死亡类型,铁死亡在多种肝脏疾病的发生与发展中发挥了重要作用。
2.1 ALD
在ALD 的发展过程中Fe2+会发生大量积聚,而体外补充铁元素也会加速ALD 的进展。过量的铁和酒精均与肝脏疾病的高风险相关。有研究[6,15]表明,铁死亡抑制剂可明显减轻由酒精诱导的肝细胞死亡,且Fer-1 可显著改善小鼠酒精性肝损伤。因此,铁死亡在ALD 的进展中可能发挥了关键作用。
研究[16]显示,过表达磷脂酸磷酸水解酶lipin-1 可促进三酰甘油的合成和脂肪酸的氧化,加速体内铁的积累并加重脂肪变性,进而促进铁死亡和肝损伤的发生。Zhou等[17]研究发现,在相同酒精饮食的条件下,肠特异性Sirtuin1(Sirt1)敲除组小鼠相比于野生型组的肝脏炎症和肝损伤明显减轻,铁死亡相关基因的表达受到抑制,继而提示肠特异性敲除Sirt1 或可通过部分减轻铁死亡而减轻ALD。此外,Hu 等[18]研究发现,敲除小鼠线粒体外膜蛋白mitoNEET 基因可诱导脂肪脂联素和回肠成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)的表达水平协同升高,抑制肝脏氧化应激及铁超载,进而减轻酒精性肝损伤;进而提示脂联素和FGF15 可能作为脂肪-肠-肝代谢关键协调因子,介导mitoNEET 敲除后对ALD 的保护作用。
2.2 NAFLD 和NASH
近年来NAFLD 和NASH 的全球发病率均持续升高。文献[19]指出,肝脏铁含量的增加可能是NAFLD 的重要致病因素,且过量的铁可能通过增加肝细胞膨胀、炎症和纤维化的风险加重NAFLD,从而使其转化为NASH。作为抗氧化剂,维生素E 能够抑制脂质过氧化反应,也能减轻NASH 患者的肝损伤程度[20-21]。除了脂质过氧化,铁代谢紊乱也是导致NASH 病情加重的因素之一。有临床研究[20]显示,部分NASH 患者出现了肝铁质沉着现象,原发性血色素沉着症患者出现了NASH 加重现象等。因此,在NASH 的部分患者中有可能存在铁死亡现象[20]。
Yang 等[22]发现,给予高铁饮食会导致小鼠肝脏氧化应激和炎症反应加重,引起肝损伤,从而加速NAFLD 向NASH 的进展。而铁死亡抑制剂可明显抑制模拟NASH发病的甲硫氨酸/ 胆碱缺乏饲料(methionine-choline deficient diet,MCD)模型或胆碱缺乏并添加乙硫氨酸饮食(choline-deficient,ethionine-supplemented diet,CDE)模型小鼠的肝细胞死亡和炎症相关基因的表达[23-24],这些均表明抑制铁死亡可在NASH 进展过程中发挥潜在的治疗作用。但目前,关于铁死亡在NASH 中的作用及机制的报道较少,值得进一步研究。
2.3 肝纤维化
肝纤维化是慢性肝病发展过程中的一个阶段,长期持续的肝纤维化会演变成肝硬化。肝星状细胞(hepatic stellate cell,HSC)的激活、增殖及转化是肝纤维化过程中的重要环节,因此以HSC 作治疗标靶或可为新的抗肝纤维化治疗提供重要的理论意义。研究[25]显示,青蒿琥酯可诱导活化的HSC,通过铁自噬发生铁死亡来抑制肝纤维化发展。异甘草酸镁可通过上调血红素氧合酶1 的表达调控铁转运过程,促进Fe2+和脂质过氧化物累积,诱导HSC 发生铁死亡,从而减轻肝纤维化程度[26]。此外,蒿甲醚可通过上调P53 的基因表达,抑制溶质载体家族7成 员11(recombinant solute carrier family 7,member 11,SLC7A11)重组蛋白间接使GPX4 失活,最终诱导HSC发生铁死亡,抑制肝纤维化的发生[27]。因此,针对铁死亡调控机制的研究或将为肝纤维化提供新的诊断和治疗 方法。
2.4 病毒性肝炎
丙型肝炎病毒(hepatitis C virus,HCV)感染可通过不同的机制引起肝细胞铁含量过载,如HCV 可诱导氧化应激抑制肝脏铁调素从而导致十二指肠膜铁转运蛋白1 (ferroportin-1)上调等。研究[28]发现,HCV 患者的细胞内铁含量与该疾病的严重程度密切相关。同时,有研究[29]发现转铁蛋白受体1(transferrin receptor 1,TfR1)在HCV 感染肝细胞过程中可引起铁代谢改变,从而增强病毒遗传物质的复制及其转录产物的翻译。此外,使用聚乙二醇干扰素联合利巴韦林治疗HCV 发现,在药物处理24 h 后血清转铁蛋白水平急剧升高,细胞铁和铁蛋白水平亦进一步升高,这些动态变化可能与治疗相关的病毒动力学有关[1]。
2.5 自身免疫性肝病
自身免疫性肝病是由免疫介导的不同组织损伤引起的一组慢性肝病,主要指以肝细胞为靶点的AIH[30]。AIH 是一种持续性的、复发性的由免疫反应介导的肝损伤。目前,引起AIH 的机制尚未被阐明,其中利用刀豆蛋白A (concanavalin A,ConA)导致的暴发性免疫肝损伤是AIH 最常用的模型。研究[30]表明,微囊蛋白(caveolin-1,CAV1)的基因被敲除可明显促进由ConA 诱导产生的ROS 和活性氮(reactive nitrogen species,RNS)的大量累积,从而诱发更加严重的肝细胞铁死亡和AIH。而吲哚胺2,3-双加氧酶1(indoleamine 2,3-dioxygenase 1,IDO1)与铁死亡抑制剂Fer-1 均可减轻ConA 诱导的铁死亡和肝损伤[31-32]。这些数据均表明,铁死亡可能在免疫介导的肝炎中发挥一定作用,靶向铁死亡或将成为治疗AIH 的潜在靶点。
2.6 肝癌
研究[33]表明,铁死亡诱导剂erastin 可明显抑制HCC细胞中GA 结合蛋白转录因子亚基-1(GA binding protein transcription factor subunit β 1,GABPB1)蛋白的表达,使得过氧化物酶基因表达受到抑制,从而导致胞内ROS 和丙二醛不断累积,引发细胞死亡。因此,GABPB1 可能是介导erastin 诱导的HCC 细胞铁死亡的关键分子。此外,在肝癌细胞中发现长链酰基辅酶A 合成酶3(acyl-CoA synthetase long chain family member 3,ACSL3) 和ACSL4 表达显著上调[33],而ACSL4 可通过5- 羟基二十碳四烯酸介导的脂毒性在erastin 诱导的铁死亡中发挥作用[4]。索拉非尼(Sorafenib)是目前唯一能够通过诱导铁死亡治疗肝癌的抗癌药物,但其耐药性会在很大程度上影响其治疗效果。而另有研究[34-35]表明,抑制金属硫蛋白1G(metallothionein 1G,MT1G)和氧化应激相关蛋白sigma 1 受体(oxidative stress-related protein sigma 1 receptor,S1R)均可通过诱导铁死亡过程来改善肝癌细胞对索拉非尼的耐药问题。也有文献[36]报道,索拉非尼可通过下调成视网膜母细胞瘤蛋白(retinoblastoma protein,RB)的表达提高肝癌细胞对铁死亡的敏感性,从而增强其抗癌作用。最新的一项研究[37]证明,铜蓝蛋白(ceruloplasmin,CP)通过调节HCC 细胞的铁稳态来抑制铁死亡,而抑制CP 可显著增加细胞内Fe2+和ROS 的积累,进而促进erastin 和RSL3 诱导的HCC 细胞铁死亡。因此,对肝癌患者进行联合用药治疗或许可以解决部分耐药性问题,从而提升其临床效果。
同时,纳米颗粒药物也为原位诱导肝癌细胞铁死亡提供了新的方向。文献[38]报道显示,锰-二氧化硅纳米颗粒可通过快速消耗胞内的GSH 来诱导肿瘤细胞发生铁死亡。由低密度脂蛋白-二十二碳六烯酸(low density lipoprteindocosahexaenoic acid,LDL-DHA)重组而成的纳米颗粒可提高肝癌细胞内的脂质过氧化水平,降低GSH 水平并抑制GPX4 的功能,从而诱发铁死亡杀死肝癌细胞,抑制大鼠原位肝肿瘤的生长[4]。因此,诱导肝癌细胞发生铁死亡可能是未来特异性治疗肝癌的新方向。
3 总结与展望
铁依赖的脂质过氧化反应是铁死亡的标志,但目前针对铁死亡过程中发挥关键调控作用的分子以及通用的信号通路尚未被阐明。铁作为催化剂可将过氧化物转化为自由基从而诱导铁死亡,但该作用机制尚不清楚,也不能确定是否有其他代谢过程或其他形式的调节性细胞死亡参与了铁死亡的调控。同时,作为调节机体稳态的重要的细胞死亡方式之一,铁死亡还参与了多种肝脏疾病的发生与发展。若正常肝细胞发生铁死亡,将会导致细胞氧化还原代谢紊乱从而引起相应的病理生理学改变。而在肝癌细胞中增加其对铁死亡的敏感性,则可通过降低肿瘤细胞的耐药性提高治疗效果。目前,已有的关于铁死亡在肝脏疾病中作用的文献报道多为间接研究,较难找到直接作用的靶点,而仅使用抗氧化剂抑制脂质过氧化亦很难达到治疗效果。因此,了解其具体的作用机制和因果关系对于分析铁死亡在肝脏相关疾病中作用至关重要。近年来,以铁死亡为方向进行疾病治疗的研究快速发展,其或将为未来临床治疗的方向和策略提供一定的参考。
参·考·文·献
[1] Macías-Rodríguez RU, Inzaugarat ME, Ruiz-Margáin A, et al. Reclassifying hepatic cell death during liver damage: ferroptosis-a novel form of nonapoptotic cell death?[J]. Int J Mol Sci, 2020, 21(5): 1651.
[2] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072.
[3] Gautheron J, Gores GJ, Rodrigues CMP. Lytic cell death in metabolic liver disease[J]. J Hepatol, 2020, 73(2): 394-408.
[4] 李余佳, 王玲, 金春, 等. 铁死亡的调控机制及其在肝疾病中的作用研究进展[J]. 中国药理学与毒理学杂志, 2019, 33(4): 307-313.
[5] Guo JP, Xu BF, Han Q, et al. Ferroptosis: a novel anti-tumor action for cisplatin[J]. Cancer Res Treat, 2018, 50(2): 445-460.
[6] Gao WX, Zhao J, Gao ZH, et al. Synergistic interaction of light alcohol administration in the presence of mild iron overload in a mouse model of liver injury: involvement of triosephosphate isomerase nitration and inactivation[J]. PLoS One, 2017, 12(1): E0170350.
[7] Yang WS, Kim KJ, Gaschler MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. PNAS, 2016, 113(34): E4966-E4975.
[8] Liu Y, Wang W, Li YY, et al. The 5-lipoxygenase inhibitor zileuton confers neuroprotection against glutamate oxidative damage by inhibiting ferroptosis[J]. Biol Pharm Bull, 2015, 38(8): 1234-1239.
[9] 刘宏伟, 邵莹莹, 陈倩, 等. 铁死亡调控机制及其在肝细胞癌中的研究进展[J]. 中南药学, 2020, 18(4): 607-612.
[10] Battaglia AM, Chirillo R, Aversa I, et al. Ferroptosis and cancer: mitochondria meet the “iron maiden”cell death[J]. Cells, 2020, 9(6): 1505.
[11] Fang D, Maldonado EN. VDAC regulation: a mitochondrial target to stop cell proliferation[J]. Adv Cancer Res, 2018, 138: 41-69.
[12] Shimada K, Skouta R, Kaplan A, et al. Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis[J]. Nat Chem Biol, 2016, 12(7): 497-503.
[13] Bersuker K, Hendricks JM, Li ZP, et al. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis[J]. Nature, 2019, 575(7784): 688-692.
[14] Dixon SJ, Winter GE, Musavi LS, et al. Human haploid cell genetics reveals roles for lipid metabolism genes in nonapoptotic cell death[J]. ACS Chem Biol, 2015, 10(7): 1604-1609.
[15] Liu CY, Wang M, Yu HM, et al. Ferroptosis is involved in alcohol-induced cell death in vivo and in vitro[J]. Biosci Biotechnol Biochem, 2020, 84(8): 1621-1628.
[16] Zhou Z, Ye TJ, Bonavita G, et al. Adipose-specific lipin-1 overexpression renders hepatic ferroptosis and exacerbates alcoholic steatohepatitis in mice[J]. Hepatol Commun, 2019, 3(5): 656-669.
[17] Zhou Z, Ye TJ, DeCaro E, et al. Intestinal SIRT1 deficiency protects mice from ethanol-induced liver injury by mitigating ferroptosis[J]. Am J Pathol, 2020, 190(1): 82-92.
[18] Hu XD, Jogasuria A, Wang JY, et al. MitoNEET deficiency alleviates experimental alcoholic steatohepatitis in mice by stimulating endocrine adiponectin-Fgf15 axis[J]. J Biol Chem, 2016, 291(43): 22482-22495.
[19] Marmur J, Beshara S, Eggertsen G, et al. Hepcidin levels correlate to liver iron content, but not steatohepatitis, in non-alcoholic fatty liver disease[J]. BMC Gastroenterol, 2018, 18(1): 78.
[20] Tsurusaki S, Tsuchiya Y, Koumura T, et al. Hepatic ferroptosis plays an important role as the trigger for initiating inflammation in nonalcoholic steatohepatitis[J]. Cell Death Dis, 2019, 10(6): 449.
[21] Handa P, Morgan-Stevenson V, Maliken BD, et al. Iron overload results in hepatic oxidative stress, immune cell activation, and hepatocellular ballooning injury, leading to nonalcoholic steatohepatitis in genetically obese mice[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 310(2): G117-G127.
[22] Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1/2): 317-331.
[23] Qi J, Kim JW, Zhou ZX, et al. Ferroptosis affects the progression of nonalcoholic steatohepatitis via the modulation of lipid peroxidation-mediated cell death in mice[J]. Am J Pathol, 2020, 190(1): 68-81.
[24] Li XY, Wang TX, Huang XM, et al. Targeting ferroptosis alleviates methionine-choline deficient (MCD)-diet induced NASH by suppressing liver lipotoxicity[J]. Liver Int, 2020, 40(6): 1378-1394.
[25] Kong ZY, Liu R, Cheng YR. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway[J]. Biomed Pharmacother, 2019, 109: 2043-2053.
[26] Sui M, Jiang XF, Chen J, et al. Magnesium isoglycyrrhizinate ameliorates liver fibrosis and hepatic stellate cell activation by regulating ferroptosis signaling pathway[J]. Biomed Pharmacother, 2018, 106: 125-133.
[27] Wang L, Zhang ZL, Li MM, et al. P53-dependent induction of ferroptosis is required for artemether to alleviate carbon tetrachloride-induced liver fibrosis and hepatic stellate cell activation[J]. IUBMB Life, 2019, 71(1): 45-56.
[28] Zou DM, Sun WL. Relationship between hepatitis C virus infection and iron overload[J].Chin Med J (Engl), 2017, 130(7):866-871.
[29] Li WH, Urban S. Entry of hepatitis B and hepatitis D virus into hepatocytes: basic insights and clinical implications[J]. J Hepatol, 2016, 64(1): S32-S40.
[30] Selmi C, Generali E, Gershwin ME. Rheumatic manifestations in autoimmune liver disease[J]. Rheum Dis Clin North Am, 2018, 44(1): 65-87.
[31] Deng GH, Li YJ, Ma SY, et al. Caveolin-1 dictates ferroptosis in the execution of acute immune-mediated hepatic damage by attenuating nitrogen stress[J]. Free Radic Biol Med, 2020, 148: 151-161.
[32] Zeng T, Deng GH, Zhong WC, et al. Indoleamine 2, 3-dioxygenase 1 enhances hepatocytes ferroptosis in acute immune hepatitis associated with excess nitrative stress[J]. Free Radic Biol Med, 2020, 152: 668-679.
[33] Ndiaye H, Liu JY, Hall A, et al. Immunohistochemical staining reveals differential expression of ACSL3 and ACSL4 in hepatocellular carcinoma and hepatic gastrointestinal metastases[J]. Biosci Rep, 2020, 40(4): BSR20200219.
[34] Sun XF, Niu XH, Chen RC, et al. Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis[J]. Hepatology, 2016, 64(2): 488-500.
[35] Bai T, Wang S, Zhao YP, et al. Haloperidol, a sigma receptor 1 antagonist, promotes ferroptosis in hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2017, 491(4): 919-925.
[36] Louandre C, Marcq I, Bouhlal H, et al. The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 356(2 Pt B): 971-977.
[37] Shang YX, Luo MY, Yao FP, et al. Ceruloplasmin suppresses ferroptosis by regulating iron homeostasis in hepatocellular carcinoma cells[J]. Cell Signal, 2020, 72: 109633.
[38] Tang HX, Chen DF, Li CQ, et al. Dual GSH-exhausting sorafenib loaded manganese-silica nanodrugs for inducing the ferroptosis of hepatocellular carcinoma cells[J]. Int J Pharm, 2019, 572: 118782.
