城市红树林系统中微塑料表面细菌群落结构特征分析
2021-01-13付茜茜李大圳章宇晴邓惠冯丹赵媛媛俞花美吴晓晨葛成军
付茜茜 李大圳 章宇晴 邓惠 冯丹 赵媛媛 俞花美 吴晓晨 葛成军



摘 要:以城市紅树林生态系统为研究对象,研究该系统水体中微塑料表面细菌群落结构的多样性与组分特征。采用野外原位暴露实验的方法,利用扫描电镜显微镜(SEM)和16S rDNA高通量测序技术,检测聚乙烯(PE)、聚苯乙烯(PS)、聚氯乙烯(PVC)和具有可降解性的聚乳酸(PLA)4种不同类型微塑料表面形貌特征和细菌群落结构。结果表明:4种微塑料暴露45 d后(标记为LPE、LPS、LPVC、LPLA)在其表面均能观察到明显微生物聚集体,主要以杆状细菌、球状细菌为主;不同类型微塑料表面生物膜总量存在显著差异,表现为LPE>LPLA>LPS>LPVC;4种微塑料表面的细菌群落主要包括变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),而水环境中以蓝细菌门(Cyanobacteria_Chloroplast)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)为优势菌群。基于细菌群落多样性分析,结果发现微塑料表面生物膜中的细菌群落结构和周围水体存在显著差异,各个类型的微塑料表面细菌群落结构组分相似。红树林系统是微塑料的重要收纳场所,研究微塑料表面生物膜微生物群落特征,为进一步开展城市红树林系统中微塑料的环境行为与生态风险评价提供重要参考依据。
关键词:红树林生态系统;微塑料;细菌群落结构;城市
中图分类号:S718.55 文献标识码:A
Abstract: Recently, microplastic pollution has become a new global environmental problem. Due to the strong hydro-phobicity and large specific surface area, microplastics exposed to the environment can provide a new ecological site for microorganisms. Mangrove system is the “source” and “sink” of pollutants. Urban mangrove system was selected to study the diversity and composition characteristics of the bacterial community structure of the microplastics surface in the system. The method of in-situ exposure experiment, scanning electron microscope and 16S rDNA high-throughput sequencing technology were used to investigate the surface morphology characteristics and bacterial community structure of four types of microplastics (PE, PS, PVC, PLA). The results showed that obvious microbial aggregates were observed on the surfaces of the four microplastics after exposure (labeled as LPE, LPS, LPVC, LPLA), mainly bacilli and cocci (shape). There were significant differences in the total amount of biofilm on the surfaces of the four microplastics, which was represented by LPE>LPLA>LPS>LPVC. The results of high-throughput sequencing presented that the bacterial communities on the surfaces of the four microplastics mainly included Proteobacteria and Bacteroidetes. However, in the water environment, Cyanobacteria_Chloroplast, Proteobacteria, Actinobacteria and Bacteroidetes were the dominant flora. Based on the analysis of the diversity of the bacterial community, it was found that there were significant differences between the bacterial community structure in the microplastic surface biofilm and the surrounding water body, and the bacterial community structure composition on the surfaces of the four microplastics were similar. Since microplastics were accumulated in the mangrove area, it is necessary to study the microbial community characteristics of microplastic surface biofilm in order to provide an important reference for in-depth understanding the environmental behavior and ecological risk assessment of microplastics in urban mangrove systems.
Keywords: mangrove system; microplastics; bacterial community structure; urban
DOI: 10.3969/j.issn.1000-2561.2021.12.041
微塑料(MPs)是指粒径或长度小于5 mm的塑料,来源于大块塑料垃圾的碎裂或其直接环境排放,包含碎片、纤维、颗粒、发泡、薄膜等不同形貌类型[1]。近几年来,微塑料在全球各地海水、河流湖泊[2]、饮用水[1]、污水处理厂进水和出水[3]、沉积物[4]、土壤[5]和生物体[6]中被频繁检出,且丰度呈现出不断增加的趋势。2020年意大利学者甚至在人类胎盘中发现了直径为5~10 μm的微塑料[7]。微塑料污染已成为当前新的全球性环境污染问题。
因具有疏水性强、比表面积大等特性,暴露于环境中的微塑料容易被微生物快速定殖,并在其表面形成微生物膜[8]。Li等[9]发现北大西洋微塑料碎片表面上存在着丰富的微生物群落结构(包括自养生物、异养生物、捕食者和共生体),并将此命名为“plastisphere”(塑料圈)。红树林生态系统是以红树植物为主要群落的湿地生态系统。拥有发达根系的红树林可通过消浪、缓流、缠绕等作用来捕获或截留来自海陆环境中的塑料碎片。鉴于此,红树林湿地也被称为近岸海域(微)塑料的“捕集器”[10]。Xie等[11]在红树林系统中的微塑料和根系土壤中均检测出致病菌(副溶血性弧菌和埃希菌-志贺氏菌),并且发现二者之间的相互作用可能会影响红树林植物的生长代谢。目前,对于城市红树林系统中微塑料与微生物互作效应的研究非常缺乏,其中很多的科学问题仍不清楚。基于此,本研究以聚乙烯(PE)、聚苯乙烯(PS)、聚氯乙烯(PVC)和具有可降解性的聚乳酸(PLA)为基质,选择海南大学东坡湖红树林系统作为目标城市红树林系统,通过45 d的野外原位暴露实验,探讨城市红树林生态系统中微塑料表面细菌群落结构特征。以期为城市红树林生态系统健康评估、城市(微)塑料污染治理和政策制定提供参考依据。
1 材料与方法
1.1 材料
PE、PS、PVC和PLA等4种微塑料购买于安特塑胶原料有限公司,粒径约为1 mm。E.Z.N. TM Mag-Bind Soil DNA Kit提取试剂盒、Qubit 3.0 DNA检测试剂盒及细菌引物341F(CCTACGGGN GCWGCAG)和805R(GACTACHVGGGTATCTA TCC)均由生工生物工程(上海)股份有限公司提供和合成。其他试剂均为国产分析纯。
1.2 方法
1.2.1 野外原位暴露试验 本研究选取海南省海南大学东坡湖(20.06′ N,110.33′ E)作为微塑料暴露实验现场试验区。东坡湖的含盐度约为23%,适合海桑、红海榄、木榄、海莲等红树植物生长,该区域中红树林带宽约100 m,红树群落平均高度为2.5~3.5 m。试验开始之前,采用无菌水清洗微塑料表面,除去其表面附着的有机物和微生物,自然干燥后,将20~30 g不同类型的微塑料分别放入尼龙网纱袋于2020年7月投放于水体中。调节样品使其沉降到0.5 m水深处。暴露45 d后采集样品,分别标记为LPE、LPS、LPVC和LPLA,周边水域水样(记为L)为对照样品。用无菌水冲洗干净,分装后开展相关研究。
1.2.2 微塑料表面形貌观察 使用扫描电子显微镜(SEM,TESCAN MIRA3 LMH, Czech)观察微塑料表面生物膜的表面形貌。观察前,参照陈涛[8]的方法对样品进行预处理,观察时SEM的加速电压为1.5 kV。以原生微塑料样品作为空白对照组(CK)。
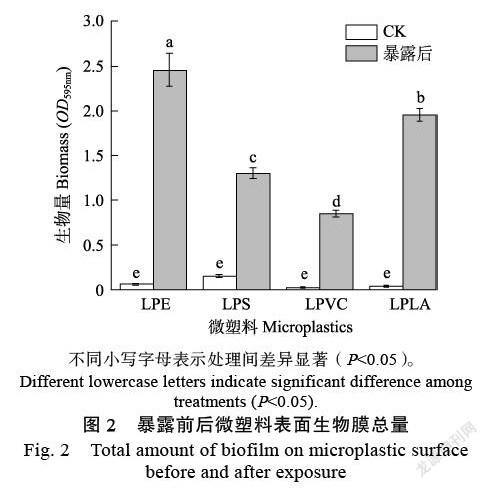
1.2.3 微塑料表面生物膜总量分析 使用结晶紫染色法分析测定微塑料表面生物膜的总量[8]。在分光光度计于595 nm下测定脱色液的吸光值,同时以95%乙醇作为空白。595 nm处的光密度(OD595nm)代表微塑料表面形成的生物膜总量。
1.2.4 微塑料表面生物膜DNA提取和测序 使用高通量测序技术分析微塑料表面生物膜细菌(扩增区域:16SV3-V4)的群落特征。PCR扩增体系:10~20 ng模板DNA,9~12 μL无菌水,1 μL Bar-PCR引物F、1 μL引物R、15 μL的2× ieff® Robust PCR Master Mix。PCR初始扩增条件:94 ℃ 3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5次循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20次循环;最后在72 ℃下进行5 min的最终延伸。PCR二次扩增条件:95 ℃ 3 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,5次循环。扩增产物经2%琼脂凝胶电泳初步筛选纯化,后续测序过程基于Illumins MiSeq平台由生工生物工程(上海)股份有限公司完成。
1.2.5 微塑料表面细菌群落结构多样性分析 对原始数据进行拼接、过滤等优化处理后,得到的有效序列数,以97%以上的相似性将序列聚类为操作分类单元(operational taxonomic units,OTUs)。检测不同类型的微塑料表面生物膜的Alpha多样性指数。Alpha多样性中的Ace和Chao指数,描述群落丰富度,指数越大表示群落的丰富度越高;Shannon和Simpson指数,描述细菌群落多样性;Shannon指数越大,Simpson指数越
小,表示细菌群落的多样性及均匀度越高。绘制不同类型微塑料表面细菌和周围水体的Venn图。根据湖水和微塑料样品的物种注释结果和OTUs序列信息,获得Bray-Curtis距离矩阵,对各样品间细菌菌落的Beta多样性进行进一步分析。绘制基于Bray-Curtis距离的热图、主协调分析(principal coordinated analysis,PCoA)和非度量多維校准分析(non-metric multidimensional calibration analysis,NMDS)图,进一步对暴露后的微塑料及周围水体中的微生物细菌群落结构相似性或差异性进行探究。
1.3 数据处理
采用Microsoft Excel 2019软件对相关数据进行处理;采用SPSS19软件进行数据统计分析,利用单因素分析(one-way ANOVA)来评估不同类型微塑料表面生物量之间的差异显著性;使用Origin 8.0软件和R语言软件制图。
2 结果与分析
2.1 暴露处理对微塑料表面形貌的影响
经过45 d原位暴露处理后,东坡湖城市红树林系统中的4种微塑料表面形貌发生了明显的变化。暴露处理前,4种微塑料的表面相对光滑(图1A~图1D)。暴露后,4种微塑料表面几乎都被不同形态微生物和颗粒物所覆盖(图1E~图1H)。LPE样品表面附着团聚体状的球状细菌、杆状细菌和沉积物颗粒(图1E),LPS样品表面清晰观察到其褶皱附近聚集着大量球菌、杆菌等(图1F),LPVC表面附着很多粒径相对较大的球状细菌(图1H)。LPLA表面汇集了密集成团的球菌以及少量的杆菌(图1G),同时还形成了大量的微孔结构,分析可能与附生细菌的降解作用有关。
2.2 暴露处理对微塑料表面生物膜的影响
由图2可知,经过一定时间暴露后,LPE、LPS、LPVC和LPLA微塑料表面生物膜的总量均显著高于原始微塑料(P<0.05),4种类型微塑料表面生物膜的总量差异显著(P<0.05),其OD595nm值大小依次为:LPE>LPLA>LPS>LPVC。
2.3 不同类型微塑料表面细菌群落结构多样性分析
对原始数据进行拼接、过滤等优化处理后,L、LPE、LPS、LPVC和LPLA得到的有效序列数分别为58 053、58 161、43 671、53 835和42 928条。所有处理的测序覆盖率均高于99%,且稀释曲线已趋于平缓,表明测序数据量大,样品测序完整。
L、LPE、LPS、LPVC和LPLA的OTUs数量分别为(579±29)、(2136±107)、(1949±97)、(2065± 103)和(1906±95)(图3)。各样品间OTUs数量表现为L<LPVC<LPS<LPLA<LPE,说明微塑料可从水环境中富集微生物,且微塑料的类型可能是影响微塑料表面微生物生长的重要因素之一。
4种不同类型微塑料表面生物膜总量和OTUs存在显著性差异,均表现为:LPE>LPLA>LPS> LPVC,说明塑料表面微生物群落结构特征与塑料材质类型有关。
2.3.1 Alpha多样性 经过单因素(ANOVA)检验(图4),不同类型的微塑料(LPE、LPS、LPVC和LPLA)表面生物膜的Alpha多样性指数与周围水体无显著性差异(P>0.05),且与塑料材质的差异不显著(P>0.05)。此外,暴露后微塑料样品的Chao、Ace和Shannon指数明显高于水体,Simpson指数低于水体,表明塑料圈上微生物群落较周边水环境丰富,且分布更均匀。
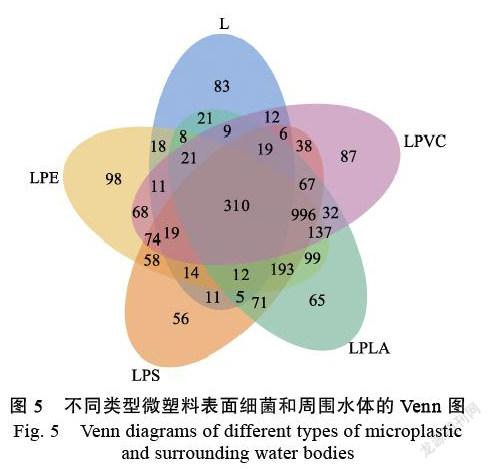
从图5可见,暴露于东坡湖后,微塑料表面细菌与其周围水体共享OTUs数目为310个,约占微塑料样品的15%~17%,表明微塑料表面有利于微生物的附着和生长,对水环境中微生物种群有选择性吸附和富集作用。此外,各样品也存在独有的细菌OTUs:东坡湖水(L)中83个(14.34%),LPE表面98个(4.59%),LPS表面56个(2.87%),LPVC表面87个(4.56%),LPLA表面65个(3.15%)。
2.3.2 Beta多样性 基于距离热图可发现(图6A),在OTUs水平上,暴露后的所有微塑料(LPE、LPS、LPVC和LPLA)與东坡湖水的距离均在0.92以上,说明微塑料表面细菌群落结构与东坡湖水中的差异显著。从PCoA和NMDS图可看出(图6B、图6C),PCoA1的解释度为52.08%,PCoA2的解释度为27.08%,PCoA1和PCoA2共解释了79.16%;湖水(L)中细菌群落与微塑料样品(LPE、LPS、LPVC和LPLA)间表现出较高的差异性,与距离热图结果一致。
2.4 不同类型微塑料表面细菌群落结构组成
基于OTUs聚类结果,得到各样品的细菌群落结构及其物种丰度的信息。本研究中共检测到14个门、23个纲、29个目、34个科及38个属。
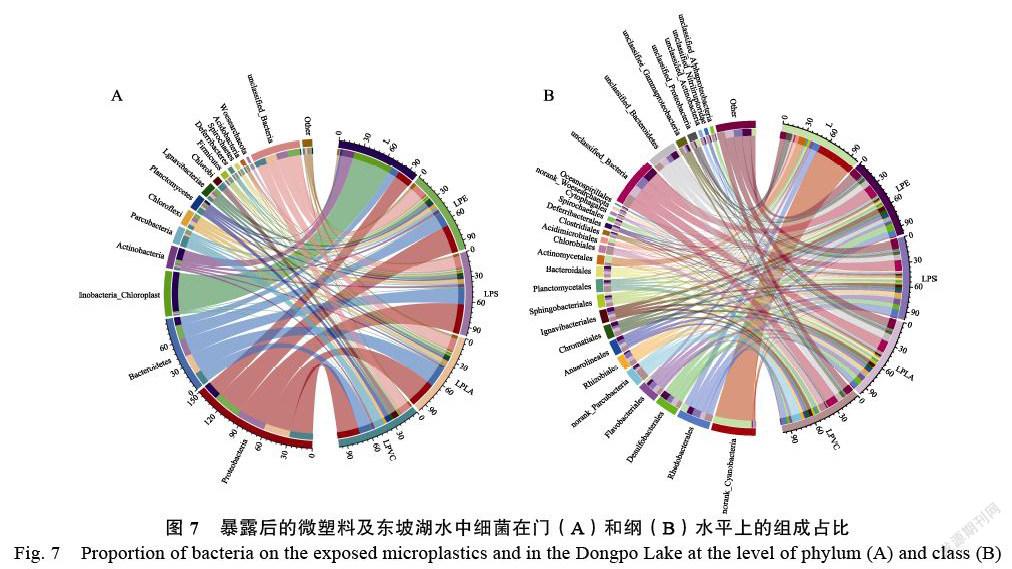
在门水平上(图7A),14个细菌物种群门均存在于水体和微塑料样品上,但样品间各物种的丰度明显不同。暴露于水环境中后,4种微塑料样品表面上优势菌门为变形菌门(Proteobacteria,28.07%~37.08%)和拟杆菌门(Bacteroidetes,15.85%~24.53%)。相比于其他3种微塑料,LPVC表面含有较为丰富的俭杆菌门(Parcubacteria,12.31%)和绿细菌门(Chlorobi,7.27%)。在东坡湖水中,丰度前4位的菌为蓝细菌门(Cyanoba¬cteria_Chloroplast,49.50%)、变形菌门(Prote¬obacteria,19.77%)、放线菌门(Actinobacteria,14.64%)和拟杆菌门(Bacteroidetes,10.33%),总计占比高达94.25%。此外,原位投放的微塑料表面的蓝细菌门和放线菌门在总量中的比例分别为0.91%~1.11%和2.59%~3.80%,这表明水环境中微生物在微塑料表面的定殖具有选择性。
从纲水平来看(图7B),LPE、LPS、LPVC和LPLA微塑料生物膜中的优势菌群为-变形杆菌纲(Alphaproteobacteria,10.04%~19.42%)、-变形菌纲(Deltaproteobacteria, 5.07%~11.63%)、γ-变形菌纲(Gammaproteobacteria,6.69%~10.15%)和黄杆菌纲(Flavobacteriia,3.01%~6.96%)。东坡湖水中蓝藻细菌纲(Cyanobacteria,49.35%)的丰度最高,其次是放线菌纲(Actin¬obacteria,14.64%)和-变形杆菌纲(Alphaprote¬obacteria,9.95%)。
3 讨论
本研究探讨了城市红树林生态系统中PE、PS、PVC、PLA等4种微塑料表面微生物群落结构特征。结果表明,暴露于城市红树林生态系统中的微塑料表面附着有大量的微生物,主要以球菌和杆菌为主,与前人的报道一致[9, 12-13]。具有较大比表面积的发泡类微塑料可从水环境中吸附蛋白质等营养物质,进而吸引更多的微生物在其表面定殖[9, 12]。4种不同类型微塑料表面生物膜总量和OTUs均表现为LPE>LPLA>LPS>LPVC。PLA的合成原料中包含淀粉、糖类等物质,可为环境中微生物的生长活动提供营养物质。在本研究中,PE微塑料为发泡类材质,PLA为可生物降解塑料,PS和PVC塑料是普通树脂颗粒,因此,发泡类PE和可生物降解的PLA更易于细菌微生物的快速定殖。基于Bray-Curtis距离的热图、PCoA和NMDS图分析显示,湖水(L)中细菌群落与微塑料样品(LPE、LPS、LPVC和LPLA)间表现出较高的差异性,暴露于城市红树林生态系统中后,LPS和LPLA距离最为靠近,说明LPS和LPLA微塑料表面生物膜的细菌群落结构相似。LPVC与其他微塑料样品相隔较远,表明LPVC微塑料表面生物膜具有不同的微生物细菌群落结构。从细菌群落的多样性分析结果可看出,微塑料的类型或结构是影响其表面定殖微生物群落多样性的关键因素之一。
本研究的微塑料表面除了微生物外,在SEM上还观察到大量的沉积物颗粒附着在微塑料表面,与Tu等[13]报道结果相似,这可能表明微塑料表面的部分微生物是来源于沉积物。在本研究中,未在微塑料的SEM图上观察到硅藻、丝状菌等微生物,这可能与暴露水环境的类型以及其中的微生物优势菌群有关联。此外,暴露后微塑料表面细菌群落的多样性显著高于水环境,表明微塑料可从城市红树林生态系统中选择性富集微生物,并为生长在该系统中的微生物提供新的栖息场所。本研究结果与Keswani等[14]报道一致,微塑料可以作为病原体、粪便指示生物和有害藻类在水生环境中持续存在和传输的重要载体。
在本研究中,变形菌门和拟杆菌门是微塑料表面细菌的优势菌群,其相对丰度分别占细菌群落的19.77%~37.08%和10.33%~24.53%。Jiang等[15]通过对长江口潮间带上微塑料表面生物膜的群落结构特征调查发现,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是主要的优势菌群。陈涛[8]发现暴露于烟台养马岛扇贝养殖区的微塑料表面微生物物种群门为33~43,其中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是绝对优势菌群。De Tender等[16]通过将塑料垃圾原位投放于比利时港口,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是PE微塑料表面的主要菌群。
随着微塑料表面生物膜的形成及悬浮性颗粒物的附着,表面颜色加深,其密度增加,粒径减小[8],进而使得其沉降速度加快[17]。此外,微生物作用可加速破坏微塑料物理化学结构的完整性,使得微塑料表面粗糙度增加,甚至出现裂痕[8]。相关变化进一步影响微塑料的表面风化、沉降、降解、与污染物的互作效应等一系列环境行为过程。
此外,暴露于水环境中的微塑料也是病原菌(如弧菌属、假单胞菌属等)的栖息场所[9, 13, 18]。栖息在城市红树林生态系统中的生物摄食或携带致病微生物后,将会对生物甚至人类构成重大威胁。因此,城市红树林生态系统中微塑料表面附着的致病菌的特征及微生物群落的定殖對微塑料环境行为的影响将是后续研究的重点。
参考文献
[1] Koelmans A A, Mohamed Nor N H, Hermsen E, et al. Mi-croplastics in freshwaters and drinking water: Critical re-view and assessment of data quality[J]. Water Research, 2019, 155: 410-422.
[2] Scopetani C, Chelazzi D, Cincinelli A, et al. Assessment of microplastic pollution: occurrence and characterisation in Vesijärvi lake and Pikku Vesijärvi pond, Finland[J]. Envi-ronmental Monitoring and Assessment, 2019, 191(11): 1-17.
[3] Sun J, Dai X, Wang Q, et al. Microplastics in wastewater treatment plants: Detection, occurrence and removal[J]. Wa-ter Research, 2019, 152: 21-37
[4] Van Cauwenberghe L, Devriese L, Galgani F, et al. Micro-plastics in sediments: a review of techniques, occurrence and effects[J]. Marine Environmental Research, 2015, 111: 5-17.
[5] Zhang G S, Liu Y F. The distribution of microplastics in soil aggregate fractions in southwestern China[J]. Science of the Total Environment, 2018, 642: 12-20.
[6] Vandermeersch G, Van Cauwenberghe L, Janssen C R, et al. A critical view on microplastic quantification in aquatic or-ganisms[J]. Environ Research, 2015, 143: 46-55.
[7] Ragusa A, Svelato A, Santacroce C, et al. Plasticenta: First evidence of microplastics in human placenta[J]. Envi-ronment International, 2021, 146: 106274.
[8] 陈 涛. 近海微塑料表面生物膜的形成及其对微塑料理化性质的影响[D]. 烟台: 中国科学院烟台海岸带研究所, 2018.
[9] Li R, Yu L, Chai M, et al. The distribution, characteristics and ecological risks of microplastics in the mangroves of Southern China[J]. Science of The Total Environment, 2020, 708: 135025.
[10] Naji A, Nuri M, Amiri P, et al. Small microplastic particles (S-MPPs) in sediments of mangrove ecosystem on the northern Coast of the Persian Gulf[J]. Marine Pollution Bul-letin, 2019, 146: 305-311.
[11] Xie H, Chen J, Feng L, et al. Chemotaxis-selective coloniza-tion of mangrove rhizosphere microbes on nine different microplastics[J]. Science of The Total Environment, 2021, 752: 142223.
[12] Rummel C D, Jahnke A, Gorokhova E, et al. Impacts of biofilm formation on the fate and potential effects of micro-plastic in the aquatic environment[J]. Environmental Sci-ence & Technology, 2017, 4(7): 258-267
[13] Tu C, Chen T, Zhou Q, et al. Biofilm formation and its influences on the properties of microplastics as affected by exposure time and depth in the seawater[J]. Science of The Total Environment, 2020, 734: 139237.
[14] Keswani A, Oliver D M, Gutierrez T, et al. Microbial hit-chhikers on marine plastic debris: Human exposure risks at bathing waters and beach environments[J]. Marine Environmental Research, 2016, 118: 10-19.
[15] Jiang P, Zhao S, Zhu L, et al. Microplastic-associated bac-terial assemblages in the intertidal zone of the Yangtze Estuary[J]. Science of the Total Environment, 2018, 624: 48-54.
[16] De Tender C, Devriese L I, Haegeman A, et al. Temporal dynamics of bacterial and fungal colonization on plastic de-bris in the north sea[J]. Environmental Science & Technology, 2017, 51(13): 7350-7360.
[17] Lagarde F, Olivier O, Zanella M, et al. Microplastic interac-tions with freshwater microalgae: Hetero-aggregation and changes in plastic density appear strongly dependent on po-lymer type[J]. Environmental Pollution, 2016, 215: 331- 339.
[18] 龔梦婷. 水体环境中微塑料表面的微生物群落结构分析[D]. 广州: 暨南大学, 2019.
责任编辑:黄东杰
