甜橙Dof基因家族鉴定与表达分析
2021-01-13杨杰陈蓉胡文娟吴巧玲佟晓楠李兴涛
杨杰 陈蓉 胡文娟 吴巧玲 佟晓楠 李兴涛





摘 要:为研究甜橙单锌指DNA结合蛋白(DNA binding with one zine finger, Dof)家族的进化关系和该家族成员在不同花期甜橙品种花芽和叶片的表达模式,利用甜橙基因组筛选鉴定CsDof基因家族成员,对甜橙Dof基因家族成员及启动子区进行生物信息学分析,并使用qRT-PCR检测不同花期甜橙品种中CsDof家族成员在成花时期的表达情况。共鉴定出24个CsDof基因家族成员,这些基因分布在甜橙的8条染色体上。系统进化树聚集为9个亚群,CsDofs被分在A、B1、B2、C1、C2.1、C2.2、D1和D2亚群,同一亚群的CsDofs具有相似的基因结构和基序分布。CsDofs启动子区域含大量的光响应元件和激素响应元件。qRT-PCR检测分析发现2个甜橙品种花芽和叶片组织中的CsDofs表达模式存在较大差异,对照品种‘纽荷尔’花芽和叶片中CsDof6、CsDof11、CsDof13、CsDof17和CsDof21表达量均高于早熟品种‘赣南早’,而‘赣南早’花芽和叶片中CsDof19和CsDof23表达量高于‘纽荷尔’,表明CsDofs在不同花期的甜橙中具有明显的品种表达特异性,推测CsDofs对甜橙开花时间起重要的调控作用。这些结果为阐明CsDof基因家族在甜橙花期调控中的功能提供了理论参考。
关键词:甜橙;Dof基因家族;生物信息学;基因表达
中图分类号:S666.4 文献标识码:A
Abstract: The DNA binding with one zine figer proteins (Dof) in Citrus Sinensis was identified by bioinformatics, and the evolution model and expression pattern were analyzed. Used the recently released upland C. Sinensis genomic data, Dof genes in C. Sinensis were identified by bioinformatic methods. The chromosomal localization, physicochemical properties, sequence characteristics, phylogeny, cis-acting elements and expression profile of Dof genes in C. Sinensis were systematically analyzed. We identified 24 Dof genes which were distributed on 8 chromosomes. The phylogenet-ic-tree was clustered into 9 subgroups, and CsDof genes were divided into A, B1, B2, C1, C2.1, C2.2, D1 and D2 sub-groups. The promoter region of CsDof genes contained a large number of light-responsive and hormone-responsive elements. The expression pattern of CsDof genes was different in buds and leaves of two sweet orange varieties by quantitative real-time PCR (qRT-PCR). The expression of CsDof6, CsDof11, CsDof13, CsDof17 and CsDof21 in ‘New-hall’ cultivars was higher than that in buds and leaves of ‘Gannan Zao’ cultivars, while that of CsDof19 and CsDof23 in ‘Gannan Zao’ cultivars was higher than that in buds and leaves of ‘Newhall’ cultivars. The CsDof genes had obvious specificity of variety expression in sweet orange at different flowering stages, it suggesting CsDof genes played an im-portant role in the regulation of flowering time. The results would provide references for clarifying the functions of CsDof gene family in the regulation of flowering stage.
Keywords: Citrus Sinensis; Dof gene family; bioinformatics; gene expression
DOI: 10.3969/j.issn.1000-2561.2021.12.013
单锌指DNA结合蛋白(DNA binding with one zine finger, Dof)是植物特有的转录因子,在调控其生长发育、开花周期等过程中发挥重要作用。Dof蛋白具有N末端高度保守Dof结构域和C末端转录调控域[1]。其中,Dof结构域为含有52个氨基酸残基的C2-C2型单锌指结构,可识别AAAG/CTTT顺式作用调控元件[2];C末端转录调控域具有不同氨基酸序列,表明其具備多种蛋白功能[3]。
Dof蛋白家族广泛存在于植物中,参与植物生长发育过程及抗逆反应,包括植物种子萌发、开花调控和非生物胁迫等[4]。目前,拟南芥[5]、水稻[6]、番茄[7]和玉米[8]等植物的Dof基因家族已被陆续鉴定。其中,部分Dof基因家族成员的功能已经被验证。AtCDFs通过控制光周期调控拟南芥花期[9],其在番茄中的同源基因也调控花期[10];AtDof5.8可提高拟南芥对干旱和盐胁迫的抗逆性[11];OsDof12调控长日照条件下水稻花期[12];ZmDof1可抑制Zm401的表达来调控玉米的花粉发育[13]。
甜橙(Citrus sinensis)作为柑橘中最主要的鲜食类群,营养丰富、口感清爽而广受消费者青睐。甜橙花器发育影响其果实熟期和产量,国家脐橙工程技术研究中心选育的特早熟甜橙品种‘赣南早’具有早花早结丰产的优点[14]。多年的研究结果发现,‘赣南早’甜橙的成花期比对照品种‘纽荷尔’提前10~20 d,果实熟期比纽荷尔提前30 d以上[15]。研究表明,在果树栽植培养过程中使其尽快开花,可使果实提早成熟[16]。因此,鉴定甜橙Dof基因家族成员,分析其进化和表达,以研究CsDof家族成员在甜橙早花诱导中的作用,对解析甜橙早花早结的分子机制提供重要启示。随着测序技术的发展,已从多个物种中鉴定出Dof基因家族成员,而至今鲜见甜橙基因组中Dof基因家族的鉴定及表达模式的报道。本研究利用Dof蛋白特征结构域Dof的隐马尔可夫模型在甜橙基因组中进行HMMER分析,鉴定CsDOf基因家族成员;对其基因序列、基因结构、蛋白理化性质、系统进化关系和顺式作用元件进行分析;通过qRT-PCR检测2个甜橙品种CsDofs在不同成花时期的相对表达情况,为研究CsDofs参与甜橙开花的调控作用提供参考。
1 材料与方法
1.1 材料
供试甜橙品种为‘赣南早’(Gannan Zao)和‘纽荷尔’(Newhall),由赣南师范大学国家脐橙技术研究中心提供。选取生长良好,长势一致的2个甜橙品种‘赣南早’和‘纽荷尔’(树龄为8年)花芽与叶片样品进行对比试验。分别于开花前120 d(T1)、90 d(T2)、60 d(T3)、30 d(T4)和0 d(T5)采集(3个重复)样品。经液氮冷冻后置于–80 ℃低温保存备用。
1.2 方法
1.2.1 样品RNA提取和反转录 Trizol法提取样品RNA[17],凝胶电泳检测提取情况,紫外分光光度计测定浓度和纯度,保留浓度范围高于100 ng/μL且OD260/OD280大于1.8的RNA样,使用反转录酶反转录合成cDNA,将其放入–20 ℃贮藏备用。
1.2.2 CsDof基因序列搜索及鉴定 在CPBD(http://citrus.hzau.edu.cn/)中下载甜橙基因组数据。以拟南芥Dof基因[5]作为查询序列,对甜橙蛋白序列进行BLASTp,期望值E-value<10-5检索甜橙Dof基因家族成员,在Uniprot数据库(https://www.uniprot.org/)中下载Dof-family模型(PF02701),使用HMMER软件对甜橙Dof蛋白进行搜索。此外,通过CDD(https://www.ncbi. nlm.nih.gov/cdd/term)、Pfam(http://pfam.xfam. org/)和InterPro(https://www.ebi.ac.uk/interpro/ search/sequence/)鉴定CsDof基因的蛋白完整性及蛋白质结构域,剔除保守结构域不完整的基因。得到的甜橙Dof基因家族成员按照其在染色体的位置依次进行命名。
1.2.3 生物信息学分析 利用在线软件EXpasy ProParam(https://web.expasy.org/protparam/)和ProComp(http://linux1.softberry.com/)数据库对CsDof基因的理生特性、亞细胞定位和蛋白亲疏水性进行预测;运用SOPMA预测CsDof蛋白的二级结构;使用在线工具Map MG2C(http:// mg2c.iask.in/mg2c_v2.0/)绘制CsDof基因在染色体上的分布图;使用Gene Structure Display Server 2.0(GSDS)软件对CsDof基因结构图进行可视化,同时使用MeMe分析软件(http://meme-suite. org/)对CsDof基因保守基序进行预测,设置预测motif数量为10,并绘制motif结构图。通过MEGA 6.0软件的邻接法来构建拟南芥Dof蛋白和甜橙Dof蛋白的系统进化树,bootstrapping设置为1000,其他均为默认值。提取转录起始位点上游2000 bp的序列作为CsDof基因的启动子序列,利用在线软件PlantCARE(http://bioinfor matics.psb.ugent.be/webtools/plantcare/html/)预测启动子序列上的顺式作用元件。
1.2.4 CsDofs组织表达分析 从CPBD数据库中下载最新的甜橙愈伤组织、花、叶片和果实的转录组数据,获取CsDofs相应的表达量,绘制CsDofs表达量热图。
1.2.5 实时荧光定量PCR(qRT-PCR)分析 基于CsDofs在不同组织的表达分析结果,使用Beacon Designer 7软件设计引物(表1),由生工生物工程(上海)股份有限公司合成。使用2×SYBR Green PCR Mix试剂配置反应体系,检测不同采集时间2个甜橙品种样品中CsDof基因家族成员的表达情况,选用柑橘ACTB作为内参基因。使用Light-Cycler 480荧光定量PCR仪进行qRT-PCR反应。反应体系10.0 l: 2×SYBR Green PCR Mix 5.0 l,上、下游引物各0.5 l,cDNA模板2.0 l,ddH2O 2 l。扩增程序: 95 ℃预变性1 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 30 s, 进行40个循环;95 ℃ 5 s,65 ℃ 1 min;40 ℃ 30 s。每个样品3次重复。采用2–CT法计算qRT-PCR试验结果,用SP-SS 19.0软件对实时荧光定量数据进行方差分析。
2 结果与分析
2.1 CsDof基因鉴定及命名
基于甜橙基因组,利用HMMER软件比对搜索种子文件(PF02701),得到候选蛋白序列,经过CDD和Pfam数据库验证保守结构域,使用InterPro软件对其进行确证,鉴定出24个甜橙Dof基因家族成员。根据CsDofs在不同染色体上的位置顺序,命名为CsDof1~CsDof24(表2)。
2.2 CsDof蛋白理化性质分析、亚细胞定位
CsDof蛋白理化性质如表3。CsDof基因家族成员编码的蛋白氨基酸数目为172~495,其中CsDof17最长,CsDof5最短;24个CsDof蛋白的等电点为5.24~9.37,CsDof9、CsDof12、CsDof13、CsDof14、CsDof16、CsDof17和CsDof19的等电点均低于7,为酸性蛋白,其余蛋白等电点高于7;分析表明24个CsDof蛋白均为亲水蛋白,但其分子量差异较大,最大的CsDof18有54.75 kDa,最小的CsDof5仅19.36 kDa;除CsDof4为稳定蛋白,其他均为不稳定蛋白;脂融指数在44.2~ 66.23,原子总数在2660~7514。亚细胞定位预测表明大多数CsDof蛋白定位于细胞核,仅CsDof3、CsDof6、CsDof7和CsDof8蛋白定位在细胞外。
2.3 CsDof蛋白二级结构预测结果
由表4可知,24个CsDof蛋白的二级结构均以无规则卷曲为主,所占比例为51.5%~86.5%;β-折叠所占比例均最小,为1.03%~7.29%。
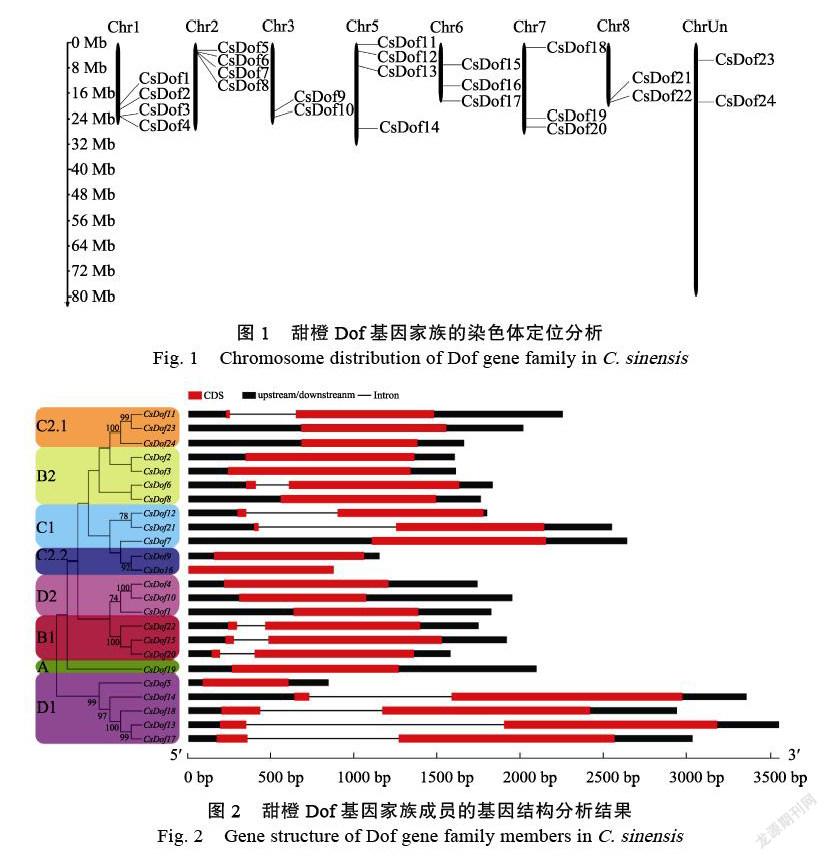
2.4 CsDof基因家族染色体定位分析
CsDofs在染色体上的位置如图1。24个CsDof基因分别分布在甜橙的Chr1、Chr2、Chr3、Chr5、Chr6、Chr7、Chr8和ChrUn上,其中Chr1、Chr2和Chr5上分布数量最多,均为4个;其次是Chr6和Chr7,为3个;Chr3、Chr8和ChrUn上数量最少,各有2个。
2.5 CsDof基因家族结构及蛋白保守基序分析
从图2所知,CsDof基因家族成员的基因结构相对简单,CsDofs不含或仅含有1个内含子;CsDofs外显子数量为1~2个。位于同一亚群的CsDofs具有相似的外显子-内含子分布结构。A、C2.2和D2中的基因均含有1个外显子;D1中除了CsDof5含有1个外显子,其他CsDofs均含有2个外显子。
在CsDof蛋白序列中发现10个保守基序(图3),属于同一亚群的CsDof蛋白保守基序的类型、数量和空间分布类似。Motif 1代表Dof结构域,所有CsDof蛋白都含有Motif 1;Motif 2、Motif 6、Motif 8和Motif 9仅分布在D1;Motif 4、Motif 5和Motif 10仅分布在C2.1。
2.6 CsDof基因家族系统发育进化分析结果
从图4可知,甜橙(24个)和拟南芥(36个)共60个Dof蛋白被分为9个亚群,分别为A、B1、B2、C1、C2.1、C2.2、C3、D1和D2亚群。除C3亚群不含CsDof蛋白,其余各亚群都包含CsDof蛋白,这与CsDof蛋白进化树的分组情况一致。D1亚群包含的CsDof蛋白个数最多,为5个;B2亚群次之,为4个;A亚群最少,仅有1个。
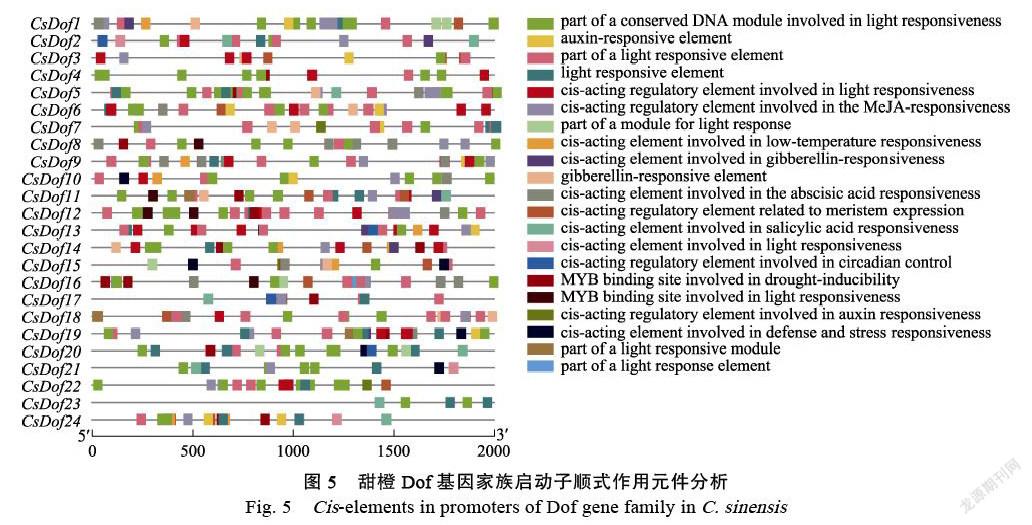
2.7 CsDOf基因家族顺式作用元件分析结果
CsDofs启动子区的顺式作用元件分析结果如图5,CsDofs启动子序列主要包括光响应元件、激素響应元件、非生物胁迫响应元件和调节生长发育的响应元件。其中激素响应元件含生长素响应元件、茉莉酸甲酯响应元件、赤霉素响应元件、水杨酸响应元件和脱落酸响应元件;非生物胁迫响应元件包括干旱胁迫响应元件、低温胁迫响应元件和参与应激反应响应元件;调节生长发育的响应元件中有分生组织表达响应元件和昼夜节律控制响应元件。在上述响应元件中光响应元件、生长素响应元件、茉莉酸甲酯响应元件及低温胁迫响应元件的数量显著多于其他调控元件。说明CsDofs在响应光调控、逆境胁迫以及响应体内激素平衡过程中发挥重要作用,继而推测其在控制甜橙成花时期中发挥作用。
2.8 CsDof基因家族在不同组织表达分析
利用甜橙的转录组数据绘制了CsDofs在愈伤组织、花、叶片和果实中的表达热图(图6)。CsDof13、CsDof14和CsDof17在甜橙愈伤组织中高表达;CsDOf6、CsDof11、CsDof13、CsDOf17、CsDof19、CsDof21和CsDOf23在甜橙花和叶片中优势表达,其中,CsDof19在花中的表达量高于其他组织;在甜橙果实中高度表达的基因有CsDof11、CsDof13、CsDof14、CsDof17、CsDof18、CsDof21和CsDof23。CsDof13和CsDof17在4个组织的表达均较高;CsDof11、CsDof21和CsDof23在花、叶片和果实中表达均较高。
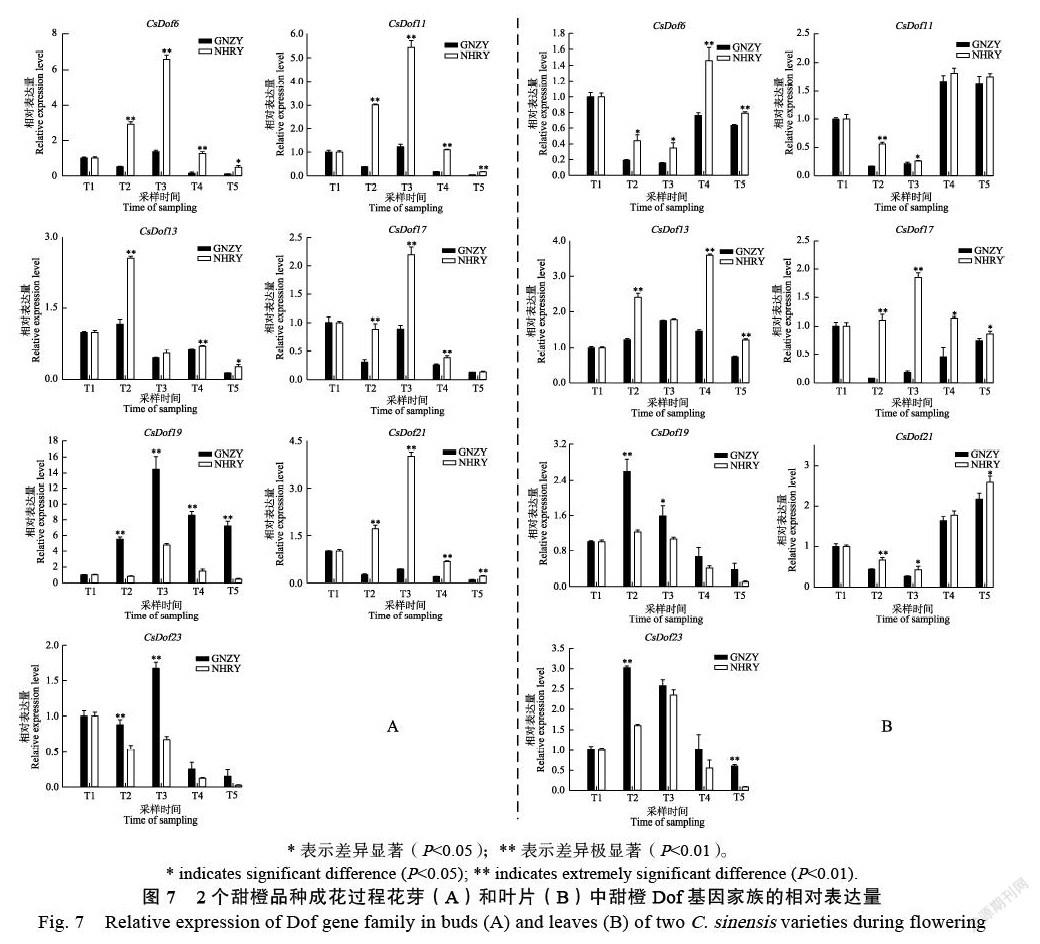
2.9 CsDof基因家族表达特异性分析结果
使用qRT-PCR检测‘赣南早’和‘纽荷尔’2个甜橙品种中CsDOf6、CsDof11、CsDof13、CsDOf17、CsDof19、CsDof21和CsDOf23的时空表达差异(图7),7个CsDof基因在2个甜橙品种的花芽和叶片中均表达。各时期CsDof6、CsDof11、CsDof13、CsDof17和CsDof21在花芽和叶片中的相对表达量,对照品种‘纽荷尔’均高于早熟品种‘赣南早’,而CsDof19和CsDof23是‘赣南早’高于‘纽荷尔’。本研究推断CsDofs可能具有调控甜橙成花时期的作用机制。
3 讨论
3.1 CsDofs进化特性
通过统计分析发现Dof基因家族成员在不同植物中数量差异较大,如拟南芥有36个,番茄有34个,水稻则仅有30个[18]。本研究利用CPBD的甜橙基因数据库对Dof基因家族进行了全面分析,共鉴定出24个CsDof基因家族成员。甜橙Dof家族成员之间外显子-内含子分析存在较大的差异,CsDofs外显子数量在1~3之间,有37%的CsDofs没有内含子,基因结构相对简单。这与拟南芥、水稻、小麦和黄瓜等植物的研究结果[8,19-20]相类似,表明Dof基因家族成员的基因结构在不同物种中高度保守,推测这些Dof蛋白可能具有相似的调控功能。同一亚群的大多数基因的保守基序分布模式相类似[21],我们发现聚集在同一亚群的CsDofs有类似的保守基序类型、数量和顺序。此外,保守基序1(Motif 1)存在于所有CsDofs,与拟南芥、水稻的研究结果[8]相吻合。
系统发育分析表明,CsDofs被分为8个亚群,而AtDofs被分为9个亚群。CsDofs未与C3亚群的AtDofs聚在一起;B1亚群含有3个CsDofs,5个AtDofs;甜橙中B2亚群含有4个CsDofs,拟南芥仅有3个AtDofs。这些结果表明,CsDofs和AtDofs经历了不同的复制事件。此外,D1亚群含CsDofs和AtDofs的数量最多,与SiDofs[22]和MaDofs[23]中基因的聚集优势相似。
3.2 CsDofs响应不同组织部位及不同开花期的表达分析
同一基因在同物种不同组织的表达情况存在差异,在不同物种的表达特性不同,具有组织表达特异性。研究表明,Dofs在黄瓜根、茎、叶子、雄花、雌花和卷须均有表达,但17个成员在根中有较高表达,其中CsaDof06、CsaDof13、CsaDof14、CsaDof17、CsaDof21和CsaDof23仅在根中表达,表明这6个基因可能在黄瓜根系发育中起着特定的作用[18]。OsDof11和OsDof30在水稻根、茎、叶、种和苗中均表达,但在叶中表达量最高,推测这2个基因可能参与水稻叶片的发育[1]。小麦中发现,Cluster I中的7个基因在叶片、茎和穗中表现出较高的表达水平,尤其是在发育早期。本研究对甜橙不同组织器官中的转录组数据分析表明,CsDofs在4个器官中均有表达。其中,大部分CsDofs在花朵和叶片中表达量较高,除CsDof17外的所有成员在愈伤组织中均较低表达,少部分在果实中表达较高。推测CsDofs在甜橙叶片、花朵、果实和愈伤组织各自发育过程中发挥一定的调控作用,但具体的功能机制需进一步研究。
花组织高表达的CsDofs在2个甜橙品种成花期花芽和叶片中5个不同时期均检测到表达,发现同时期CsDof6、CsDof11、CsDof13、CsDof17和CsDof21在对照品种‘纽荷尔’花芽和叶片中均显著高表达;而同时期的CsDof19和CsDof23在早熟品种‘赣南早’花芽和叶片中优势表达。推测,CsDofs在调控甜橙开花周期中发挥重要作用。前人研究也表明,将AtCDF1超量表达会抑制拟南芥开花[18];转OsDof12水稻在长日照条件下会提早开花[19]。本研究利用CPBD的甜橙基因数据库对CsDof基因家族进行全面分析,为研究其调控开花时间的功能机制提供一定依据。在后续的研究中,应克隆花中高表达CsDof家族成员,分析其在成花周期下的表达模式,及通过调控该基因影响甜橙成花周期的分子机制。
4 结论
本研究使用生物信息学方法从甜橙基因组鉴定出24个CsDofs,预测其蛋白长度为在172~495,蛋白质分子量为在19.36~54.75 kDa,含10个保守基序。CsDofs被划分为8个亚群,其成员可响应光调控和多重逆境胁迫。CsDofs具有组织表达特异性,部分CsDofs在甜橙花中高表达,但是高表达的CsDofs在不同花期甜橙品种的成花过程中瞬时表达又有差异,显示CsDofs对甜橙成花起重要的调控作用。
参考文献
[1] 周淑芬, 颜静宛, 刘华清, 等. 水稻Dof基因家族的组织表达谱及胁迫诱导表达特征分析[J]. 分子植物育种, 2012, 10(6): 635-643.
[2] 张焕欣, 李国权, 杨惠栋, 等. 甜瓜Dof家族全基因组鉴定与表达分析[J]. 园艺学报, 2019, 46(11): 2176-2187.
[3] 成 亮, 刘宝玲, 刘 盼, 等. 青狗尾草Dof基因家族的全基因组鉴定及组织特异性表达分析[J]. 分子植物育种, 2018, 16(13): 4226-4234.
[4] 琚龍贞, 赵 汀, 方 磊, 等. 陆地棉Dof基因家族的全基因组鉴定及分析[J]. 棉花学报, 2020, 32(4): 279-291.
[5] Yanagisawa S. The Dof family of plant transcription fac-tors[J]. Trends in Plant Science, 2002, 7(12): 555-560.
[6] Lijavetzky D, Carbonero P, Vicente-Carbajosa J. Genome- wide comparative phylogenetic analysis of the rice and Ara-bidopsis Dof gene families[J]. BMC Evolutionary Biology, 2003, 3(1): 631-637.
[7] 蔡晓锋. 番茄Dof基因家族全基因组分析及SlDof22、SlDHAR1和FaGalUR在AsA积累中的功能分析[D]. 武汉: 华中农业大学, 2014.
[8] 葛 敏, 吕远大, 李 坦, 等. 玉米Dof转录因子家族的全基因组鉴定与分析[J]. 中国农业科学, 2014, 47(23): 4563-4572.
[9] Fornara F, Panigrahi K C, Gissot L, et al. Arabidopsis DOF transcription factors act redundantly to reduce CONSTANS expression and are essential for a photoperiodic flowering response[J]. Developmental Cell, 2009, 17: 75-86.
[10] Corrales AR, Nebauer S G, Carrillo L, et al. Characterization of tomato cycling Dof factors reveals conserved and new functions in the control of flowering time and abiotic stress responses[J]. J Exp BotJournal of Experimental Botany, 2014, 65: 995-1012.
[11] He L, Su C, Wang Y C, et al. ATDOF5.8 protein is the up-stream regulator of ANAC069 and is responsive to abiotic stress[J]. Biochimie, 2015, 110: 17-24.
[12] Iwamoto M, Higo K, Takano M. Circadian clock-and phy-tochrome-regulated Dof-like Gene, Rdd1, is associated with grain size in rice[J]. Plant Cell Environ, 2009, 32: 592-603.
[13] Chen Y, Cao J. Comparative analysis of Dof transcription factor family in maize[J]. Plant Molecular Biology Reporter, 2015, 33(5): 1245-1258.
[14] 钟八莲, 赖晓桦, 杨斌华, 等. 纽荷尔脐橙芽变早熟品种——赣南早脐橙[J]. 中国南方果树, 2013, 42(2): 48-51.
[15] 易 龙, 夏宜林, 李双花. ‘赣南早’与‘纽荷尔’脐橙对柑橘衰退病病毒变异的影响[J]. 园艺学报, 2017, 44(11): 2179-2185.
[16] 江国良. 枇杷在四川不同生态型区的生态适宜性及调控技术研究[D]. 雅安: 四川农业大学, 2011.
[17] 慈晓彤, 石 辰, 王大玮, 等. 云南栘[木衣]叶片总RNA提取方法的比较与改进[J]. 西北林学院学报, 2020, 35(03): 95-99.
[18] 刘 俊, 金 钰, 吴耀松, 等. 植物Dof基因结构特点及功能研究进展[J]. 生物技术通报, 2020, 36(10): 180-190.
[19] Liu Y, Liu NN, Deng X, et al. Genome-wide analysis of wheat DNA-binding with one finger (Dof) transcription fac-tor genes: evolutionary characteristics and diverse abiotic stress responses[J]. BMC Genomics, 2020, 21(1): 549-562.
[20] Wen CL, Cheng Q, Zhao LQ, et al. Identification and cha-racterization of Dof transcription factors in the cucumber genome[J]. Scientific Reports, 2016, 6(1): 23072.
[21] 牟艺菲. 小麦OPR和LOX基因家族的鑒定及其抗逆功能分析[D]. 杨凌: 西北农林科技大学, 2019.
[22] Cai X F, Zhang Y Y, Zhang C J, et al. Genome-wide Analy-sis of Plant-specific Dof transcription factor family in tomato[J]. Journal of Integrative Plant Biology, 2013, 55(6): 552-566.
[23] Feng B H, ,Han Y C, Xiao Y Y, et al. The banana fruit Dof transcription factor MaDof 23 acts as a repressor and inte-racts with MaERF9 in regulating ripening-related genes[J]. Journal of Experimental Botany, 2016, 67(8): 2263-2275.
责任编辑:沈德发
