“十三五”我国西瓜遗传育种研究进展
2021-01-13刘文革

摘 要:“十三五”期间,我国在西瓜基础与应用研究领域取得了重要进展。在选育一批优质抗逆西瓜新品种的同时,结合基因组、转录组、代谢组等多组学对西瓜植株和果实等重要性状进行了系统研究。系统总结了“十三五”以来我国在西瓜重要农艺性状的基因定位研究、代谢品质研究、育种技术创新、新品种选育等方面取得的重要进展,并对我国西瓜遗传育种工作进行了展望。
关键词:西瓜;生物技术;遗传育种
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2021)12-001-09
Abstract:During “the 13th Five-Year Plan” period, watermelon basic and applied research was developed rapidly in China. A batch of high-quality and stress-tolerance new watermelon varieties have been bred. A systematic research work of important traits such as watermelon plants and fruits was carried out in combination with a variety of technical methods such as genome, transcriptome, and metabolome. This paper systematically summarized the latest progress made in the past 5 years from the aspects of activating research on watermelon gene mapping of important agronomic traits of watermelon, metabolic of fruit quality, transgenic and gene editing technology, new variety selective breeding, etc. The paper also analyzed the existing problems and prospected in genetic breeding of watermelon and prospected the future works in China.
Key words:Watermelon; Biological technology; Genetic breeding
1961—2019年,我國西瓜种植面积从54万hm2增加到147万hm2,增加了1.7倍,2019年种植面积占世界总面积的47.7%,西瓜总产量从655万t增加到6086万t,增加了8.3倍,2019年总产量占全世界总产量的60.6%(FAO)。西瓜遗传育种研究获得了国家重点研发计划、国家西甜瓜产业技术体系、国家自然科学基金以及地方产业技术体系等多个项目的支持,经过广大科研工作者的努力,在西瓜基础研究、育种技术、育种材料创制和新品种选育等方面取得了令人瞩目的进展。创建了西瓜分子标记聚合育种技术,并且在基因编辑技术上实现突破;创新出一批优良的育种材料,育成多个优质抗逆西瓜新品种,并在生产上大面积推广应用,促进了西瓜产业的快速发展。
1 西瓜重要农艺性状功能基因挖掘研究
随着西瓜基因组数据库的公布 [1],西瓜重要农艺性状的研究取得了快速发展。2019年,随着414份代表性西瓜种质资源的重测序工作的完成,使得在自然群体水平上进行全基因组关联分析(GWAS)成为了现实[2]。至此,遗传图谱构建、集群分离分析法(BSA)以及GWAS成为对主要农艺性状进行基因定位的重要正向遗传学手段,并在西瓜株型、果实外观、果肉品质、西瓜种子等主要农艺性状的基因定位中取得了重要进展,对西瓜优质抗病简约化分子育种应用具有重要意义。
1.1 植株性状的遗传与基因定位研究
西瓜短蔓和无杈性状有益于简约化和集约化栽培。Haileslassie[3]发现西瓜短蔓为单基因控制的隐性性状,并通过BSA将候选区间定位于9号染色体8.525 kb的区间范围内,发现Cla015407可能是控制西瓜节间长度的候选基因;Zhu等[4]通过二代测序和BSA-seq将Cldw-1基因定位在9号染色体上107.00 kb 的候选区域,其中Cla010337的表达水平在矮株系 WM102 中测试的所有组织中均显着降低;Haileslassie[3]发现西瓜叶色后绿性状受单个隐性基因(dg)控制,并将dg基因精细定位到3号染色体一个53.54 kb的区域内,表明ClCG03G010030可能是控制西瓜叶色后绿的候选基因;Dou等[5]鉴定了一个由单个隐性基因控制的侧向无枝性状,命名为Clbl,进行BSA-seq和连锁分析后将Clbl定位在西瓜4号染色体上一个9011 bp的候选区域,其中仅包含一个编码TERMINAL FLOWER 1蛋白的候选基因Cla018392。这些为西瓜植株性状的遗传规律与基因调控研究提供了理论依据。
1.2 果实外观性状的遗传与基因定位研究
西瓜果实外观品质包括果形、果皮颜色、花纹和蜡粉等。在西瓜果形的研究上,Dou等[6]发现西瓜果形长、圆受单基因控制,表现不完全显性遗传,在BSA和GWAS的基础上,证明了Cla011257基因在控制西瓜果形长、圆时潜在的功能。果皮颜色是影响西瓜商品价值的重要因素,Dou等[7]将与黄色果皮相关的位点定位到4号染色体1~58.8 kb范围内;Li等[8]通过构建高密度遗传图谱将控制墨绿色和浅绿色果皮的位点定位到8号染色体 142.7~154.7 cM范围内,并获得了可能的候选基因ClCG08G017810。此外,对西瓜果实表皮蜡粉等外观性状的研究也取得了一定的进展[9]。
1.3 果肉品质性状的遗传与基因定位研究
果肉颜色、果实硬度、风味(甜味、酸味、苦味)等农艺性状是西瓜育种的重要选择目标。在西瓜果肉颜色性状的研究上,Li等[10]确定了一个调控西瓜的鲜红色果肉颜色的显性基因Y scr,将Y scr定位到6号染色体上的一个小区域;Wang等[11]表明红肉颜色是由一个调节红色和淡黄色色素沉淀的隐性基因控制的,通过精细定位发现第4号染色体上两个候选基因Cla005011和Cla005012,其中Cla005011为番茄红素β-环化酶基因的关键位点,Cla005011的表达差异并不是COS和LSW-177果肉颜色变化的主要原因; Zhang[12]通过图谱克隆和转基因分析,鉴定了一个控制西瓜果肉颜色的番茄红素b-环化酶(ClLCYB)基因,ClLCYB的下调使肉色由淡黄色变为红色,ClLCYB的过表达使肉色变为橙色,ClLCYB内的天然错义突变影响了ClLCYB蛋白的丰度,促进了西瓜红肉颜色的发展;此外,刁卫楠等[13]丰富了对西瓜柠檬黄色果肉的研究。在果实硬度研究方面,高磊等[14]对西瓜果肉硬度主效基因进行精细定位,将其精细定位在西瓜6号染色体上,发现木葡聚糖内糖基转移酶基因Cla004119和乙烯响应元件Cla004120可能是控制西瓜果肉硬度的关键基因。ANEES等[15]结合转录组的数据对果实硬度的转录调控进一步完善,并挖掘到了8个候选基因。在果实风味物质的研究中,高磊等[14]对西瓜果实酸味性状主效基因精细定位,将基因定位在西瓜6号染色体上,发现仅有Cla009218和Cla009226两个基因在不同果实酸味的材料中差异表达,可能对西瓜果实中有机酸的积累起决定作用;Gong等[16]发现苦味是显性性状,并结合遗传图谱和精细定位推测基因Cla011508为控制西瓜果实苦味的候选基因;Ren等[17]表明棉子糖(Raf)家族寡糖(RFOs)是瓜类维管束中主要的转运糖,确定碱性半乳糖苷酶ClAGA2为水苏糖(Sta)和Raf水解的关键调控因子,并确定其在维管束中特异性表达,证实了ClAGA2控制果实Raf水解,降低果实中糖含量;Ren等[18]发现一个假定的液膜糖转运基因(ClTST2)编码一个液泡膜基因,该基因的表达与西瓜果肉细胞液泡膜对糖的吸收和积累有关。目前与风味相关的代谢物不断地被挖掘,为提升西瓜品质提供了有效的数据支撑。
1.4 西瓜种子性状的遗传与基因定位研究
西瓜种子性状包括种子大小、颜色等。Li等[19]构建了一张西瓜高密度遗传图谱,将控制种皮颜色(黑色vs浅黄)的候选基因进行了精细定位,候选基因被缩小到3号染色体上70.2 kb的区间内,区间内Cla019481为编码多酚氧化酶,可能催化多酚类物质生成黑色素。Luan等[20]对11个候选基因进行了测序,预测蛋白质Cla007520 可能与促进胚珠发育中的外被细胞增殖有关;Gao等[21]构建了西瓜GBS高密度遗传图谱,在2号染色体同一区域内鉴定到2个QTLs SW2.1和20 SWT2.1,其解释率为35.52%~50.10%。此外,在2号、6号等染色体上也获得了与西瓜种子大小相关的QTL或者候选基因[22-23](表1)。
2 西瓜代谢组学研究进展
代谢组学的概念由科学家于20世纪90年代中期提出。西瓜中丰富的营养物质不但为人体提供了糖类等重要的能量来源,而且在预防与治疗疾病等方面也有重要作用。西瓜中富含的蔗糖、葡萄糖和果糖等糖类代谢物能够满足人体的能量需求[11]。类胡萝卜素是一类四萜类化合物,他们不仅仅参与西瓜果实瓤色的形成,同时在清除自由基,预防心血管疾病和癌症等方面起到重要作用[25]。瓜氨酸等代谢物则在促进人体血液循环、治疗男性性功能障碍等方面具有良好效果[26]。多种功能性代谢物的存在使得西瓜果实的代谢组学研究具有重要的意义。笔者将重点对转录和代谢联合分析解析西瓜果实风味和代谢物在物种驯化进程中的变化情况进行介绍,以期为西瓜果实风味代谢物育种提供代谢水平的见解。
2.1 转录组和代谢组联合分析解析西瓜果实风味
西瓜果实风味与代谢物密不可分。果实的风味由味道和气味构成[27],糖类和有机酸的比例是衡量果实味道的重要的代谢物。Gao等[28]以203Z(母本)和PI 271769(父本),然后经过7次回交和4次自交后获得了具有酸甜口感的特色型西瓜新品种SW。UMER等[29]进一步对该品种以及203Z在果实发育过程中的糖类和有机酸的含量进行了测定,结果表明苹果酸和柠檬酸是导致果实酸味差异的重要代谢物,蔗糖、果糖以及葡萄糖则对果实的甜味具有重要的贡献,这些代谢物的综合作用形成了西瓜的酸甜口感。Yuan等[30]对白、金黄、橙、粉和大红5种瓤色西瓜3个关键发育时期的13种类胡萝卜素的含量进行了测定,明确了不同类胡萝卜素对不同瓤色西瓜的贡献情况,Zhang等[12,31]进一步通过基因编辑和体外验证等试验证实了ClPHT4;2和Lcyb在调控类胡萝卜素积累进程中的重要作用,为不同瓤色之间颜色与风味差异提供了分子见解。此外,Gong等[32]对西瓜果实发育过程中73种重要的初级代谢物进行相关性分析,发现这些代谢物之间大多与具体正向积累模式的糖类代谢物具有相似的积累模式,说明初级代谢物之间可能通过参与糖酵解和TCA循环等代谢活动共同参与西瓜味道的形成。对西瓜果实风味的研究往往集中在对挥发性有机化合物的研究方面,Gong等[27]在Crimson西瓜果实发育的4个时期共检测到了74种挥发性有机化合物,并进一步对代谢物积累模式进行分析,认为香叶基丙酮、2,6-壬二烯醛等11种挥发性代谢物是西瓜风味形成的关键代谢物。对西瓜风味的研究只是开始,还需要进一步加强。
2.2 西瓜中重要代谢物的驯化进程研究
与野生西瓜相比,栽培西瓜糖类的增加、苦味的消失以及果肉颜色更加丰富是驯化与改良进程的重要特征[32]。Guo等[2]通过对414份西瓜种子的重测序,挖掘到了调控西瓜果实含糖量等重要农艺性状的关键基因,揭示了人工选择进程对西瓜糖分提升所起到的重要作用。Ren等[18]对400份西瓜资源进行了重测序与糖含量的测定,并进一步分析发现ClTST2的表达增加是西瓜驯化中的一个主要分子事件,与该基因启动子周围的选择扫描有关;ClNAC68也被證明在调控含糖量方面起到一定的作用[33]。西瓜果实的苦味与葫芦素的积累有关[34],Gong等[32]结合不同发育时期的数据发现,栽培品种中没有检测到葫芦素,而野生品种中,糖基化的葫芦素E等物质是造成野生西瓜果实苦味的根本原因。Yuan等[35]对6种不同类型的西瓜进行了代谢谱的测定,共发现了431种差异积累的代谢物,并进一步发现芹菜素6-C-葡萄糖苷、木犀草素6-C-葡萄糖苷、柚皮素C-己糖苷和蔗糖等代谢物是在栽培西瓜和野生西瓜之间最主要的差异代谢物,黏籽西瓜和栽培西瓜之间具有较为相似的代谢物积累模式,暗示着在驯化进程中这两种类型的西瓜间可能存在更为相近的关系。总之,代谢物为西瓜的驯化与改良研究提供了更为可靠的数据支撑。
3 西瓜遗传转化技术的研究进展
西瓜分子育种是西瓜遗传转化育种中的重要一环,是研究西瓜基因功能和改良西瓜品种的重要手段。在西瓜中进行遗传转化的主要方式仍然是农杆菌介导的遗传转化,但西瓜转基因技术的主要瓶颈仍然是转化效率低。Liu等[36]、张曼等[37]和Vasudevan等[38]优化了农杆菌介导的转化方式,为西瓜的高效遗传转化和分子育种奠定了基础。随着西瓜中遗传转化体系的不断完善,目前在西瓜中进行了品质、抗病抗逆和株型等相关基因的功能验证。此外,CRISPR/Cas9等基因编辑技术也运用到了西瓜功能基因的研究中。
3.1 西瓜转基因技术研究
在西瓜果实品质研究方面,Ren等[18,39]将甜性性状的液膜糖转运基因(ClTST2)和新型液泡糖转运体ClVST197在白瓤半野生型的西瓜中分别过表达,发现均能提高转基因株系果肉糖含量。Zhang等[12]认为西瓜ClLCYB基因的错义突变引起西瓜果肉的白、黄和红等3种颜色的变化。研究发现ClLCYB基因的下调表达导致果肉颜色从淡黄色变为红色,而红色果肉中的 ClLCYB 过表达导致果肉颜色变为橙色。Zhang等[31]从西瓜中分离出了一种有色体磷酸盐转运体基因(ClPHT4;2),酵母缺陷体中异源表达和干扰试验表明该基因编码的Pi转运蛋白具有促进果肉类胡萝卜素积累以及响应外源ABA、乙烯和葡萄糖等调控的作用。在抗逆研究方面,Yang等[40]从西瓜中分离出了一种冷诱导的ClCASPL基因,异源表达CICASPL基因能够增强冷胁迫感知的敏感性,而atcaspl4c1突变体对冷胁迫具有较强的耐受性。Zhang等[41]发现西瓜中的AopP 基因能够与植物免疫响应因子ClWRKY6互作,负向调控ClWRKY6的转录水平和翻译水平,并降低植物的免疫反应。He等[42]发现异源表达的ClHSP22.8基因增强了植株感知ABA的敏感性和降低了耐盐性。Shi等[43]发现西瓜中交替氧化酶(ClAOX)基因由于单核苷酸发生突变而具有两种亚型,分别为ClAOX k和ClAOX n,异源表达的ClAOX k比拟南芥aox1a突变体和ClAOX n的耐寒性强。在株型转基因研究方面,Shi等[44]发现西瓜中异源表达的ClTCP14a和ClTCP15基因能够调控植株高度;Wei等[45]证实了GA3ox基因的移码突变引起了西瓜的矮化。
3.2 西瓜基因编辑技术研究
基因编辑技术的成熟使西瓜的基因编辑技术也获得了重大突破,为西瓜功能基因的研究和种质资源的定向改良奠定了基础[46]。Tian等[47]首次在西瓜的基因编辑技术上取得突破,成功利用CRISPR/ Cas9编辑了西瓜的八氢番茄红素去饱和酶基因(ClPDS),获得了基因敲除的西瓜白化苗。随后,Tian等[48]利用CRISPR/ Cas9定点编辑了西瓜的乙酰乳酸合成酶基因(ALS)基因的单核苷酸位点,成功将ALS 蛋白的第190位的脯氨酸突变成了丝氨酸,发现纯合后的als突变体获得了抗磺酰脲类除草剂的特性。此外,Ren等[39]利用CRISPR/ cas9编辑了液泡糖转运体基因ClVST197后,发现 clvst197突变体的叶片光合效率下降且含有更多的淀粉,证实了ClVST197蛋白具有显著的糖转运能力。Zhang等[49]利用CRISPR/ Cas9对西瓜的Clpsk1基因进行基因编辑并获得了抗白粉病的clpsk1突变体。Ren等[17]同时将西瓜中ClAGA2、ClSWEET3和ClTST2基因敲除后,显著影响了果实中糖的积累量,证实了ClAGA2、ClSWEET3和ClTST2等3个基因在糖分积累中的作用。Wang等[50]系统靶向并突变了西瓜ABA合成相关基因β-葡萄糖苷酶(BGs),发现BG1基因具有调控种子大小和促进种子发芽的作用。随着西瓜中转基因和基因编辑技术研究的不断推进,有望通过定点编辑技术改良西瓜重要的农艺性状,进而培育出综合性状优良的超级西瓜新品种。
4 西瓜种质资源评价筛选与育种材料创新
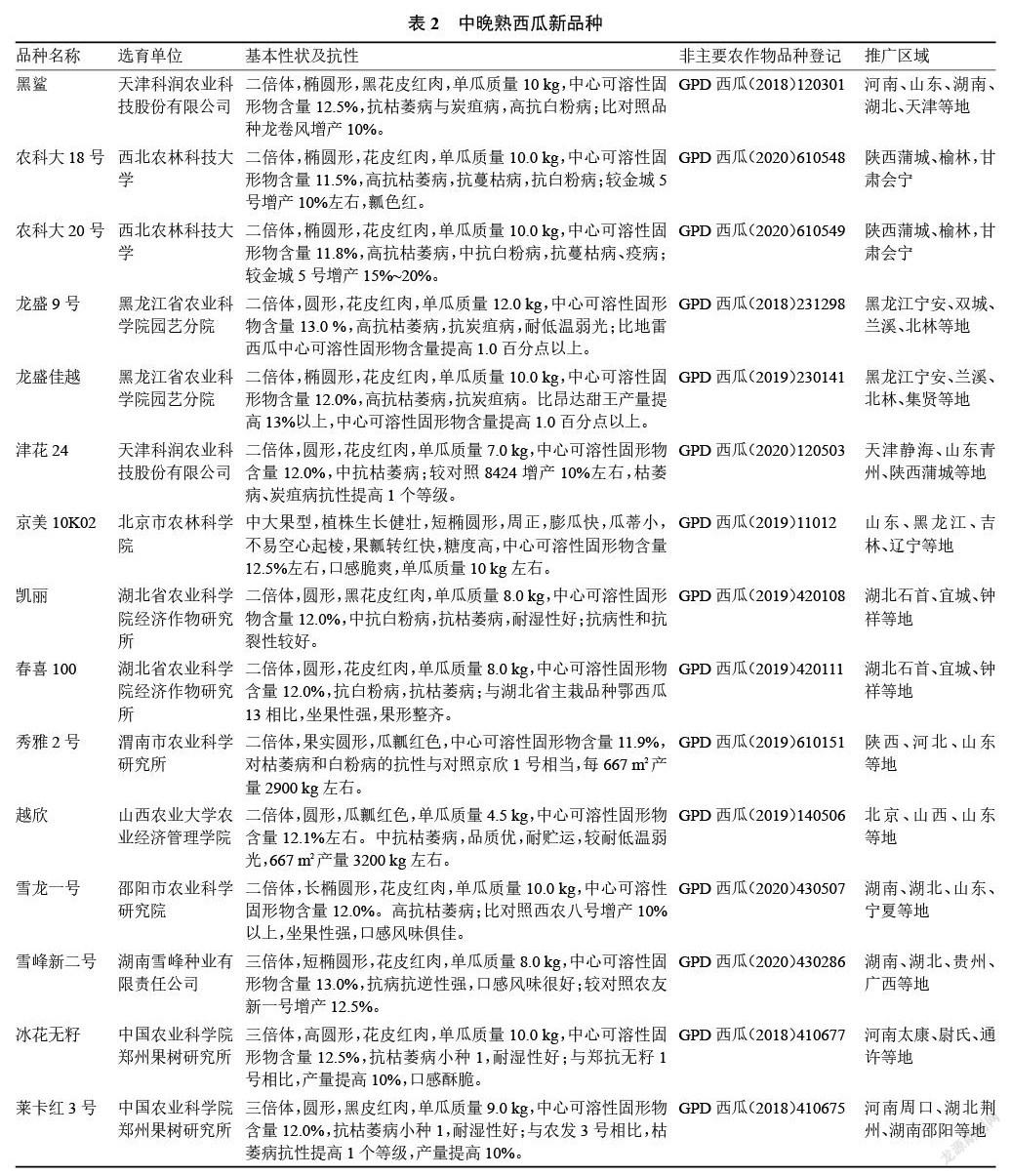
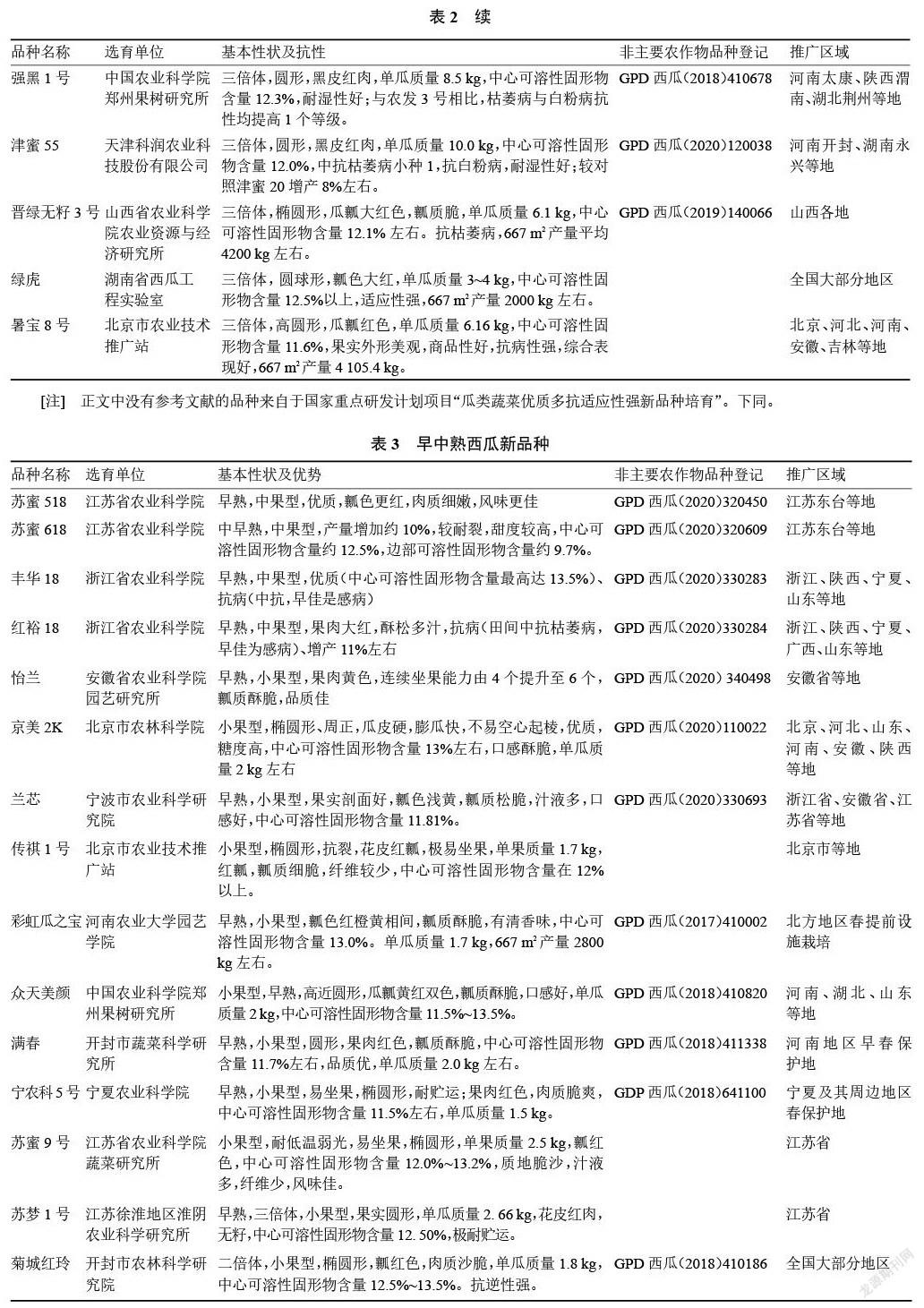
2017—2020 年通过非主要农作物品种登记的西瓜品种共有2685个。其中2017年176个、2018年1256个、2019年679个、2020年574个。目前已进行西瓜品种登记的省(自治区、直辖市)共有 27个,排名前十的为河南、安徽、甘肃、新疆、黑龙江、河北、山东、辽宁、北京、山西等。一些主要品种见表2~3。
2016—2020 年申请植物新品种保护的西瓜品种共有 389个,其中2016年24个、2017年70个、2018年89个、2019年146个、2020年60个。授权109个,其中2016年10个、2017年7个、2018年15个、2019年16个、2020年61个。从2016年的10 个增长到2020年60个,增幅达到83.8%。
目前市场上栽培面积较大的品种有京欣、8424、申抗968、甜王、美都、金城5号、西农8号、农科大6号、郑抗无籽1号、雪峰花皮、洞庭1号等。“十三五”期间,经过育种家的不懈努力,选育西瓜新品种超过50个。这些新品种的外观品质有了明显提升,尤其在含糖量、耐贮运方面大幅度提升,在中果型和小果型育种方面有所突破。适合露地栽培的西瓜新品种有黑鲨、农科大18号、农科大20号、龙盛9号[51]、龙盛佳越、津花24[52]、京美10K02、凱丽[53]、春喜100[54]、秀雅2号[55]、越欣[56]、雪龙一号、三倍体无籽西瓜有雪峰新二号[57]、冰花无籽[58]、莱卡红3号[59]、强黑1号[60]、津蜜55[61]、晋绿无籽3号[62]、绿虎[63]、暑宝8号[64]。适合设施栽培的西瓜新品种有中果型苏蜜518、苏蜜618、丰华18、红裕18,小果型怡兰[65]、京美2K、兰芯[66]、传祺1号[67]、彩虹瓜之宝[68]、众天美颜[69]、满春[70]、宁农科5号[71]、苏蜜 9号[72]、苏梦 1号[73]、菊城红玲[74]。
5 我国西瓜遗传育种前景展望
“十三五”期间,我国在西瓜基础研究、分子育种技术、育种材料创制和新品种选育等方面取得了突出的成绩,但与发达国家相比,国内在多基因聚合育种及商业化育种等方面还存在较大差距,常规育种与分子育种脱节,育种周期长;单倍体育种、基因编辑和转基因技术应用缺乏;抗病優质基因挖掘和野生地方种质资源利用不足;重复育种或同质化育种现象严重;缺乏具有核心竞争力的新品种。
5.1 进一步加强西瓜种质资源搜集、保存、鉴定和创制
种质资源是育种工作的基础,目前我国西瓜种质资源收集范围狭窄,特别是抗炭疽病、病毒病、细菌性果斑病等优异种质资源匮乏。应加强国内外种质资源的搜集和保存,以及种质资源的精准鉴定和优良基因挖掘相关研究,尤其是对西瓜多种病虫害具有较强抗性、有潜在育种价值的西瓜野生种基因的深入挖掘。通过对地方品种的优异性状的发掘,创制具有创新性的优质抗病的西瓜新种质。
5.2 继续加强应用基础和育种技术研究,提升西瓜育种水平
我国现阶段西瓜育种中基础研究相对薄弱,特别是抗病育种基础研究有待进一步加强,应进一步加大对基础研究的投入力度,加快抗病毒病、细菌性果斑病等基因的克隆进程。同时,要更加重视常规育种技术与生物技术的结合,进一步通过单倍体和多倍体诱导、远缘杂交和基因编辑等技术创制符合市场需求的优异育种材料,为今后高竞争力西瓜新品种培育奠定坚实的材料基础。
5.3 拓展育种新技术,提高育种效率
加强西瓜基因组学、代谢组学、转录组学、表型组学多组学研究。首先,基因组学不断深化,第 2 代、第3 代测序技术促进了全基因组选择育种的发展,在获得大量序列的基础上,大量 SNP 标记的开发使得利用全基因组 SNP 进行基因型分型很普遍。PAN-基因组学广泛地揭示多种基因信息,挖掘野生资源的遗传多样性信息。代谢组学有助于研究果实代谢物、品质、风味、抗逆等遗传关联;转录组学揭示不同时期不同组织的基因表达差异;表型组学研究已经在其他作物上开展。开展西瓜雄性不育材料的创制和育种技术研究;加强生长发育、单性结实基因挖掘和分子调控机制研究;重视西瓜主要果实品质、植株性状和抗逆体系;建立和优化抗病抗逆性状基因创制技术体系,开发新型实用分子标记,建立高通量分子标记辅助的遗传转化体系和基因编辑技术,实现定制化创制和改良西瓜种质材料。
5.4 根据生产和市场需求培育西瓜新品种
近些年设施西瓜面积增加迅速,培育不同熟性优质耐低温等西瓜新品种,适于春、夏、秋、冬多茬不同设施栽培;加强适应不同生态区优良西瓜品种的选育;由于三倍体无籽西瓜具有杂种优势和多倍体优势,具有优质、高产、抗病、抗逆、耐贮运、高功能性成分含量等特点,选育优质多样性的三倍体无籽西瓜新品种仍然是西瓜育种专家的目标;选育番茄红素、瓜氨酸、谷胱甘肽和维生素C高含量西瓜品种以及适合糖尿病人食用的高甜低糖品种,满足消费者健康需求。选育适合简约化栽培和机械化栽培的西瓜新品种,减少人工投入,提高瓜农种植效益,促进西瓜产业可持续发展。
致谢:感谢龚成胜、赵永、杨东东提供相关资料。
参考文献
[1] GUO S G,ZHANG J,SUN H,et al.The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions[J].Nature Genetics,2013,45(1):51-58.
[2] GUO S G,ZHAO S J,SUN H,et al.Resequencing of 414 cultivated and wild watermelon accessions identifies selection for fruit quality traits[J].Nature Genetics,2019,51(11):1616-1623.
[3] HAILESLASSIE G K.西瓜叶色后绿和植株短蔓性状的遗传与分子机制研究[D].北京:中国农业科学院,2020.
[4] ZHU H Y,ZHANG M J,SUN S R,et al.A single nucleotide deletion in an abc transporter gene leads to a dwarf phenotype in watermelon[J].Frontiers in Plant Science,2019,10:1399.
[5] DOU J L,YANG H H,SUN D L,et al.The branchless gene Clbl in watermelon encoding a TERMINAL FLOWER 1 protein regulates the number of lateral branches[J/OL].Theoretical and Applied Genetics,2021[2021-09-25].http://doi.org/10.1007/S00122-021-03952-6.
[6] DOU J L,ZHAO S J,LU X Q,et al.Genetic mapping reveals a candidate gene (ClFS1) for fruit shape in watermelon (Citrullus lanatus L.)[J].Theoretical and Applied Genetics,2018,131(4):947-958.
[7] DOU J L,LU X Q,ALI A,et al.Genetic mapping reveals a marker for yellow skin in watermelon (Citrullus lanatus L.)[J].PloS One,2018,13(9):e0200617.
[8] LI B B,ZHAO S J,DOU J L,et al.Genetic mapping and development of molecular markers for a candidate gene locus controlling rind color in watermelon[J].Theoretical and Applied Genetics,2019,132(10):2741-2753.
[9] 龔成胜,赵胜杰,路绪强,等.西瓜果实表皮蜡粉的化学成分与基因定位[J].中国农业科学,2019,52(9):1587-1600.
[10] LI N,SHANG J L,WANG J M,et al.Discovery of the genomic region and candidate genes of the scarlet red flesh color(yscr) locus in watermelon (Citrullus lanatus L.)[J].Frontiers in Plant Science,2020,11:116.
[11] WANG C N,QIAO AH,FANG X F,et al.Fine mapping of lycopene content and flesh color related gene and development of molecular marker-assisted selection for flesh color in watermelon (Citrullus lanatus)[J].Frontiers in Plant Science,2019,10:1240.
[12] ZHANG J,SUN H H,GUO S G,et al.Decreased protein abundance of lycopene β-cyclase contributes to red flesh in domesticated watermelon[J].Plant Physiology,2020,183(3):1171-1183.
[13] 刁卫楠,袁平丽,龚成胜,等.西瓜果肉柠檬黄色的遗传分析和基因定位[J].中国农业科学,2021,54(18):3945-3958.
[14] 高磊.西瓜果肉硬度和酸味性状的转录组分析及主效基因的精细定位[D].北京:中国农业科学院,2018.
[15] ANEES M,GAO L,UMER M J,et.al.Identification of key gene networks associated with cell wall components leading to flesh firmness in watermelon[J].Frontiers in Plant Science,2021,12:630243-630243.
[16] GONG C S,LI B B,ANEES M,et al.Fine-mapping reveals that the bHLH gene Cla011508 regulates the bitterness of watermelon fruit[J].Scientia Horticulturae,2022,292(in Press).
[17] REN Y,LI M Y,GUO S G,et al.Evolutionary gain of oligosaccharide hydrolysis and sugar transport enhanced carbohydrate partitioning in sweet watermelon fruits[J].The Plant Cell,2021,33(5):1554-1573.
[18] REN Y,GUO S G,ZHANG J,et al.A tonoplast sugar transporter underlies a sugar accumulation QTL in watermelon[J].Plant Physiology,2018,176(1):836-850.
[19] LI B B,LU X Q,GEBREMESKEL H.Genetic mapping and discovery of the candidate gene for black seed coat color in watermelon (Citrullus lanatus)[J].Frontiers in Plant Science,2020,10:1689.
[20] LUAN F S,FAN C,SUN L,et al.Genetic mapping reveals a candidate gene for egusi seed in watermelon[J].Euphytica,2019,215(11).
[21] GAO M L,LIANG X X,GUO Y,et al.QTL analysis of seed size by a high-density GBS genetic map in watermelon (Citrullus lanatus L.)[J].Acta Horticulturae,2020(1294):121-126.
[22] REN Y,MCGREGOR C,ZHANG Y,et al.An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon (Citrullus lanatus)[J].BMC Plant Biology,2014,14(1):33.
[23] 周慧文,盧丙洋,马鸿艳,等.西瓜种子大小形状相关 QTL 分析[J].园艺学报,2016,43(4):715-723.
[24] LIAO N,HU Z,LI Y,et al.Ethylene‐responsive factor 4 is associated with the desirable rind hardness trait conferring cracking resistance in fresh fruits of watermelon[J].Plant Biotechnology Journal,2019,18(4):1066-1077.
[25] 刁卫楠,朱红菊,刘文革.蔬菜作物中类胡萝卜素研究进展[J].中国瓜菜,2021,34(1):1-8.
[26] 李蒙蒙,路绪强,赵胜杰,等.西瓜种质资源的瓜氨酸含量分析及评价[J].果树学报,2017,34(4):482-494.
[27] GONG C S,DIAO W N,ZHU H J,et al.Metabolome and transcriptome integration reveals insights into flavor formation of ‘Crimson’ watermelon flesh during fruit development[J].Frontiers in Plant Science,2021,12:629361.
[28] GAO L,ZHAOS J,LU X Q,et al.‘SW’: a new watermelon cultivar with a sweet and sour flavor[J].HortScience,2018,53(6):895-896.
[29] UMER M J,BIN SAFDAR L,GEBREMESKEL H,et al.Identification of key gene networks controlling organic acid and sugar metabolism during watermelon fruit development by integrating metabolic phenotypes and gene expression profiles[J].Horticulture Research,2020,7(1):193.
[30] YUAN P L,UMER M J,HE N,et al.Transcriptome regulation of carotenoids in five flesh-colored watermelons (Citrullus lanatus)[J].BMC Plant Biology,2021,21(1):203.
[31] ZHANG J,GUO S G,REN Y,et al.High‐level expression of a novel chromoplast phosphate transporter ClPHT4;2 is required for flesh color development in watermelon[J].New Phytologist,2017,213(3):1208-1221.
[32] GONG C S,ZHU H J,LU X Q,et al.An integrated transcriptome and metabolome approach reveals the accumulation of taste-related metabolites and gene regulatory networks during watermelon fruit development[J].Planta,2021,254(2):35.
[33] WANG J F,WANG Y P,ZHANG J.et al.The NAC transcription factor ClNAC68 positively regulates sugar content and seed development in watermelon by repressing ClINV and ClGH3.6[J].Horticulture Research,2021,8(1):214.
[34] ZHOU Y,MA Y S,ZENG J G,et al.Convergence and divergence of bitterness biosynthesis and regulation in Cucurbitaceae[J].Nature Climate Change,2016,2(12):16183.
[35] YUAN P L,HE N,UMER M J,et al.Comparative metabolomic profiling of Citrullus spp.fruits provides evidence for metabolomic divergence during domestication[J].Metabolites,2021,11(2):78.
[36] LIU L F,GU Q S,IJAZ R,et al.Generation of transgenic watermelon resistance to Cucumber mosaic virus facilitated by an effective Agrobacterium-mediated transformation method[J].Scientia Horticulturae,2016,205:32-38.
[37] 張曼,徐锦华,刘广,等.西瓜‘SM1’高效遗传转化体系的构建[J].分子植物育种,2021,19(2):498-503.
[38] VASUDEVAN V,SATHISH D,AJITHAN C,et al.Efficient Agrobacterium-mediated in planta genetic transformation of watermelon[Citrullus lanatus Thunb.][J].Plant Biotechnology Reports,2021,15:447-457.
[39] REN Y,SUN H H,ZONG M,et al.Localization shift of a sugar transporter contributes to phloem unloading in sweet watermelons[J].New Phytologist,2020,227(6):1858-1871.
[40] YANG J H,DING C Q,XU B C,et al.A casparian strip domain-like gene,CASPL,negatively alters growth and cold tolerance[J].Scientific Reports ,2015,5(1):14299.
[41] ZHANG X X,YANG Y W,ZHAO M,et al.Acidovorax citrulli type III effector AopP suppresses plant immunity by targeting the watermelon transcription factor WRKY6[J].Frontiers in Plant Sciences,2020,11:579218.
[42] HE Y J,YAO Y X,LI L L,et al.A heat-shock 20 protein isolated from watermelon (ClHSP22.8) negatively regulates the response of Arabidopsis to salt stress via multiple signaling pathways[J].Peer J,2021,9:e10524.
[43] SHI T R,JOSHI V,JOSHI M,et al.Broad-spectrum amino acid transporters ClAAP3 and ClAAP6 expressed in watermelon fruits[J].International Journal of Molecular Sciences,2019,20(23):5855.
[44] SHI P B,GUY K M,WU W F,et al.Genome-wide identification and expression analysis of the ClTCP transcription factors in Citrullus lanatus[J].BMC Plant Biology,2016,16(1):85.
[45] WEI C H,ZHU C Y,YANG L P,et al.A point mutation resulting in a 13 bp deletion in the coding sequence of Cldf leads to a GA-deficient dwarf phenotype in watermelon[J].Horticulture Research,2019,6(1):132.
[46] WANG Y P,WANG J F,GUO S G,et al.CRISPR/Cas9-mediated mutagenesis of ClBG1 decreased seed size and promoted seed germination in watermelon[J].Horticulture Research,2021,8(1):70.
[47] TIAN S W,JIANG L J,GAO Q,et al.Efficient CRISPR/Cas9-based gene knockout in watermelon[J].Plant Cell Reports,2017,36(3):399-406.
[48] TIAN S W,JIANG L J,CUI X X,et al.Engineering herbicide-resistant watermelon variety through CRISPR/Cas9-mediated base-editing[J].Plant Cell Reports,2018,37(9):1353-1356.
[49] ZHANG M,LIU Q L,YANG X P,et al.CRISPR/Cas9-mediated mutagenesis of Clpsk1 in watermelon to confer resistance to Fusarium oxysporum f.sp.niveum[J].Plant Cell Reports,2020,39(5):589-595.
[50] WANG Y P,WANG J F,GUO S G,et al.CRISPR/Cas9-mediated mutagenesis of ClBG1 decreased seed size and promoted seed germination in watermelon[J].Horticulture Research,2021,8(1):70.
[51] 王喜庆,贾云鹤,闫闻,等.高抗枯萎病西瓜新品种‘龙盛9号’[J].园艺学报,2020,47(11):2273-2274.
[52] 焦荻,商纪鹏,高素燕,等.西瓜新品种‘津花24’的选育[J].中国瓜菜,2019,32(6):57-59.
[53] 戴照义,王运强,易丽聪,等.早中熟有籽西瓜新品种凯丽的选育[J].长江蔬菜,2021(16):39-41.
[54] 戴照义,王运强,易丽聪,等.西瓜新品种‘春喜100’的选育[J].中国瓜菜,2020,33(7):76-78.
[55] 朱雪荣,马飞明,许丽婷,等.西瓜新品种秀雅2号的选育[J].中国蔬菜,2021(3):96-98.
[56] 王静,郝科星,苏东涛,等.中果型西瓜新品种‘越欣’的选育[J].中国瓜菜,2021,34(2):71-73.
[57] 孙小武,杨仁喜,邓大成,等.无籽西瓜新品种‘雪峰新二号’的选育[J].中国瓜菜,2018,31(6):20-22.
[58] 路绪强,刘文革,赵胜杰,等.优质无籽西瓜新品种‘冰花无籽’的选育[J].中国瓜菜,2017,30(9):21-24.
[59] 刘文革,何楠,赵胜杰,等.高番茄红素黑皮无籽西瓜新品种‘莱卡红3号’的选育[J].中国瓜菜,2015,28(3):22-26.
[60] 何楠,王伟伟,路绪强,等.乌黑皮无籽西瓜新品种强黑1号[J].长江蔬菜,2020(23):11-12.
[61] 高素燕,焦定量,商纪鹏,等.无籽西瓜新品种‘津蜜55’的选育[J].中国瓜菜,2018,31(6):23-25.
[62] 郝科星,苏东涛,侯东颖,等.椭圆绿皮无籽西瓜新品种‘晋绿无籽3号’的选育[J].中国瓜菜,2020,33(7):79-82.
[63] 周泉,马陆平,罗中钦,等.无籽西瓜新品种‘绿虎’的选育[J].中国瓜菜,2018,31(1):23-27.
[64] 陈艳利,张雪梅,曾剑波,等.无籽西瓜新品种‘暑宝8号’的选育[J].中国瓜菜,2020,33(5):62-65.
[65] 严从生,金建芳,王明霞,等.黄瓤西瓜新品种‘怡兰’[J].园艺学报,2020,47(4):807-808.
[66] 应泉盛,张蕾琛,张华峰,等.小果型黄瓤西瓜新品种兰芯的选育[J].中国瓜菜,2021,34(10):110-112.
[67] 穆生奇,曾剑波,曾雄,等.抗裂小果型西瓜新品种‘传祺1号’的选育[J].中国瓜菜,2015,28(5):24-26.
[68] 马长生,胡建斌,杨路明,等.彩瓤小果型西瓜新品种‘彩虹瓜之宝’的选育[J].中国瓜菜,2018,31(12):24-26.
[69] 王平勇,赵光伟,贺玉花,等.设施专用小果型西瓜新品种‘众天美颜’的选育[J].中国瓜菜,2019,32(2):23-25.
[70] 于玉红,赵小龙,张琳,等.小果型西瓜新品种满春的选育[J].中国蔬菜,2021(9):100-102.
[71] 于蓉,田梅,郭松,等.小果型西瓜新品种宁农科5號的选育[J].中国蔬菜,2021(6):99-101.
[72] 徐锦华,羊杏平,侯茜,等.早熟西瓜新品种苏蜜9号的选育[J].中国蔬菜,2017(7):75-77.
[73] 张朝阳,杨红,赵建峰,等.小果型早熟无籽西瓜新品种苏梦1号的选育[J].中国果树,2015(5):9-11.
[74] 吴占清,范君龙,霍治邦,等.西瓜新品种‘菊城红玲’的选育[J].中国果树,2021(1):89-91.
