基于免疫相关基因的生物信息学分析构建头颈部鳞癌预后模型
2021-01-13沈阳秦建晔孙博文
沈阳 秦建晔 孙博文
摘 要 目的:以免疫相關基因的生物信息学分析为基础,构建头颈部鳞癌预后模型。方法:从癌症基因组图谱(the cancer genome atlas,TCGA)下载头颈部鳞癌患者的基因表达数据和临床数据,从ImmPort数据库下载免疫相关基因,通过单因素Cox回归分析、LASSO回归分析和多因素Cox回归分析得到相应预后基因并构建预后模型。运用KaplanMeier生存分析、受试者工作特征曲线(receiver operating characteristic curve,ROC)进行模型的内、外部评价。采用多因素Cox回归鉴定模型能否作为独立预后因子。通过诺莫图和决策曲线评价模型的精确度和有效性。结果:单因素Cox回归分析初步得到162个与预后相关的免疫基因,LASSO回归进一步缩减到24个基因,多因素Cox回归分析最终确认11个,构建预后模型。通过Kaplan-Meier生存分析发现在训练集与测试集中,低风险组生存时间远大于高风险组(P<0.001)。且预后模型的1、2、3年的ROC曲线下面积AUC较大。多因素Cox回归分析发现模型的风险比(HR)=1.3、95% CI=1.289~1.508、P<0.001。经决策曲线验证预后模型与分级、分期、年龄、性别一起联用时,患者净收益最大。校正曲线得知3、5年的C指数均为0.705。结论:成功建立了11个免疫相关基因的头颈部鳞癌预后模型,该模型能较好的预测患者的预后情况。
关键词 头颈部鳞癌;随机生存森林;预后模型;免疫治疗;肿瘤微环境
中图分类号:R73 文献标志码:A 文章编号:1006-1533(2021)24-0023-05
Construction of a prognostic mode for head and neck squamous cell carcinoma based on bioinformatic analysis of immune-related genes
SHEN Yang1, QIN Jianye2, SUN Bowen2,3(1.Graduate School of Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2. Shanghai Health and Medical
College, Shanghai 200120, China; 3. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China)
ABSTRACT Objective: To construct a prognosis mode for head and neck squamous cell carcinoma based on the bioinformatics analysis of immune-related genes. Methods: Gene expression data and clinical data of patients with head and neck squamous cell carcinoma were downloaded from the cancer genome atlas(TCGA), and the immune-related genes were downloaded from the ImmPort database, by univariate Cox regression analysis, Lasso regression analysis and multivariate Cox regression analysis, the corresponding prognostic genes were obtained and the prognostic mode was constructed. Kaplan Meier survival analysis and receiver operating characteristic curve(ROC) were used for internal and external evaluation of the mode. Multivariate Cox regression was used to identify whether the mode could be used as an independent prognostic factor. The accuracy and effectiveness of the mode were evaluated through the Nomo diagram and the decision curve. Results: Univariate Cox regression analysis initially obtained 162 immune genes related to prognosis, LASSO regression further reduced to 24 genes, and multivariate Cox regression analysis finally confirmed 11 immune genes to construct the prognostic mode. Kaplan-Meier survival analysis found that in the training set and test set, the survival time of the low-risk group was significantly longer than that of the high-risk group(P<0.001). Moreover, the area AUC under the ROC curve of 1, 2 and 3 years in the prognosis mode was large. Multivariate Cox regression analysis showed that the risk ratio(HR)=1.3, 95% CI=1.289~1.508, P<0.001. The decision curve verified that when the prognostic mode was combined with classification, staging, age, and gender, the patient’s net benefit was the largest. The correction curve showed that the C index in 3 and 5 years was 0.705. Conclusion: The prognosis mode for head and neck squamous cell carcinoma with 11 immune related genes is successfully established, which can better predict the prognosis of patients.
KEY WORDS head and neck squamous cell carcinoma; random survival forest; prognostic mode; immunotherapy; tumor microenvironment
头颈部鳞癌是全世界范围内常见的恶性肿瘤之一,通常其生存时间的中位值在10~13个月之间,5年总体生存率在50%左右,预后较差[1]。当今,头颈部鳞癌治疗的核心问题之一是对头颈部鳞癌患者预后情况的预测,因此有必要开发出一种准确的预测模型来指导治疗。
肿瘤微环境中的免疫反应不仅决定了肿瘤的生长行为,还影响着肿瘤患者的预后情况。其中,免疫逃逸已经有大量的文献报道,特别是关于PD-1/PD-L1的研究[2-3]。2016年FDA批准PD-1单抗用于铂类治疗失败的复发和(或)转移性头颈部鳞癌的治疗[4]。预测肿瘤患者预后情况通常有两种方法:(1)单分子的标志物如人乳头瘤病毒(HPV)来预测头颈部鳞癌患者的预后;(2)利用与患者相关的预后基因构建的模型来预测患者预后[5-6]。基于此,通过分析癌症基因组图谱(the cancer genome atlas,TCGA)的头颈部鳞癌的基因表达数据,构建并验证免疫相关基因的预后模型,从而预测患者预后情况,解决相同临床分期但结局不同的问题。
1.1 数据收集与处理
从TCGA中下载头颈部鳞癌的基因表达数据以及临床信息。以TCGA数据为训练集构建预后模型。同时从ImmPort下载免疫相关基因,并从基因表达数据库(Gene Expression Omnibus,GEO)下載头颈部鳞癌的数据集GSE65858作为模型测试集,以验证模型的预测能力。提取免疫相关基因,进行单因素Cox回归分析,设定P≤0.01,筛选获得相应免疫相关基因,再进行LASSO回归以及交叉验证获得最优基因集。
1.2 预后基因模型构建
将最优基因集进行多因素Cox回归,同时基于赤池信息量准则,采用逐步回归法精简获得相应免疫相关基因。采用另一种独立方法即随机生存森林评估免疫相关基因的重要性。
1.3 预后基因模型验证

1.4 决策曲线和诺莫图构建
采用决策曲线分析评估模型的临床有效性,其曲线下所形成面积越大,患者的净收益越大。同时构建风险值及其他指标的诺莫图。通过校准曲线评价训练集实际生存状态和预测生存状态的一致性。
2.1 免疫相关基因提取
从TCGA中下载的头颈部鳞癌数据集有546例样品信息,其中包括502例癌症患者样品信息和44例正常样品信息。临床数据包括528例患者信息,删除缺失生存状态和生存时间的临床信息1例,共计527例临床信息。从ImmPort下载到的免疫相关基因有2013个基因,GSE65858中包含了270例头颈部鳞癌患者的基因表达数据及相应临床信息。利用单变量Cox回归分析后得到162个免疫相关基因与患者预后有关。LASSO回归可得到不同基因集下的正则化参数值(图1A),交叉验证得到最小误差下的最优正则化参数,从而得到最适合的基因集。当正则化参数为-3.55时,误差最小,即基因集中含24个基因,模型表现最佳(图1B)。
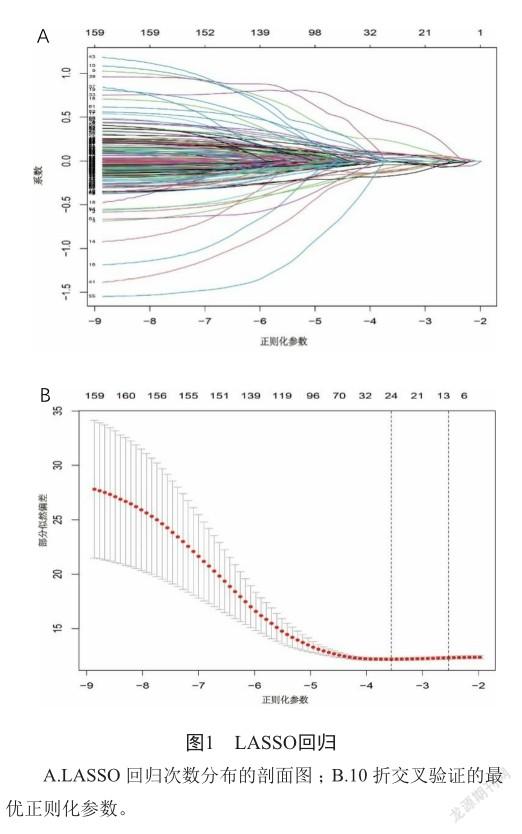
2.2 预后基因模型构建
通过多变量Cox回归分析,同时兼顾模型的复杂度和简洁性,利用逐步回归法,最终得到11个免疫相关基因(图2)和相应回归系数(表1)。用随机生存森林进一步评估11个免疫相关基因对患者生存状态的重要程度,发现分类树在2000颗左右时,错误率趋于平稳(图3A),而此时的变量重要性均为非负值(图3B),提示了这些基因对患者预后具有一定的影响。因此,最终采用这11个免疫基因作为模型构建基因。
2.3 模型验证
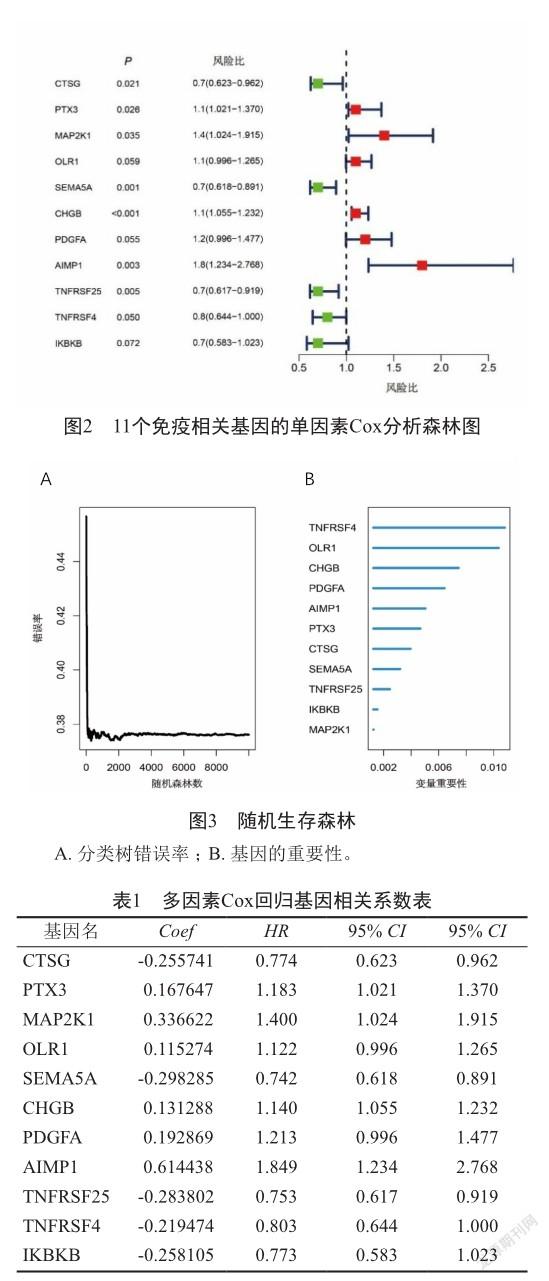
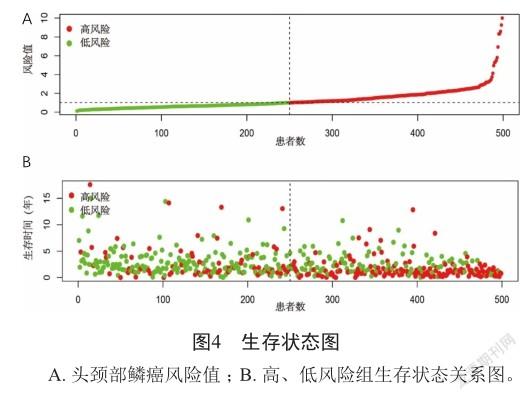
11个基因代入风险公式后得到:riskScore=-0.255741*CTSG+0.167647*PTX3+0.336622*MA P2K1+0.115274*OLR1+- 0.298285*SEMA5A+ 0.131288*CHGB+0.192869*PDGFA+0.614438*AI MP1+-0.283802*TNFRSF25+-0.219474*TNFRSF4+-0.258105*IKBKB。风险值越高,患者的生存率越低。根据风险值的中位值(1.014)在训练集即TCGA中头颈部鳞癌患者的数据中划分成高、低风险组(图4A)。高风险组的死亡人数远大于低风险组,且生存时间低于低风险组(图4B)。通过Kaplan-Meier生存分析得到高风险组的中位生存期为1.82年,3、5年的生存概率分别为37.8%、28.7%。低风险组中位生存期为7.41年,3、5年的生存概率分别为76.0%、63.9%。低风险组较高风险组生存期长、总生存率高(P<0.05)(图5A)。同时,1、2、3年的总体生存率ROC曲线下面积AUC分别为0.716、0.747、0.757(图5B)。上述结果提示模型在训练集中表现良好,具有一定的准确性和良好的预测能力。为进一步验证模型的预测能力,通过评估模型在测试集GSE65858的表现情况。同样在测试集中划分成高、低风险两组。利用Kaplan-Meier生存分析得到高风险组的中位生存期为3.15年,3、5年生存率分别是53.1%、35.65%。低风险组的中位生存期为5.38年,3、5年生存率分别是76.5%、60.2%。发现在测试集中,低风险组依然较高风险组生存期长,总生存率高(P<0.05)(图5C)。同时测试集中1、2、3年的总体生存率的ROC曲线下面积AUC分别为0.611、0.633、0.623(图5D),进一步提示模型在测试集上具有良好的预测能力。为验证模型能否作为独立预后因子,利用多因素Cox回归方法,发现模型HR=1.3,95% CI=1.289~1.508,P<0.001,可作为一个独立的预测因子(图6)。
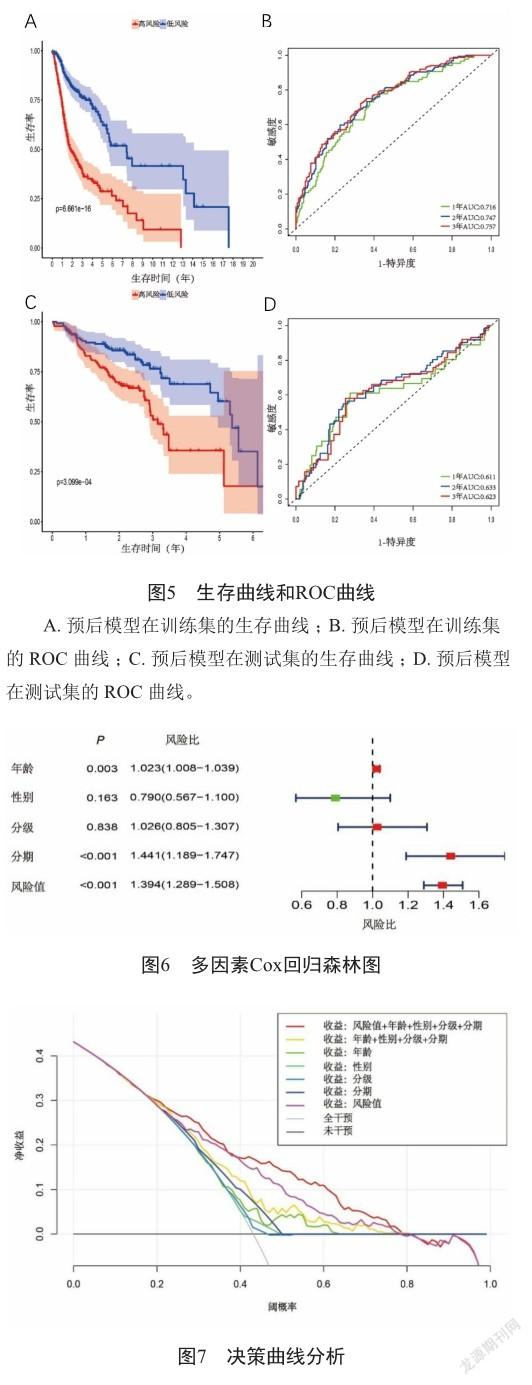
2.4 決策曲线和诺莫图
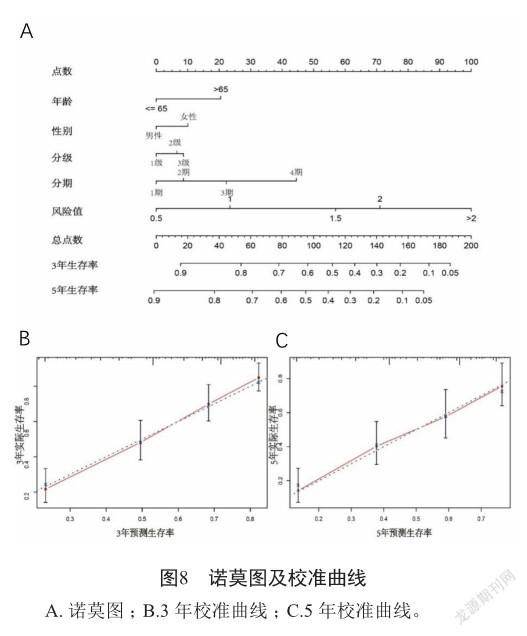
为了解模型的临床有效性,通过决策曲线得知,预后模型单独与传统的分级、分期、年龄、性别相比,患者单独使用预后模型的净收益比上述其他指标所得的净收益较大。而预后模型与分级、分期、年龄、性别一起联用时,患者净收益最大(图7)。诺莫图可以通过整合多个风险因素来量化某个单独的风险因子(图8A)。通过校准曲线来比较患者3年、5年真实生存率与预测生存率得知3、5年的C指数均为0.705(图8B、C),进一步提示模型具有良好的预测能力。
在头颈部鳞癌治疗中,除了常规的化疗、放疗外,免疫治疗也在近些年来兴起[7]。而免疫治疗中PD-1抑制剂纳武利尤单抗已经在头颈部鳞癌中取得一定的效果。现有资料表明,纳武利尤单抗组与标准治疗组的2年生存率分别为16.9%和6.0%,两组中位总体生存期分别为7.7个月和5.1个月,死亡风险降低32%,极大地显示出免疫治疗的优越性[8]。而预后情况的预测,能有效地掌握疾病的发展趋势,对临床用药具有一定的指导作用。因此,本研究通过构建免疫相关基因的预后模型来预测头颈部鳞癌患者的预后情况。
本研究通过对TCGA头颈部鳞癌患者基因表达数据的分析得到了一个由免疫相关基因构建的预后模型。本研究所构建的模型经训练集和测试集验证,发现在预测患者1、2、3年的生存率时具有相对较高的AUC值,证实了本模型具有良好的预测能力。同时,多因素Cox回归分析也证实本模型可作为一个独立预测因子。校准曲线比较了3、5年的预测生存率和实际生存率,发现两者之间具有较高的一致性,进一步说明本模型能较好地反应患者实际生存情况。决策曲线也验证了模型的临床有效性。Zhao等[9]所构建的头颈部鳞癌预后模型AUC值仅0.6,wang等[5]构建的预后模型在相同测试集中1、3年的AUC值为0.59、0.55。而本模型的AUC值比上述模型的AUC值均大,进一步提示本模型相比其他模型具有良好的预测能力。
在一项头颈部鳞癌治疗临床实验中发现,手术前使用TNFRSF4激动剂抗体能有效地预防手术切除后的复发[10]。TNFRSF4是免疫检查点分子之一,其功能主要是促进淋巴细胞的存活以及可增殖记忆性T细胞。TNFRSF4激动剂抗体可通过增强肿瘤微环境中的CD8+和CD4+T细胞的繁殖和存活能力,促进细胞因子生成,从而增强T细胞抗肿瘤的能力。因此,TNFRSF4被认为是肿瘤免疫治疗药物研发的新靶点[10-11]。OLR1为多核型髓源抑制性细胞的标志物,该细胞可抑制免疫反应,从而使肿瘤对化疗、免疫治疗产生抗性[12]。PTX3是固有免疫中体液免疫的重要组成成分之一。PTX3缺失,导致补体激活,促CCL2合成,增加肿瘤巨噬细胞招募,从而增加间皮质细胞和上皮细胞癌的发生[13]。本模型中包含以上几种基因,验证了本模型具有其临床意义。
本研究通过多种生物信息学方法和技术,最终构建了免疫相关基因预后模型,发现对头颈部鳞癌患者的预后情况有较好的预测能力,并具有一定的准确性和特异性。同时,还解决了不同患者具有相同分级分期等相同临床指标,但其临床结局不同的问题。
参考文献
[1] Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Abate D, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2017: A systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2019, 5(12): 1749-1768.
[2] 杨文婷, 余英豪. PD-1及其配体在实体肿瘤中的应用[J].临床与实验病理学杂志, 2015, 31(7): 791-793.
[3] 黄育刚, 王莉, 汤显斌. PD-1/PD-L1免疫抑制剂在肺癌临床治疗和病理检测中的研究进展[J]. 临床与实验病理学杂志, 2020, 36(6): 688-692.
[4] Seiwert TY, Burtness B, Mehra R, et al. Safety and clinical activity of pembrolizumab for treatment of recurrent or metastatic squamous cell carcinoma of the head and neck(KEYNOTE-012): an open-label, multicentre, phase 1b trial[J]. Lancet Oncol, 2016, 17(7): 956-965.
[5] Wang J, Chen X, Tian Y, et al. Six-gene signature for predicting survival in patients with head and neck squamous cell carcinoma[J]. Aging(Albany NY), 2020, 12(1): 767-783.
[6] Arantes LMRB, De Carvalho AC, Melendez ME, et al. Serum, plasma and saliva biomarkers for head and neck cancer[J]. Expert Rev Mol Diagn, 2018, 18(1): 85-112.
[7] Ferris RL. Immunology and immunotherapy of head and neck cancer[J]. J Clin Oncol, 2015, 33(29): 3293-3304.
[8] Ferris RL, Blumenschein G Jr, Fayette J, et al. Nivolumab vs investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck: 2-year long-term survival update of CheckMate 141 with analyses by tumor PD-L1 expression[J]. Oral Oncol, 2018, 81: 45-51.
[9] Zhao X, Sun S, Zeng X, et al. Expression profiles analysis identifies a novel three-mRNA signature to predict overall survival in oral squamous cell carcinoma[J]. Am J Cancer Res, 2018, 8(3): 450-461.
[10] Aspeslagh S, Postel-Vinay S, Rusakiewicz S, et al. Rationale for anti-OX40 cancer immunotherapy[J]. Eur J Cancer, 2016, 52: 50-66.
[11] 姜鑫, 杜國强, 李志勇, 等. OX40免疫检查点在头颈部鳞状细胞癌中的作用机制及临床应用的研究进展[J]. 中国医科大学学报, 2020, 49(6): 570-573.
[12] Condamine T, Dominguez GA, Youn JI, et al. Lectin-type oxidized LDL receptor-1 distinguishes population of human polymorphonuclear myeloid-derived suppressor cells in cancer patients[J]. Sci Immunol, 2016, 1(2): aaf8943.
[13] Garlanda C, Bottazzi B, Magrini E, et al. PTX3, a humoral pattern recognition molecule, in innate immunity, tissue repair, and cancer[J]. Physiol Rev, 2018, 98(2): 623-639.
