伤寒沙门氏菌质粒DNA参考物质的研制
2021-01-13努色热提阿布都沙拉木袁慕云林晓峰许龙岩陈瑶
努色热提·阿布都沙拉木 袁慕云 林晓峰 许龙岩★ 陈瑶★
沙门菌(Salmonella,Sa)属于肠杆菌科,在世界各国细菌性食物中毒病例中,其引起的食物中毒常居榜首或第二位[1-2]。沙门氏菌的血清型有超过2 500 中,肠炎沙门菌(Salmonella enteritidis,SE)和鼠伤寒沙门菌(Salmonella typhimurium,ST)感染占到人类Sa 感染患者的75%以上[3-4]。因此,快速鉴定并确定沙门氏菌的型别,对食品安全具有重要的意义。
目前沙门氏菌的检测方法在快速发展中,聚合酶链式反应(PCR)等核酸检测技术的发展在一定程度上克服了传统检测方法耗时长、操作复杂、特异性差等缺点。但是目前用于PCR 的核酸检测参考品十分缺乏。要同时进行沙门氏菌的鉴定和型别分析,往往要使用多个基因组参考品才能完成,而基因组参考品中检测靶基因的量值,又难于确定和溯源[4-5],也无法就不同实验室的检验结果进行对比和评价。为此,本实验拟制备含可用于鉴定和鉴别沙门氏菌型别的基因片段的质粒DNA 参考样品,为沙门氏菌核酸检测提供可溯源的有效参考物质,有效解决病原菌核酸检测能力快速发展与标准物质缺乏的矛盾。
1 材料与方法
1.1 实验材料与仪器
菌株来源为沙门氏菌标准菌株(CMCC50071),鼠伤寒沙门菌标准菌株(ATCC14028),肠炎沙门菌标准菌株(ATCC13076)(来自中国普通微生物菌种保藏管理中心广州海关技术中心)。全基因人工合成等(上海吉玛生物工程有限公司);引物合成、DNA 测序(华大基因科技股份有限公司)。
1.2 片段设计和克隆
通过人工合成的方法将沙门氏菌aceA基因(GenBank:U43344.1),SE 特异性序列se(Gen-Bank:AF370707.1),ST 特异性序列st(GenBank:CP001363.1)以1∶1 的比例串联在一起(单个基因的核酸序列可从https://www.ncbi.nlm.nih 下载,基因之间以不相关的基因片段aagtcg 隔开),并克隆到pUC57 中以形成重组质粒pDNASalmonella,并进行扩增纯化后用于进一步实验。
1.3 质粒纯度测定
使用琼脂糖凝胶电泳法和紫外分光光度分析法(UV 法)判定质粒纯度。取10 μL 酶切液上样,用1% 琼脂糖凝胶进行电泳,观察条带是否清晰且单一以判断核酸纯度。取1 μL 样品通过UV 法测出样品在260 nm、280 nm 波段的紫外光下的吸光度值(A260、A280),纯DNA 的A260/A280 应为大于1.8,小于2.0 的值。
1.4 均匀性检测
取样按照《JJG1006-1994 一级标准物质技术规范》进行使用紫外法(UV 法)(最小采样量为1 μL)分析pNDA 的瓶间均匀度和瓶内均匀度。
随机选择10 管pDNA,并从每管样品的上层,中层和下层提取1 μL 测试样品,根据方差分析(F-测试)瓶内均匀性。随机选择10 管pDNA,并用UV 重复测量每管中提取的1 μL 样品3 次,取平均值。通过方差分析(F 检验法)分析测量结果并进行判断瓶间均匀性。并根据ISO 指南35 使用该数据评估pDNA 分装导致的均匀性对不确定度的贡献。
1.5 稳定性考察
选择最常见的保藏方法-20℃低温保存作为稳定性考察的指标,每月随机抽取3 瓶对质粒DNA参考物质的浓度进行测定,为期一年,并根据ISO指南35 使用该数据评估长时间保存的稳定性并评估稳定性对核酸参考物质不确定度的贡献。
1.6 定值
pDNA 采用8 家实验室协同定值的方法进行标准值的确定,汇总全部原始数据后经统计检验确认各组数据无离群值、各组数据等精度、每组数据的平均值之间不存在显著性差异后,取8 家实验室检测结果的平均值为各质粒DNA 标准物质的标准值,并进行定值过程引入的不确定度。
1.7 不确定度评估
根据对pDNA 均匀性、长期稳定性、定值结果这三方面来源的不确定度最终计算出标准物质的标准不确定度及扩展相对不确定度。在计算扩展不确定度的时候,将标准不确定度乘以包含因子(k=2)。
1.8 qPCR 实验
根据沙门氏菌基因组大小3.29 Mbp,pDNA 大小5 179 bp,按照以下公式估算基因组DNA 和重组质粒DNA 的拷贝数。

定量后,使用pDNA 和gDNA 分别制备10 倍稀释系列,制备2×106、2×105、2×104、2×103、2×102和2×101copies/mL 稀释的样品用于建立qPCR 标准曲线。qPCR 每个反应均含10 pM 引物。PCR 方案如下:分别在94℃下10 min 和94℃下15 s,在58℃下45 s 进行40个循环。引物序列和扩增子大小如表1。
分别将质粒参考品(pDNA)和基因组DNA(gDNA)稀释成106、105、104、103、102和101copies/mL 用作参考样品,并一式三份进行qPCR 检验,以估计qPCR 检测的扩增效率(e)和斜率(K)。以101拷贝为检测样本进行10 次qPCR 检测,以估计检测下线(Limit of detection,LOD)来评估qPCR的检测范围。通过统计分析标准曲线的扩增效率(e)和斜率(K),以评估pDNA 对gDNA 的可替换性。
1.9 数据分析统计分析
使用SPSS 12.0 和Graphpad 5.0 软件进行统计分析。均匀性测试使用单因素方差分析。稳定性分析使用单向线性回归分析来计算斜率b1,当|b1|<t00.95,n-2×S(b1)时将认定未观察到不稳定性[(n-2 是自由度),而S(b1)是斜率的不确定性]。使用配对t检验分析pDNA 与gDNA 的适用性结果。当P<0.05 具有统计意义。

表1 三种沙门氏菌检测所需的引物序列和来源Table 1 Sequence and source of Primers for salmonella
2 结果
2.1 质粒标准品
测序结果提示成功合成了含有基因的DNA片段,并将其插入克隆载体和pUC57 中,形成了重组质粒pDNA(图1)。pDNA 提取纯化后,经酶切鉴定和测序证实,重组质粒中插入片段的序列准确度为100%,符合预期(图2)。鉴定后的质粒通过紫外法测定其A260/A280的比值为1.926±0.436,比值在1.8-2.0 间,且A260/A230的比值大于2.0。

图1 pDNA Salmonella 质粒构建示意图Figure 1 Map of plasmid reference material pDNA Salmonella

图2 pDNA Salmonella 质粒鉴定图Figure 2 Identification of pDNA Salmonella
2.2 均匀性检验
均匀性检测结果显示,在95%置信水平下,pDNA 的性质值在瓶内和瓶内均质性上差异无统计学意义。见表2。

表2 鼠肠炎伤寒沙门氏菌核酸标准样品均匀性评价结果Table 2 Statistic results of homogenous test of pDNA Salmonella
根据以下公式计算质粒DNA 的瓶间不均匀性引起的不确定度(uh):

其中:Q1为组间差方和,Q2为组内差方和,v1为组间自由度,v2为组内自由度,n为组内测量次数。
根据上述公式计算得出,pDNA 瓶间不均匀性引起的不确定度结果为:0.586 μg/mL。
2.3 稳定性检验
pDNA 在-20℃低温保存条件下用经验模型线性回归模型进行稳定性评价的结果,结果表明稳定性线性模型中的斜率|β1|<t0.95,n-2·S(β1),表明pDNA 具有良好的稳定性。根据以下公式计算质粒DNA 在12 个月内的长期稳定性引起的不确定度(us)。见表3。

表3 pDNA 长期稳定性的统计结果Table 3 Statistic results of short-term stability of pDNA Salmonella
us=Sβ1×N
其中:β1是稳定性线性模型中的斜率,S(β1)是斜率的标准偏差,N 是稳定性评估的总时间,N=12 个月最终经过计算得出pDNA 在长期保存12 个月所引起的不确定度为:1.616 μg/mL。
2.4 定值结果
pDNA 的参考值由8 个实验室共同确定,并通过统计检查证实,每组数据均没有异常值和显着差异,并得出总的平均值=30.08 μg/mL 作为标准值;进而根据以下公式计算定值过程带来的不确定度:

其中:s 为总平均值的标准偏差1.016 μg/mL,p 为实验室数目。
因此得出由定值产生的不确定度结果为:0.359 2 μg/mL
2.5 不确定度分析
质粒DNA 参考材料的不确定度成分为:均质性(uh)、有效期内变异性引起的不确定度(us)、定量过程引入的不确定度(uq),因此根据以下公式计算标准不确定度:

结果为:1.796 6 μg/mL。计算扩展不确定度时,应将标准不确定度乘以包含因子(k=2)。所以,扩展相对不确定度计按以下公式计算:
U=Ucrm*k
最终计算得到扩展不确定度(U)为3.5932 μg/mL(k=2)。图3。
2.6 荧光定量PCR(qPCR)标准曲线的建立
使用所制备的pDNA 作为参照标准以建立qPCR 标准曲线,各标准曲线的相关参数。见表4、图3。

表4 沙门氏菌pDNA 建立的标准曲线数据Table 4 Data for the standard curve established by pDNA Salmonella
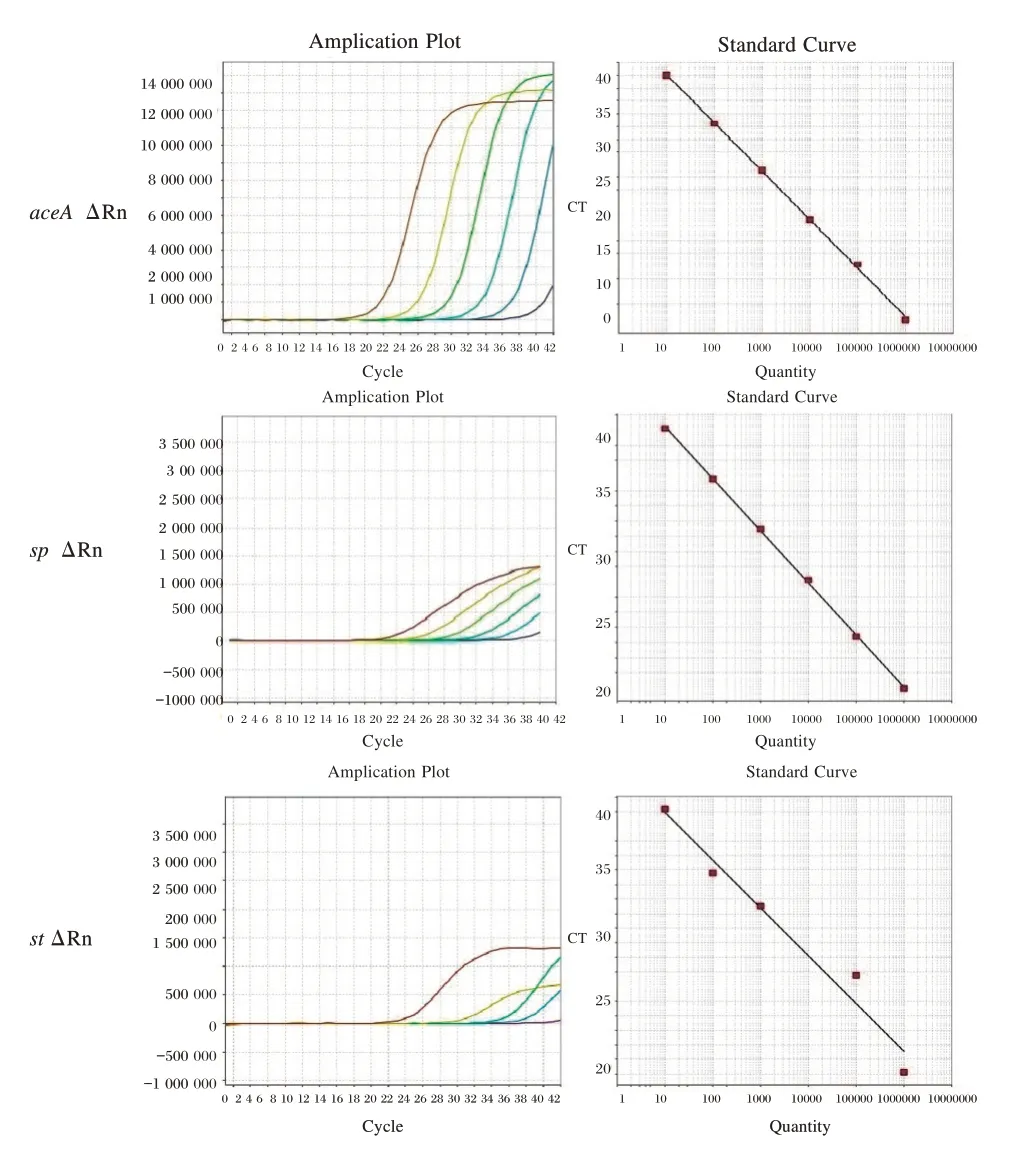
图3 沙门氏菌pDNA 建立的aceA,st,se 基因的标准曲线Figure 3 Standard curve of aceA,st,se sequence established by pDNA Salmonella
2.7 pDNA 和基因组DNA 标准品的替代研究
此研究中使用了以梯度稀释的伤寒沙门菌基因组DNA(gDNA)和pDNA 参考材料为模板绘制标准曲线,并统计分析标准曲线的扩增效率和斜率(t 检验)。在95%置信度下,基因组DNA 建立的标准曲线与pDNA 建立的标准曲线之间,差异无统计学意义(P>0.05)。见表5。
3 讨论
为了能够提供为多个检测靶标进行定性定量参考的参考品,本研究针对沙门菌的aceA基因、肠炎沙门菌特异序列st、鼠伤寒沙门菌的特异性序列se,通过人工合成方法制备了质粒核酸检测参考品。pDNASalmonella的制备解决了需要鉴别沙门氏菌的型别的时候,需要使用多种基因组核酸参考品的问题,通过一次荧光PCR 扩增就可以确认检测样本是否受到沙门菌以及哪一种沙门菌的污染。在提供有保障的序列和量值溯源的同时,大大简化了操作的繁琐性[4-7]。实验结果表明,pDNASalmonella不仅具有序列和量值的可溯源性,还具有良好的稳定性及均一性,符合《一级标准物质技术规范》要求[8-10]。本文进一步根据欧盟核酸参考品Yieldgard MON 810 的研究方 法[11-13]证明了pDNASalmonella替换基因组DNA 的可行性,提示在制备方法和安全性上具有巨大优势的人工合成质粒DNA 参考品有望替代基因组参考品应用于沙门氏菌的核酸检验。

表5 副溶血弧菌pDNA 和基因组DNA 标准品代替性研究Table 5 Substitution of pDNA Salmonella and genomic DNA reference material
本研究为人工合成质粒作为病原菌核酸检测参考品的应用提供了实践基础。下一步工作,我们将进一步验证此方法是否也可更广泛的用于食品中其他危险病原体的检测,例如Ecoli O157,副溶血性弧菌和霍乱弧菌等,并希望通过提供优质的可溯源性参考品有效提高病原体测试实验室相关项目的检测水平并确保其可比性,从而提高应对大规模突发公共安全事件的能力储备。
