淋巴细胞/单核细胞比值与地西他滨治疗骨髓增生异常综合征疗效的相关性
2021-01-12何裕邓程新李敏明吴萍陆泽生翁建宇杜欣
何裕 邓程新 李敏明 吴萍 陆泽生 翁建宇 杜欣
骨髓增生异常综合征(MDS)是一组异质性、克隆性造血干细胞疾病,其基本病变是病态造血、无效造血和高危演变为急性髓系白血病(AML)。地西他滨(DAC)为5-氮杂-2’-脱氧胞嘧啶核苷,已被美国及欧洲批准用于中高危MDS,且其总有效率约达50%[1]。近年来,越来越多的研究证实异常的免疫反应在MDS的发病及进展中起着重要作用,外周血淋巴细胞/单核细胞比值(LMR)已被证实与多种恶性肿瘤相关[2-3]。LMR与去甲基化治疗MDS的疗效相关性尚不明确。本文通过回顾性分析DAC单药治疗的MDS患者的临床资料,旨在探究LMR与MDS疗效的相关性。
对象与方法
1.对象:纳入2009年11月~2015年11月广东省人民医院收治的接受DAC单药治疗的MDS患者49例,年龄33~79岁,平均年龄(57.66±12.70)岁,其中男36例,女13例。排除标准:随访时间<1年、既往已使用DAC和DAC作为维持治疗的患者。所有患者均接受2个疗程以上的DAC治疗,最长为27个疗程,中位DAC治疗疗程数为4(3,8)个。其中4例患者经过2个疗程DAC治疗后死亡或失访导致缺失2个疗程后的相关资料。另45例患者按2个疗程后的LMR(LMR2)-1个疗程后的LMR(LMR1)以0为界进行分组:LMR2-LMR1<0组26例,其中男16例,女10例,年龄33~79岁,平均年龄(56.15±13.76)岁,使用DAC 2~26个疗程;LMR2-LMR1≥0组19例,其中男16例,女3例,年龄36~77岁,平均年龄(59.79±12.03)岁,使用DAC 2~27个疗程。两组患者年龄、性别、使用DAC疗程比较差异均无统计学意义(P>0.05),具有可比性。
2.方法
(1)治疗方法:所有患者均接受DAC结合支持治疗[包括成分血输注、祛铁、促红细胞生成素(EPO)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、雄激素等]。其中6例患者采用3天治疗方案,43例患者采用5天治疗方案。所有患者均接受2个疗程以上DAC治疗,直至其死亡、中途退出、无效或不能耐受药物相关不良反应。
(2)临床资料收集:收集所有患者治疗前的血常规[Hb、中性粒细胞计数(ANC)、PLT计数、单核细胞计数(AMC)、淋巴细胞计数(ALC)]、使用DAC疗程、骨髓检查结果(骨髓原始细胞百分比、染色体数、核型)、分型诊断结果及治疗1个疗程、2个疗程后的血常规、骨髓原始细胞百分比,计算LMR、LMR2-LMR1、2个疗程后AMC(AMC2)-1个疗程后AMC(AMC1)、2个疗程后ALC(ALC2)-1个疗程后ALC(ALC1)。以0为界,AMC2-AMC1>0、ALC2-ALC1>0为表示升高。
(3)评定方法:分析患者治疗前后的血常规、骨髓象及初诊时的细胞遗传学结果。采用2008年WHO修订的骨髓增生异常综合征(MDS)的诊断标准进行分型诊断。预后判断采用国际预后评分系统(IPSS),根据评分分为低危(0分)、中危-1(0.5~1.0分)、中危-2(1.5~2.0分)及高危(≥2.5分)[4]。治疗效果评定方法:自DAC治疗1个疗程后,在每个疗程及下一次化疗前参照2006年MDS的国际工作组(IWG)疗效标准[5]评定,包括完全缓解、部分缓解、骨髓完全缓解及血液学缓解。总有效率(%)=完全缓解例数+部分缓解例数+骨髓完全缓解例数+血液学缓解例数/总例数×100%。总生存(OS)时间:即从开始使用DAC时起,直至随访终止时间或患者因任何原因死亡的时间。生存期按照确诊日期至死亡日或随访结束日计算。
(4)随访方法:所有患者随访至2018年12月16日,随访资料来自住院病历、门诊病历及电话随访记录。
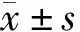
结 果
1.所有患者治疗前的临床资料:49例患者中难治性血细胞减少伴单系发育异常(RCUD)1例,难治性血细胞减少伴多系发育异常(RCMD)9例,难治性贫血伴原始细胞增多1型(RAEB-1)22例,RAEB-2 17例。根据IPSS预后,在49例患者中,中危-1患者23例,中危-2 患者22例,高危患者4例。染色体核型正常25例,一条染色体异常14例,2条染色体异常8例,3条染色体异常2例。9例患者伴7号染色体异常。所有患者治疗前外周血及骨髓原始细胞结果如下:Hb 24.80~137.00 g/L,中位值为63.00(52.70,75.95)g/L;ANC 0.13~4.32×109/L,中位值为0.82(0.48,1.18)×109/L;PLT计数 5.60~345.40×109/L,中位值为45.20(23.10,152.90)×109/L;AMC 0.02~1.75×109/L,中位值为0.28(0.15,0.42)×109/L;ALC 0.13~4.32×109/L,平均值为(1.23±0.55)×109/L;LMR 0.81~83.50×109/L,中位值为45.20(2.09,7.28)×109/L。治疗前骨髓原始细胞1%~17%,中位值为7%(5%,13%)。
2.45例患者治疗后外周血及骨髓原始细胞检查结果:最终纳入的45例患者治疗后外周血及骨髓原始细胞检查结果见表1。
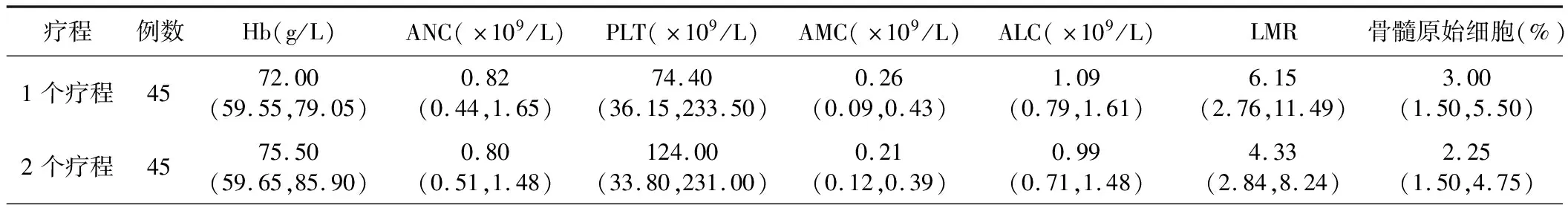
表1 45例患者治疗后外周血及骨髓原始细胞检查结果[M(P25,P75)]
3.两组患者治疗前的临床资料比较:两组患者治疗前Hb、ANC、PLT、ALC、骨髓原始细胞百分比、染色体数、核型及分型诊断结果比较差异均无统计学意义(P>0.05).LMR2-LMR1<0组患者的AMC低于LMR2-LMR1≥0组,LMR高于LMR2-LMR1≥0组(P<0.05),见表2。LMR2-LMR1<0组AMC2-AMC1升高患者比例明显高于LMR2-LMR1≥0组(80.8%比22.2%,P<0.001),但两组ALC2-ALC1升高患者比例比较差异无统计学意义(P>0.05)。
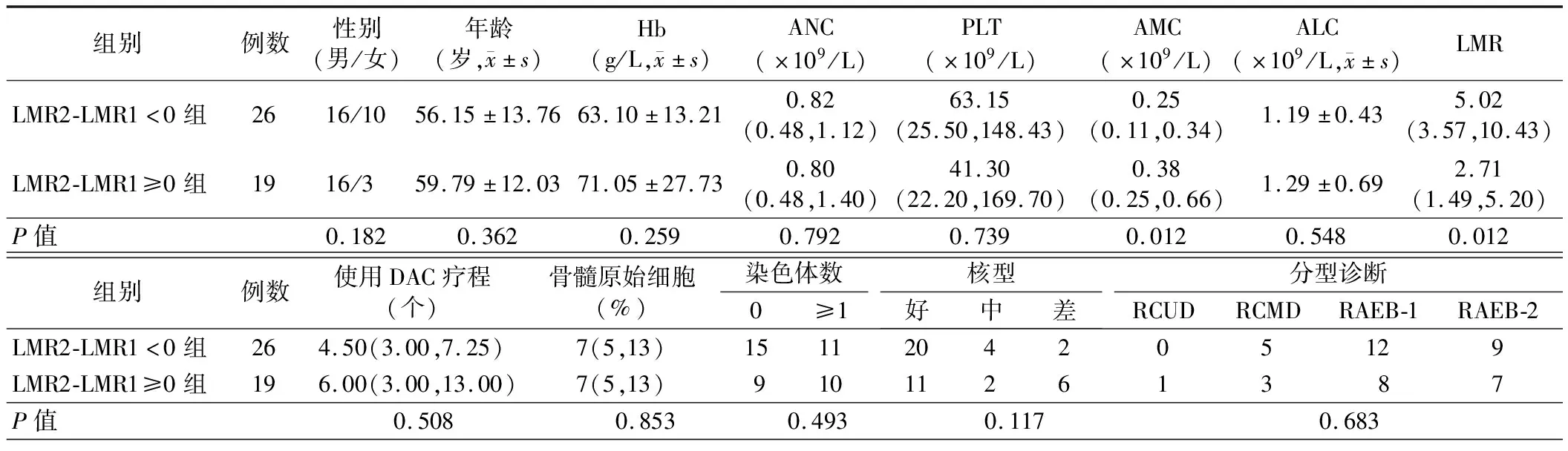
表2 两组患者治疗前的临床资料比较[M(P25,P75)]
4.临床疗效:49例患者总有效率为61.2%(30/49):完全缓解(CR)2例(22.2%);部分缓解(PR)0例;骨髓完全缓解(mCR)23例(46.9%),血液学缓解(HI)15例(30.6%),其中mCR同时伴HI 10例。治疗失败19例,其中11例为疾病稳定(SD)。所有患者达到最佳疗效的中位疗程数为2(2,3)个疗程。
5.不同因素与DAC治疗MDS有效率的相关性分析:二分类logistic回归分析结果显示,1个疗程后的骨髓原始细胞百分比、PLT1、PLT2、LMR2-LMR1均为DAC治疗MDS有效率的影响因素(P<0.05)。见表3。
表3 不同因素与有效率的相关性分析
6.LMR2-LMR1、1个疗程后骨髓原始细胞百分比、PLT1、PLT2对DAC疗效判断结果的比较:LMR2-LMR1对DAC疗效判断的灵敏度为70.0%,特异度为66.7%,正确率为68.9%。1个疗程后骨髓原始细胞数对DAC疗效判断的灵敏度为80.0%,特异度为57.9%,正确率为71.4%。PLT1对DAC疗效判断的灵敏度为46.7%,特异度为84.2%,正确率为61.22%。PLT2对DAC疗效判断的灵敏度为67.7%,特异度为64.3%,正确率为66.7%。LMR2-LMR1对DAC治疗MDS疗效的预测价值与1个疗程后的骨髓原始细胞百分比(P=0.519)、PLT1(P=0.745)、PLT2(P=0.527)相当。
7.患者预后情况:49例患者中有33例患者死亡。所有患者的中位生存期为27.0(13.5,62.0)个月,2年生存率为53%(26/49)。
8.影响患者预后的单因素分析:年龄≤60岁、诊断结果、治疗前骨髓原始细胞百分比<5%、1个疗程后骨髓原始细胞百分比<5%、ANC2≥1.5×109/L、PLT1≥100×109/L、1个疗程后血细胞减少系数≤2为患者预后的保护因素(图1)。进一步通过多因素分析结果发现,年龄(OR=3.707,95%CI1.490~9.221,P=0.005)、治疗前骨髓原始细胞数(OR=28.091,95%CI1.983~398.020,P=0.014)为MDS患者预后的独立影响因素。
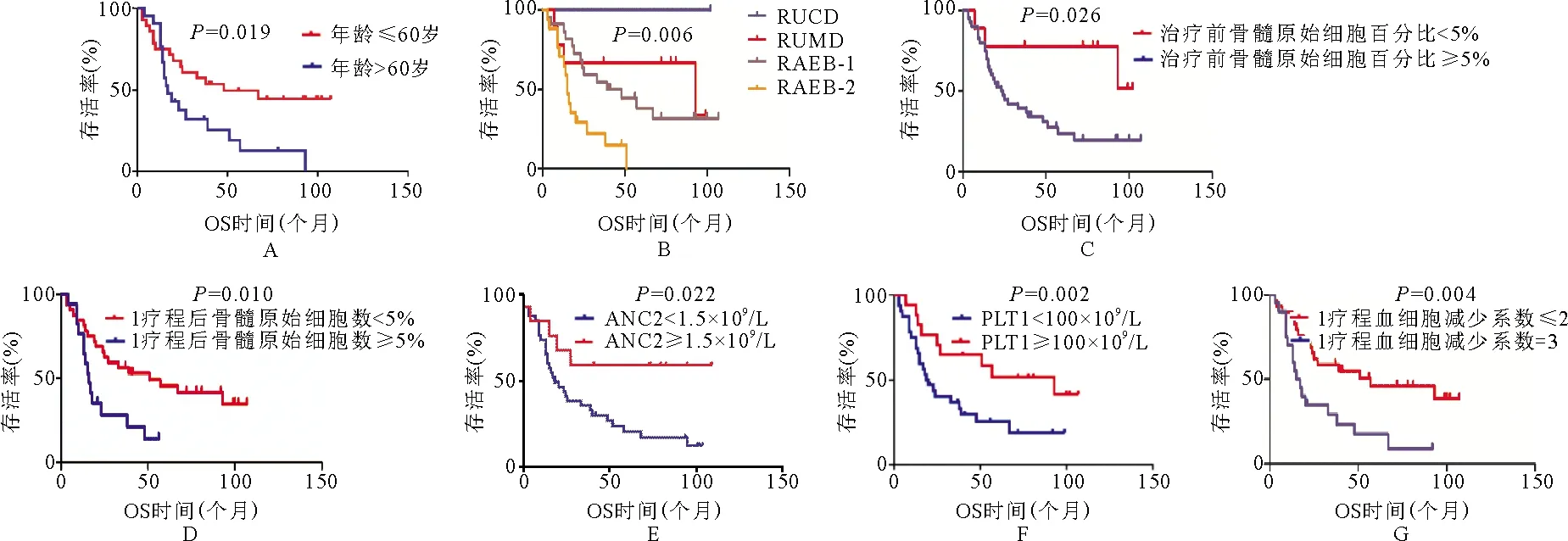
图1 不同因素对MDS患者生存时间的影响(A:年龄;B:诊断;C:治疗前骨髓原始细胞数;D:1个疗程后骨髓原始细胞数;E:ANC2;F:PLT1;G:1个疗程后血细胞减少系数)
讨 论
本研究49例接受DAC治疗的MDS患者中位生存期为27个月,与Wijermans等[1]的研究结果相似,且其明显长于既往文献[6-7]报道的仅接受支持治疗患者的中位生存时间。另外本研究还发现MDS患者接受DAC治疗后,血细胞及骨髓原始细胞百分比逐渐得到改善,在DAC治疗期间,骨髓原始细胞百分比呈逐渐下降趋势,治疗前的骨髓原始细胞百分比中位值为7.00%,1个疗程及2个疗程后骨髓原始细胞百分比的中位值分别为3.00%、2.25%。变化最为明显的是PLT,本研究结果显示,64.4%患者1个疗程后PLT较治疗前升高,中位值增加达29.20×109/L;73%患者2个疗程后PLT较治疗前升高,中位值较初诊时升高78.80×109/L,且1个疗程后及2个疗程后PLT≥100×109/L组患者的有效率明显高于PLT<100×109/L组,但红系及粒系无此表现。PLT对DAC高反应的原因可能为巨核细胞的增殖与其他系的增殖不同,前者是连续双倍增殖DNA的方式,即细胞核成倍增殖,正是这种高水平DNA复制使其对去甲基化药物如DAC更加敏感[8]。另外,Ding等[9]发现DAC可诱导MDS患者中骨髓巨核细胞的分化及成熟。
本研究49例MDS患者接受DAC治疗后,总反应率为61.2%,与既往研究结果相近[10]。如何识别MDS患者受益于去甲基化药物同样是当代学者的一个挑战。本研究通过分析49例接受DAC单药治疗的MDS患者的临床资料,发现1个疗程后的骨髓原始细胞百分比、PLT1、PLT2及LMR2-LMR1均可影响MDS的疗效。且LMR2-LMR1对DAC治疗MDS疗效的预测价值与既往研究得出与PLT1、PLT2的相当[11-12]。本研究中LMR2-LMR1<0组患者对DAC反应率较高,且该组AMC2-AMC1升高患者比例明显高于LMR2-LMR1≥0组,但两组患者中ALC2-ALC1升高患者比例比较差异无统计学意义。LMR2-LMR1<0组患者对DAC呈高反应的原因可能是患者接受DAC治疗后,血液中的单核细胞数量增加,其吞噬及活性氧产生能力也随之恢复。单核细胞计数与肿瘤坏死因子-α(TNF-α)表达水平呈正相关[13],活化单核-巨噬细胞分泌的TNF-α是重要的促进凋亡的细胞因子,通过诱导抑癌基因自杀相关因子(Fas)抗原上调或直接通过氧化损伤导致肿瘤细胞凋亡,从而使疾病得到控制。Saeed等[14]通过研究889例原发MDS患者发现,免疫紊乱在原发性MDS的发生、发展中起关键作用,初诊为单核细胞减少患者预后极差,也间接证实了本文观点。
综上所述,去甲基化药物DAC可能会影响人体免疫细胞,如单核细胞及淋巴细胞。MDS患者接受去甲基化治疗后恢复免疫平衡,LMR升高,抵抗肿瘤免疫能力增强,从而使肿瘤细胞减少,达到疾病缓解。本研究仍存在以下不足之处:(1)本研究为单中心、回顾性研究,难免存在偏倚,因此后期需要大样本、多中心、前瞻性临床试验来证实;(2)本文未一步了解淋巴细胞亚型及单核细胞亚型在DAC治疗前后的改变及LMR与基因表达谱、突变分析等预后标记的关系,后期需要将临床资料与流式细胞学、基因测序等检测方法进行综合分析,进一步探究其相关性。2个疗程后LMR非升高可预测DAC治疗MDS的疗效,该指标检测简单方便、经济实惠,有助于在取得疗效前指导临床工作者用药。
