MSCT平扫及增强扫描诊断肺硬化性血管瘤的价值
2021-01-11张佳隽彭海腾蔡静陆征海尹秋凤
张佳隽,彭海腾,蔡静,陆征海,尹秋凤
上海交通大学医学院附属新华医院影像科,上海200093
前言
肺硬化性血管瘤(PSH)是一种组织形态与皮肤组织中硬化性血管瘤相似的良性肺内肿瘤,于1956年由外国学者Liebow 和Hbbel 首次报道,多数学者认为PSH 是非特异性炎症所致的肺内瘤样增生性病变[1]。1999年世界卫生组织(WHO)对肺肿瘤的新分类中将其由瘤样病变归类为混杂性肿瘤,这意味着PSH 是一种真性肿瘤。但PSH 在临床较为少见,影像学表现为肺内边界清晰的实性占位性肿块,影像学特征不具特异性,易被误诊为肺内其他良、恶性病变,诊断困难[2-3]。近年来多层螺旋CT(MSCT)技术得到了快速发展,被广泛应用于临床辅助检查,可极大提高CT 图像空间分辨率,清晰显示病变细节,可使PSH 的影像表现具一定特征性[4]。本研究对14 例在上海交通大学医学院附属新华医院确诊为PSH 患者的MSCT 平扫及增强扫描图像进行分析,探究MSCT平扫及增强扫描在诊断PSH中的应用价值,旨在提高临床对本病的认识及影像诊断符合率。
1 资料与方法
1.1 一般资料
病例采集对象为2010年1月~2019年3月于上海交通大学医学院附属新华医院经手术或穿刺病理证实的14例PSH患者,其中男3例,女11例,年龄21~75岁,平均(45.37±10.73)岁。6 例无症状为体检时发现;3 例因偶有胸闷、胸痛或咳嗽咳痰等胸部不适症状入院;1例因痰中带血入院;4例因其他原因入院检查发现。均行MSCT平扫及增强扫描,临床资料及影像学资料完整。
1.2 检查方法
采用GE Brightspeed 16 排螺旋CT 扫描机行MSCT 平扫及增强扫描,层厚、层距均为5 mm,矩阵512×512,螺距1.375,管电压120 kV,管电流220 mA,扫描范围自胸廓入口至肾上腺水平。增强扫描对比剂采用碘海醇(300 mgI/mL),高压注射器经肘正中静脉注入,注射剂量80 mL,注射速率2.5 mL/s,注射25 s、40~65 s 分别行动脉期、静脉期扫描。对图像进行1.25 mm薄层重建。肺窗窗位-700 HU,窗宽1 000 HU,纵膈窗窗位40 HU,窗宽400 HU。
1.3 图像分析
由2名高年资影像学医师共同阅片,观察病灶位置、大小、形态、边缘、密度、强化特征、病灶周边情况、是否合并肺门及纵膈淋巴结肿大等,取统一商定后的诊断意见为最终结果。增强扫描强化幅度按Swensen 标准:CT 值增加<15 HU 为无强化,CT 值增加15~25 HU 为轻度强化,CT 值增加25~45 HU 为中度强化,CT值增加>45 HU为明显强化。
2 结果
2.1 检查结果
14 例患者均为单发孤立病灶;病变位于肺右上叶、右中叶各2 例,位于肺右下叶4 例,肺左上叶、左下叶各3例;病灶大小1.1 cm×1.2 cm~4.0 cm×5.6 cm。所有病例均未见明显囊变及出血。
2.2 CT平扫表现
11 例患者表现为病灶边缘清晰的圆形或卵圆形,形态规则,未见分叶及毛刺征象(图1);3 例表现为病灶边缘清晰的类圆形伴浅分叶,未见毛刺征象。形态为圆形或卵圆形的11 例病灶密度均匀,表现为软组织密度影,CT值26~38 HU(图2);形态为类圆形的3 例病灶密度欠均匀,表现为小斑片状略低密度区,CT值15~30 HU;4例经薄层重建纵膈窗病灶内可见砂砾状钙化,其中3例位于病灶边缘,1例位于病灶中心,为斑片状钙化。
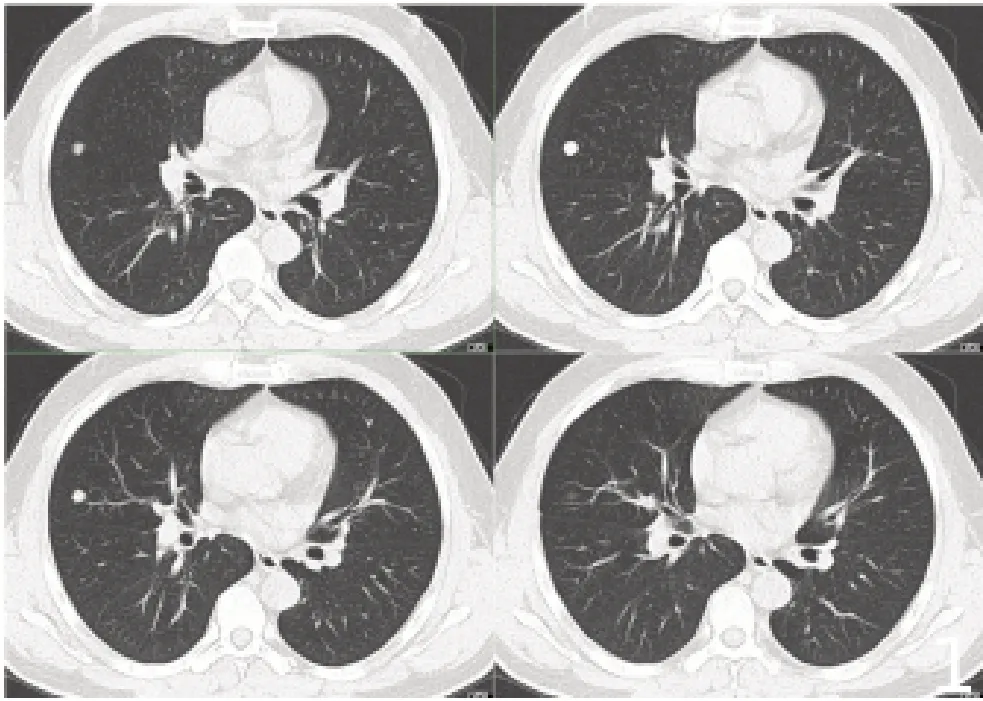
图1 病灶边缘清晰的圆形或卵圆形影,形态规则,未见分叶及毛刺征象Fig.1 A round or ovoid shaped shadow along the clear edge of the lesion,with regular morphology and no signs of lobules and burr
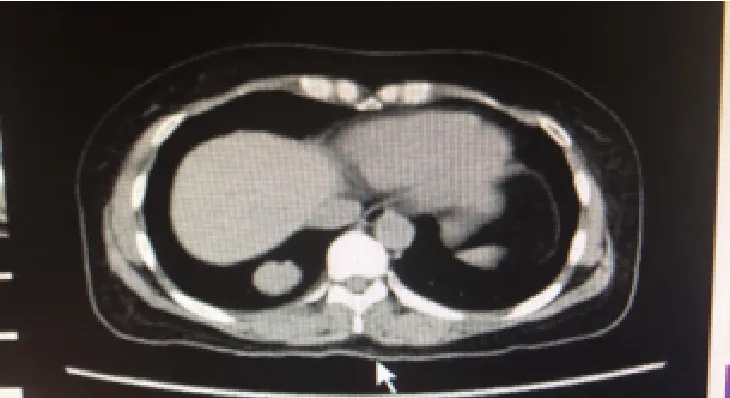
图2 病灶形态为圆形或卵圆形,密度均匀,表现为软组织密度影Fig.2 Round or oval shaped lesions with uniform density,manifested as soft tissue density shadow
2.3 增强扫描表现
14 例患者均行增强扫描,11 例平扫密度均匀,增强扫描均匀强化(动脉期净强化CT值>30 HU(图3),静脉期净强化CT 值40~53 HU;余3 例不均匀明显强化。强化幅度:14 例患者病灶增强后动脉期均为中等强化(图4),且随时间延迟强化幅度增加。
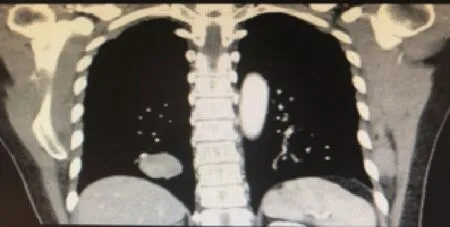
图3 增强扫描均匀强化,动脉期净强化CT值30 HUFig.3 Homogeneous enhancement with an enhanced net value of 10 HU at the arterial phase

图4 病灶增强后动脉期均为中等强化,且随时间延迟强化幅度增加Fig.4 Lesions were moderately enhanced at the arterial phase and the enhancement amplitude increased with time delay
2.4 病灶周边情况
14例患者均行薄层重建及多平面重建,12例病灶边缘清晰,周围肺野未见卫星灶及“胸膜凹陷征”,2例病灶前缘可见“尾征”,3例病灶边缘可见少许磨玻璃密度征(即“晕征”)(图5);10例多平面重建冠状位、矢状位清晰显示病灶与血管关系(即“贴边血管征”)(图6),4例可见半月形透亮影(即“空气新月征”)。4例病灶体积较小(最大径<1.5 cm),未见“贴边血管征”。
2.5 肺门及纵膈淋巴结情况
仅1例患者首诊肺门及纵膈淋巴结肿大(直径约1.0 cm),余13例均未见肺门及纵膈淋巴结肿大。
2.6 术前MSCT诊断
术前仔细阅片,7 例诊断为PSH,3 例诊断为炎性假瘤,1例诊断为结核瘤,1例诊断为错构瘤,2例诊断为周围型肺癌。

图5 经薄层重建纵膈窗病灶内可见砂砾状钙化,位于病灶边缘Fig.5 The gritty calcification at the edge of the lesion in the mediastinal window reconstructed by thin layers
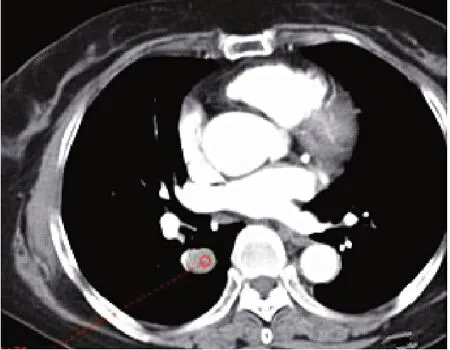
图6 贴边血管征Fig.6 Welt vascular signs
2.7 术后随访
术后随访3月~5年,14 例患者术后均未发生复发或转移。
3 讨论
PSH是一种少见的肺部肿瘤,免疫组织化学及超微结构研究证实其起源于Ⅱ型肺泡上皮细胞,临床较为少见,占良性肿瘤的22%~32%,以中青年女性多见,通常无特征症状,多数体检发现,部分可有胸闷、胸痛、咳嗽、咳痰、痰中带血等表现,病灶生长缓慢,可长期不变,较少出现淋巴结转移及远处转移,预后好[5-6]。PSH组织病理学上肿瘤细胞为立方细胞和多角形细胞,按组织类型可分为4种:实质型、乳突状型、血管型和硬化型,各类型并不独立表现,而是相互之间移行混合存在[7]。
MSCT显示PSH外形与常见良性肿瘤相似,多为圆形或卵圆形,边缘清晰,无毛刺,可见伴少量浅分叶、“尾征”及“空气新月征”(“空气新月征”征象病理基础尚不明确,多认为是病灶压迫周围支气管导致的)[8]。有文献报道PSH密度常较均匀,少数可见钙化及囊变;钙化形态可为沙砾状,也可为小斑片状,认为其形成与病理学认为的4种组织类型的演变密切相关[9]。这一过程在单个病灶不同区域内有所区别,当血管瘤样区足够大时显示低密度囊变影像,当硬化区域有明显钙盐沉积时显示高密度钙化,因此囊变及钙化病例病灶多密度不均匀[10-11]。但本研究病例未见明确钙化及囊变征象。MSCT增强扫描显示14例患者病灶增强后动脉期均为中等强化,且随时间延迟强化幅度增加。陈明等[12]认为病灶早期明显强化,强化持续时间长是PSH增强扫描的特征表现,其增强幅度及方式与其组织成分和病灶大小密切相关,乳突状型、血管型且病灶小者血管密度高,强化明显,实质型、硬化型且病灶大者血管密度低,强化幅度低且不均匀。MSCT增强扫描薄层重建及多平面重建可从多角度清晰显示病灶与血管关系,“贴边血管征”是PSH增强扫描的特征影像表现之一,是病灶周围受推挤的粗大血管影或断面血管影[13-14]。本研究14例增强扫描中10例显示此征象,对确诊PSH有重要意义。
PSH需与以下疾病鉴别。(1)炎性假瘤:PSH早期曾被认为是炎性假瘤的一种,故鉴别较为困难。但炎性假瘤形态多不规则,呈三角形、楔形或类圆形,边缘毛糙、模糊,密度均匀,多无分叶及短毛刺,少数有长毛刺,抗感染治疗后病灶可缩小。(2)错构瘤:好发于中年男性,为肺内的良性肿瘤,边缘光整,内密度均匀,有钙化,爆米花样钙化或脂肪密度是其特征性表现,增强扫描后也有强化,但不如PSH明显[15-16]。如在病灶内检出爆米花样钙化及脂肪成分则可较明确诊断。(3)周围型肺癌:也呈孤立性结节分布,但边缘毛糙,分叶更明显,有细短毛刺及胸膜凹陷征等征象,内密度不均匀,增强扫描后呈不均匀强化,强化不及PSH显著,明确诊断还需结合临床及病理资料[17]。
综上所述,PSH 是少见的肺内良性病变,临床症状无明显特异性,无特殊好发部位,MSCT 平扫表现为孤立性结节或肿块影,病灶边缘光滑、密度均匀、无毛刺,可有浅分叶,增强扫描后强化明显,“空气新月征”、“贴边血管征”为其相对特征性的表现,这些特征可提高术前诊断准确率,但明确诊断还需结合临床及病理资料,应注意与炎性假瘤、错构瘤、周围型肺癌等疾病鉴别诊断。