基于ArcCHECK-3DVH系统的鼻咽癌容积旋转调强放疗三维剂量验证研究
2021-01-11阳露余辉张国前张全彬张书旭
阳露,余辉,张国前,张全彬,张书旭
广州医科大学附属肿瘤医院放疗中心,广东广州510095
前言
鼻咽癌是我国华南地区常见恶性肿瘤之一,除有明显的放疗禁忌证,都可给予放射治疗[1-2]。众多报道指出容积旋转调强放疗(Volumetric-Modulated Arc Therapy, VMAT)技术可提高鼻咽癌治疗效率[3-5],但是放疗的安全实施还需要对病人的治疗计划进行质量验证(Quality Assurance,QA)。二维剂量验证已广泛应用于日常病人治疗计划剂量验证工作,但它无法直接预测病人体内靶区和危及器官的三维剂量[6],从而不能知悉病人靶区和危及器官剂量是否按照治疗计划的要求给予剂量。为解决此问题,随后有研究者提出一些三维剂量重建方法[7-10],比如SunNuclear 公司的ArcCHECK-3DVH 系统就是基于测量数据来重建出病人体内的三维剂量,该软件具备二维和三维剂量验证功能。国内已广泛开展了基于ArcCHECK的二维剂量验证研究[11-14],而三维剂量验证相关的研究尚不足[15-16],且极少针对Monaco 治疗计划系统(Treatment Planning System,TPS)制定的鼻咽癌计划进行三维剂量验证。因此,本文研究了ArcCHECK-3DVH 系统在鼻咽癌VMAT治疗计划剂量验证中的应用。
1 材料与方法
1.1 仪器设备与软件
本研究选用基于蒙特卡罗算法的MonacoV5.11治疗计划系统制订放射治疗计划,然后经MOSAIQ网络系统将放疗计划传送至Elekta Synergy直线加速器。在加速器上执行患者的放疗计划,并结合ArcCHECK-3DVH 系统进行剂量验证。ArcCHECK-3DVH 系统包括用于数据采集的ArcCHECK 模体ˎSNC Patient软件和用于剂量对比分析的3DVH 软件(Sun Nuclear Corporation, Melbourne, Florida,V3.3.2)。3DVH 软件采用了剂量微扰算法(Planned Dose Perturbation, PDP)计算重建剂量[17],能估算患者体内的三维剂量分布,可应用于放疗中的剂量验证。用户根据不同的加速器设备、射线能量与多叶准直器等信息选择不同的PDP机器模型。
1.2 患者选取与计划设计
选取广州医科大学附属肿瘤医院2019年治疗的20 例男性鼻咽癌患者,年龄27~68 岁,中位年龄47.5岁。对于20 例患者,CT 影像上勾画的靶区分别包括GTVnx、GTVnd、CTV1 和CTV2;考虑摆位误差等因素扩充上述靶区分别为PGTVnx、PGTVnd、PCTV1和PCTV2;危及器官包括脊髓、脑干、视神经、视交叉、晶体、眼球、喉、腮腺、下颌骨、颞叶。利用Monaco TPS 为上述患者设计6 MV VMAT 计划,并将该计划移植至ArcCHECK 模体中,重新计算剂量,以DICOM格式保存,记为该患者的QA计划。
1.3 测量方法
将每位患者的6 MV VMAT治疗计划和QA计划传送至MOSAIQ网络传输系统,进行患者计划验证工作。具体步骤如下:(1)ArcCHECK模体摆位:将厂家提供的均匀固体插件插入ArcCHECK模体的空腔中,按照用户手册要求摆放ArcCHECK模体,直至模体尾端4个倾斜仪的LED灯长亮且不闪烁状态;(2)测量本底:当ArcCHECK模体与电脑中的SNC Patient 8.0版本软件连接好后,打开软件自动测量本底;(3)矩阵和绝对剂量校准:根据SNC Patient软件配备的帮助文件和提示,按步骤校准矩阵和绝对剂量;(4)对每个患者的QA计划进行实际测量工作,并保存相关的.txt和.acml文件;(5)剂量验证分析:将患者治疗计划信息中的RT Plan、RT Structures、RT Dose、CT Images和QA计划对应的RT plan和RT Dose及每个患者的.acml文件导入至3DVH软件中,结合PDP算法就可获得重建剂量。通过软件中提供的γ 值和DVH 图可获得每个患者重建剂量与Monaco TPS计算的剂量差异。本研究中γ分析的条件设置为3 mm/3%,阈值为10%。靶区参考指标为D98%、D2%和Dmean,危及器官主要参考指标为Dmax和Dmean。3DVH 软件中的剂量差异值Diff(%)计算公式为:Diff(%)=(Dose_3DVH-Dose_TPS)/Dose_TPS×100%。本文在处理数据时,每个患者的每个器官剂量差异Differences(%)是取3DVH软件中剂量差异值的绝对值,即 | Diff(%) |,这是为了方便统计多个患者同一器官剂量差异值的平均值。每个器官的剂量差异值也将进行统计学分析,探索其是否服从正态分布。
1.4 统计学方法
使用SPSS 16.0 统计软件分析这20 例患者的数据结果,其中符合正态分布的计量资料用均数±标准差表示,采用配对t检验;而非正态分布的计量资料用M(Q1, Q3)表示,采用Wilcoxon 秩和检验。P<0.05 为差异有统计学意义。
2 结果
分析20例鼻咽癌患者的γ通过率,这个通过率包括了所有靶区和危及器官的比较结果,发现这20例患者的γ 通过率不符合正态分布,γ 通过率表示为98.20%(97.75%, 99.20%)。图1显示的是其中1 例患者在Monaco TPS系统计算的(实线)和ArcCHECK-3DVH系统中经测量重建的(虚线)剂量体积直方图和γ值。图1中Parameters 说明了该患者的剂量验证分析采用了3 mm/3%的γ分析标准,Global值为76.791 Gy,阈值为10%;Comparison部分采用了Gamma分析法,并结合了AC-PDP算法,该患者剂量网格总共包括503 494个,其中符合3 mm/3%的γ分析标准的点有494 897个,所以通过率为(494 897/503 494)≈98.3%,即图中显示的98.3%,高量点有34个,低量点有8 563个,具体这些点的位置需要借助3D Dose界面查看。每个器官对应的剂量值可在DVH图中查看,实线表示参考值(Reference),代表Monaco 计划系统计算值,虚线是比较值(Comparison),代表3DVH系统结合测量与PDP算法给出的值。DVH图界面左边可选择DVH图积分或微分类型,图1中显示的是靶区D98%对应的值,PGTVnx(PGTVp)的D98%剂量经TPS 计算为70.00 Gy,经3DVH重建计算为68.15 Gy。具体差异值可以调取模板计算,结果如图2所示,图中PGTVnx 对应的D98%差异值为-1.850 Gy,变化率为-2.643%。在本文后续研究中将所有患者的变化率取绝对值。
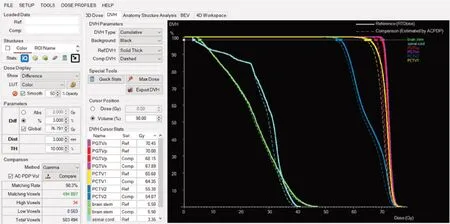
图1 基于TPS(实线)和3DVH软件(虚线)获得的剂量体积直方图和γ值Fig.1 Dose volume histogram and gamma value obtained by TPS(solid line)and the 3DVH software(dashed line)
2.1 靶区的剂量差异
20 例鼻咽癌患者,Monaco TPS 计算和ArcCHECK-3DVH 系统给出的靶区剂量如表1所示。所有患者靶区的γ 通过率经分析,PGTVnx 和PCTV1通过率不服从正态分布,在TH=10%和3 mm/3%的标准下,γ 通过率均在94%以上;PGTVnd 和PCTV2的通过率服从正态分布,PGTVnd 通过率可表示为93.23%±4.57%,其中有4 例患者PGTVndγ 通过率小于90%,其他均大于90%;所有患者PCTV2 对应的γ通过率可表示为95.22%±2.76%。综上,绝大部分患者各个靶区γ 通过率为90%以上。关于靶区具体参数,20 例患者的PGTVnd 和PCTV2 经计算或者测量对应的D98%满足正态分布,故可采用均数±标准差形式表示具体值,而比较TPS计算和3DVH测量重建的D98%差异性则采用了配对t检验,而基于计算和测量这2 种不同方法获得的靶区具体差异值则根据Diff(%)公式计算。通过Monaco TPS 和3DVH 软件分别计算PGTVnd 剂量,比较这2 组数据,发现20 例患者PGTVnd 的D2%分 别 为73.30(72.28, 74.78)Gy 和73.28(72.02, 74.49)Gy,对应Z值是-0.88,尽管具体差异值表示为0.43%(0.18%, 1.09%),但是P值是0.38,故这个差异性不具有统计学意义。同理由TPS计算和3DVH 测量重建可获得PCTV2 的D2%分别为73.85(73.03, 74.13)Gy 和73.74(73.22, 74.51)Gy,P值为0.44,这两种方法获得的剂量差异值也无统计学意义。而基于此2 种不同方法计算的PGTVnx、PGTVnd、PCTV1 和PCTV2 其他剂量参数,观察表1可知参数上的差异值大部分小于3%,极个别情况的最大差异值在5%以内,这些差异值具有统计学意义,代表TPS和3DVH获得的同一靶区剂量参数是不同的,但是这个差异范围在临床可接受范围内。
2.2 危及器官的剂量差异
表2详细描述了基于TPS 和ArcCHECK-3DVH系统获得的鼻咽癌患者危及器官剂量结果。在3 mm/3%的标准下,所有危及器官的γ 通过率在93%以上,其中视交叉、晶体和眼球的γ通过率为100%。
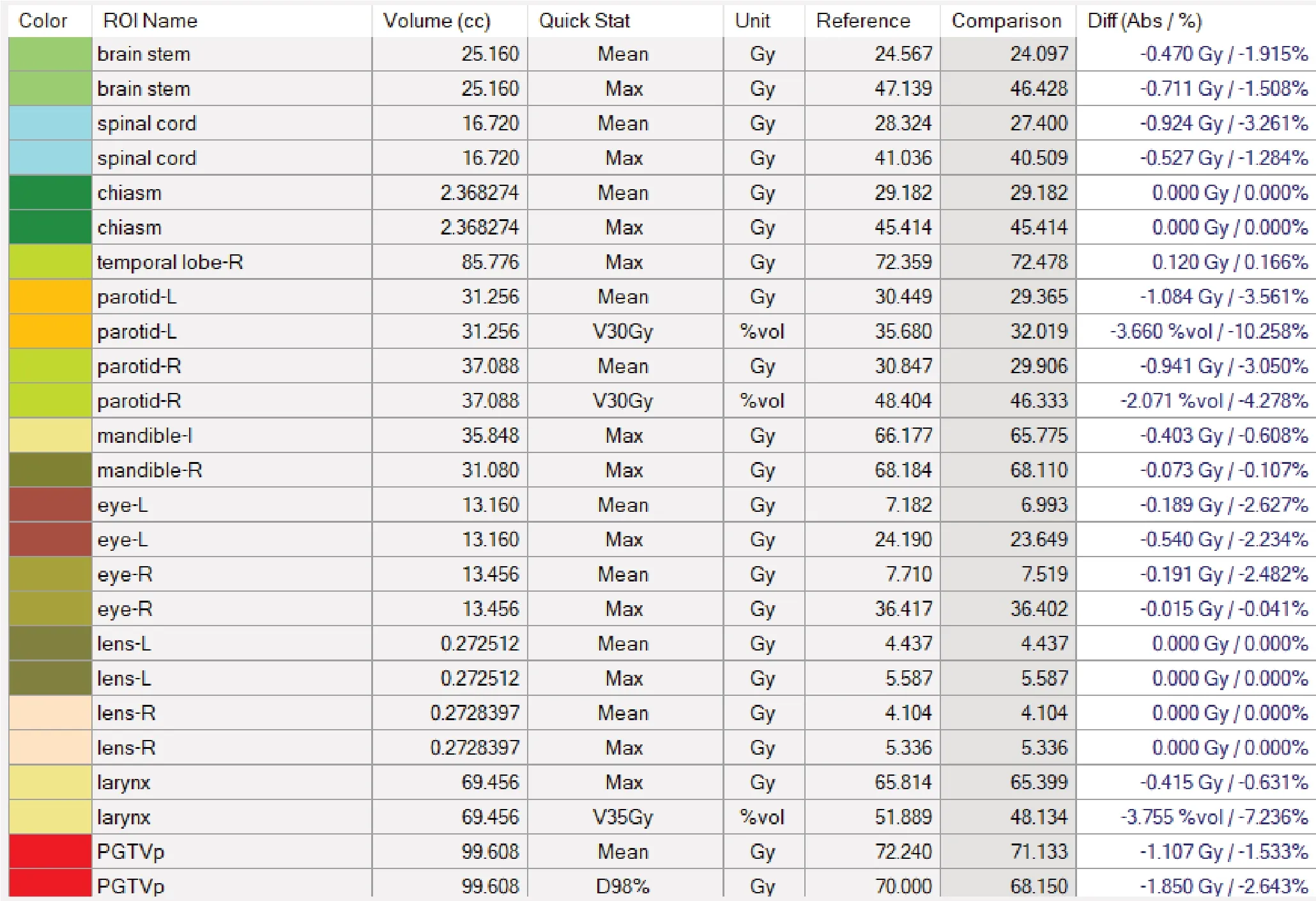
图2 基于TPS和3DVH软件获得的器官剂量差异值Fig.2 Organ dose differences based on TPS and 3DVH software
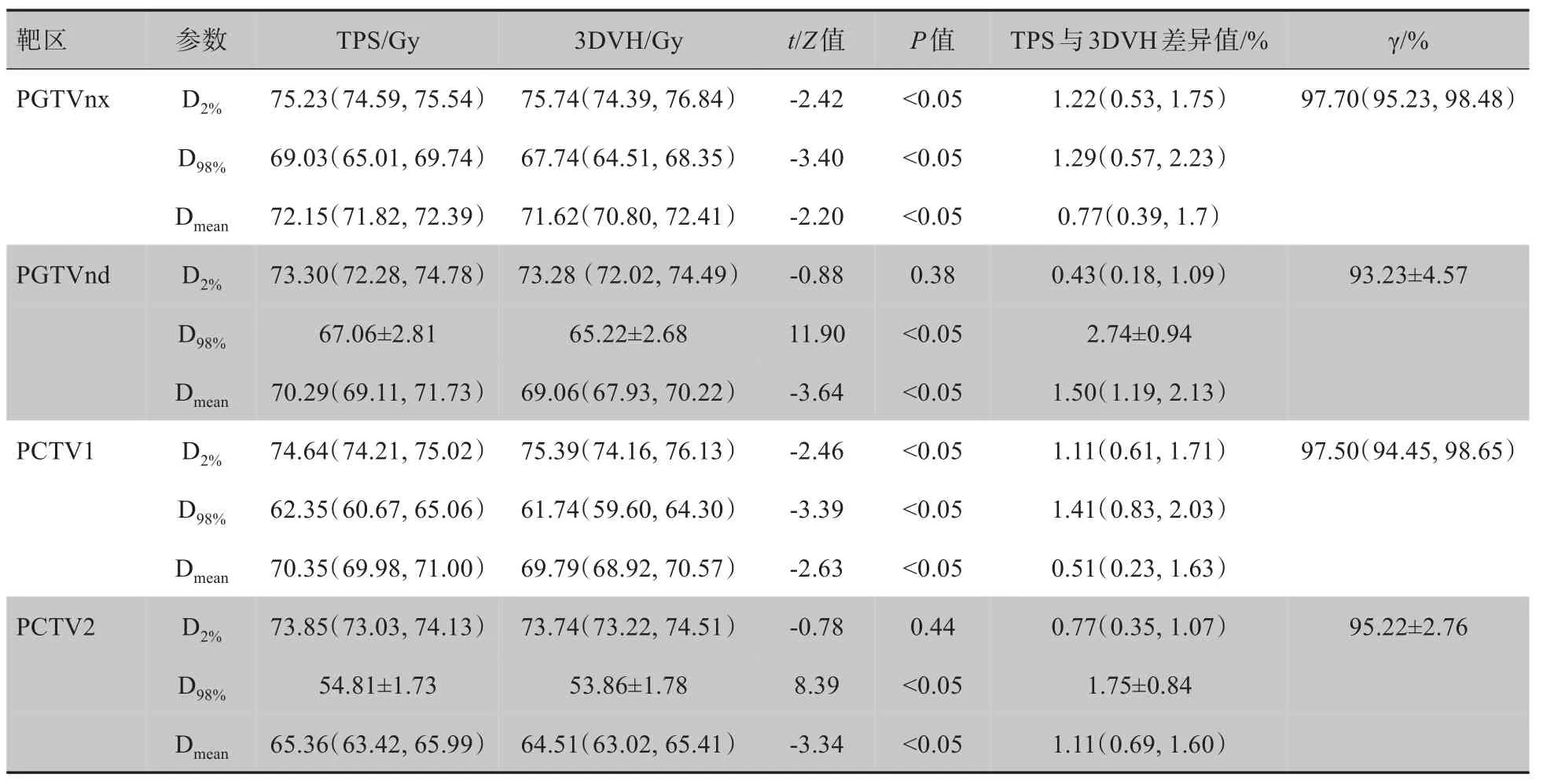
表1 基于Monaco TPS 和3DVH软件的靶区剂量学差异Tab.1 The dose differences calculated by the Monaco TPS and the software 3DVH for target
由TPS和3DVH软件计算的同一危及器官剂量存在差异。其中脊髓、视交叉、视神经、晶体、眼球、喉与下颌骨对应的Dmax差异值小于5%,且不具有统计学意义(P>0.05)。TPS和3DVH计算喉V35指的是体积百分比,且V35的差异值为8.89%±4.63%,具有统计学意义(P<0.05),TPS计算剂量大于3DVH重建剂量,其中20例患者中仅1例患者差异值近似15%,有2例患者剂量差异值小于3%,其余均在5%~13%;除以上描述情况外,危及器官对应的其他剂量参数差异值小于6%,均具有统计学意义(P<0.05)。
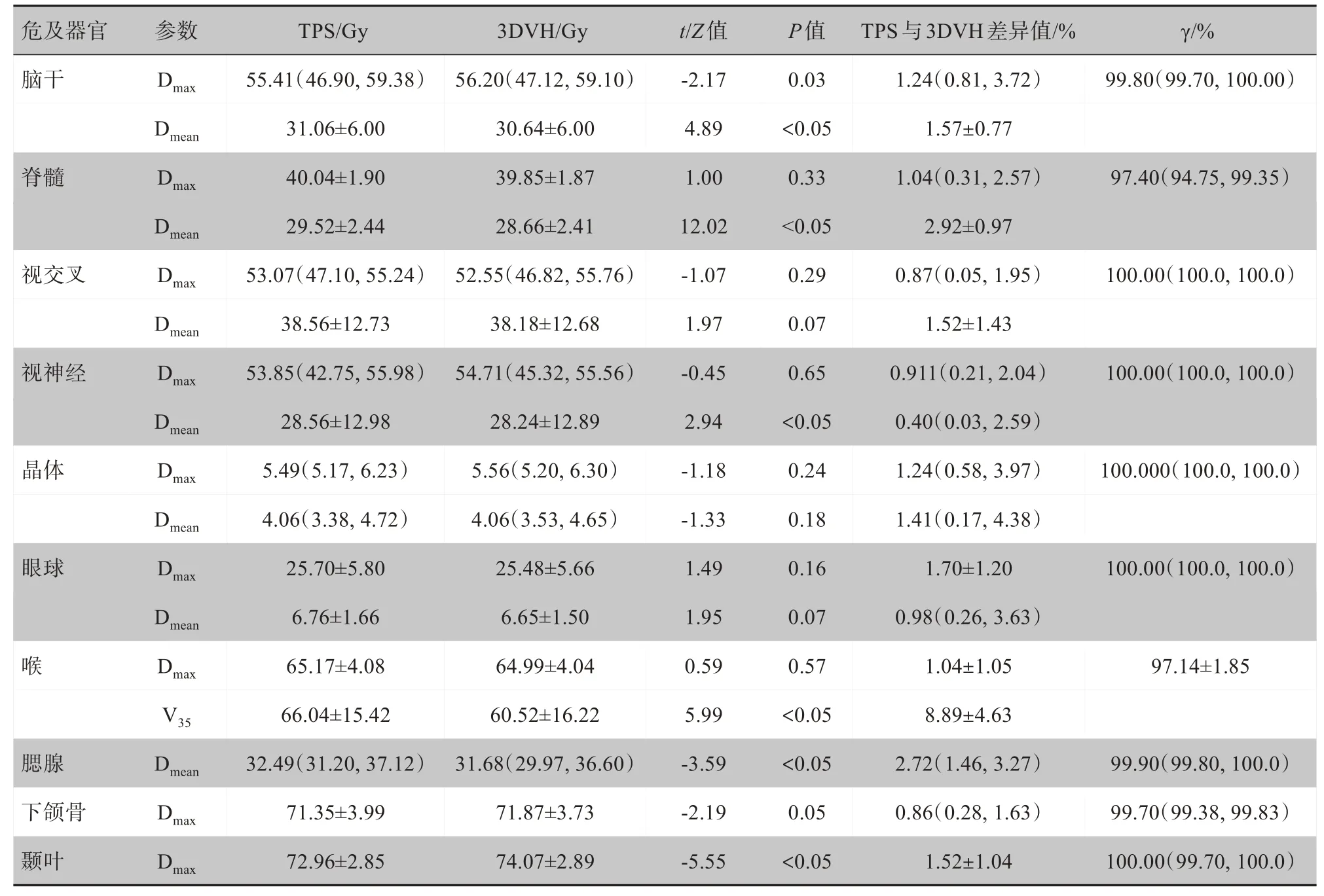
表2 基于Monaco TPS 和3DVH软件的危及器官剂量学差异Tab.2 The dose differences calculated by the Monaco TPS and the software 3DVH for OARs
3 讨论
VMAT 是一种复杂的IMRT 技术,它在治疗过程中伴随着MLC 和GANTRY 的运动,与此同时剂量率可变,因而治疗效率较高,它正被广泛应用于临床放射治疗。与传统的放疗计划相比,加速器执行过程的误差可能对VMAT 计划产生更大的剂量影响,因此VMAT的剂量验证工作也越来越重要。
目前的IMRT QA 设备也可用于VMAT QA 工作,如胶片、电离室、半导体阵列和电离室阵列等。但是胶片和电离室只可以测量点剂量和平面剂量,且二维剂量验证无法直观显示患者各个器官测量值和理论计算值的差异[6,17]。随着放疗技术的快速发展,三维剂量验证工作也开始备受关注。通过电子射野影像系统、机器日志、COMPASS 和Delta4 等方法均可进行三维剂量验证工作[7-8,10,18]。
ArcCHECK-3DVH 是一种三维剂量验证系统,既可以完成二维的平面剂量验证,也可进行基于患者CT 图像的三维剂量验证。国内已经深入研究了ArcCHECK 在各种癌症治疗计划中的二维剂量验证应用,这些研究结果显示相对γ通过率至少在95%以上,绝对γ 通过率至少在93%以上[11-14]。但是,从这些研究中,并不能获得靶区和危及器官的剂量情况,且无法知晓剂量偏差出现在患者具体的解剖位置,以及这些偏差是否被临床所接受。ArcCHECK-3DVH 中的3DVH 软件则基于患者的CT 图像、原始计划、QA plan、实际测量和PDP算法进行三维剂量验证,它能直观显示高量和低量区域,此系统的准确性在一些研究中得到证明[9,19-20]。
本研究利用ArcCHECK-3DVH 系统对基于Monaco TPS 的鼻咽癌VMAT 计划进行三维剂量验证。Monaco TPS 计算的20 例患者剂量与3DVH 重建的剂量,在3 mm/3%和阈值TH=10%标准下,三维γ 通过率为98.20%(97.75%, 99.20%),表明Monaco TPS 计算的患者靶区和危及器官剂量与3DVH 重建结果符合得很好。国外Saito 等[21]通过ArcCHECK-3DVH 和内部开发的 dynalog-based dose reconstruction(DBDR)系统重建患者体内器官三维剂量,这些患者均采用VMAT技术治疗,基于3DVH、DBDR 与TPS 计算剂量对比,γ 通过率(3 mm/3%)均达到99%以上,类似这样的γ 值结果就可被临床接受。但是,随着未来放疗技术的发展,只用γ 值评估剂量验证工作存在不足,除了γ 值外我们需要更丰富的剂量信息,以此来保证放射治疗的安全实施。本研究中利用3DVH 软件获得了每个靶区和危及器官的通过率和剂量差异情况。基于3DVH 软件和Monaco TPS 计算的PGTVnx、PCTV1 和PCTV2 通过率均大于90%,PGTVnd 通过率为93.23%±4.57%,其中有5 例患者的PGTVnd 通过率为84%~89%。对于这些结果我们进一步观察了PGTVnx、PGTVnd、PCTV1 和PCTV2 对应的D2%、D98%和Dmean值,发现差异值大部分小于3%,极个别情况的最大差异值在5%以内。对于这些差异,不可孤立只考虑靶区的某一个参数,正如PGTVnx 的D98%有1 例患者差异为4.41%,其余均在3%以内,而PGTVnx 的Dmean最大差异值为2.85%,其余均小于2%,PGTVnx 的D2%有1 例患者差异为3.71%,其余大部分在2%以内。综合多个参数和患者病情考虑,这个PGTVnx的差异值是可以被临床所接受的。所有危及器官γ 通过率在93%以上,其中视交叉和晶体的γ 通过率为100%,说明3DVH 软件重建这些危及器官剂量与TPS 计算的剂量差异较小;由TPS和3DVH软件计算的同一危及器官剂量差异值最大的是喉V35,但是喉V35中仅1 例患者差异值近似15%,有2 例患者剂量差异值小于3%,其余均为5%~13%。对于危及器官我们也观察多个指标,并寻找高量和低量出现的具体位置,结合患者实际情况进行分析。从以上分析可看出,TPS 和3DVH 计算剂量存在差异,这些差异来源包括以下几个方面:首先,3DVH 重建的患者体内三维剂量是根据PDP 算法在TPS 计算的患者体内剂量基础上得到的,PDP 算法在重建剂量过程中引入了校准因子,该校准因子来自于ArcCHECK 均匀模体上的测量结果与TPS计算结果的比值,此过程会引入一定程度的误差[22];另外,为了得到上述校准因子,需要将ArcCHECK 均匀模体测量的低分辨率数据进行变形与校准来变成高分辨率数据,之后才能与TPS计算的均匀模体剂量做比值[22]。而ArcCHECK 探头间距为1 cm,实际TPS 计算网格尺寸和间距通常小于1 cm,因此在上述变形与校准过程中也会引入误差;ArcCHECK 模体在摆位过程中存在误差,对剂量跌落梯度较大区域存在一定的影响;当被评估区域靠近探测器边缘时,测量值与TPS 计算值也存在差异[22]。国外也有许多研究者利用3DVH 系统进行放射治疗的三维剂量验证,得出了相似的结果。Tyagi等[17]评估了基于ArcCHECK-3DVH 和机器Logfile系统剂量重建的准确性,其中的10例患者采用SBRT或者SRS 技术,在3%/2 mm 标准下,采用3DVH 和Logfile 获得的γ通过率近似98%以上,PTV的剂量参数对应最大差异值为8.1%,小肠的剂量差异值为31.3%。Infusino 等[23]报道使用3DVH 进行Rapid Arc的三维剂量验证结果,其中靶区测量值系统性地高于TPS计划值。
综上所述,ArcCHECK-3DVH 除了可以提供二维剂量验证信息外,还可基于患者的CT 重建三维剂量,明确指出剂量差异的器官位置,有利于放射治疗前的QA工作和放疗计划的安全实施。