硝酮环加成反应的研究进展
2021-01-10张红霞施福富
张红霞, 施福富
(赛鼎工程有限公司,山西 太原 030032)
环加成反应是有机合成化学中一类非常重要的合成环状化合物的反应,而硝酮作为一种重要的有机试剂,其与含有各种不饱和键化合物发生的环加成反应研究已经引起了有机合成化学家浓厚的兴趣。硝酮化合物含有C=N-O基本官能团,通过其与各种不饱和官能团发生的分子间或者分子内环加成反应可以制备各种杂环化合物。本文针对近五年来硝酮与各种化合物发生的[3+2]、[3+3]、[4+2]和[4+3]等环加成反应进行了综述。
1 硝酮与C=C双键的环加成反应
2017年,Rescifina课题组[1]报道了利用γ-环糊精作催化剂催化N-甲基芳基硝酮与芳基烯烃的环加成反应。该反应以0.1当量的γ-环糊精作催化剂,水作溶剂于100 ℃下进行,可获得75%~85%的收率。该反应的优点是在绿色、无污染的条件下可高效地合成2-甲基-3,5-二芳基异噁唑烷化合物,且催化剂γ-环糊精可回收再用。
2017年,Feng课题组[2]完成了N-烃基硝酮与亚甲基吲哚啉酮进行的不对称环加成反应。该反应以10%(摩尔分数)的N,N’-二氧化合物/Co(BF4)2·6H2O作催化剂,乙酸乙酯作溶剂于0 ℃下在氮气氛围中进行。对反应广普性的研究表明,不同的亚甲基吲哚啉酮均可取得85%~99%的收率;对N-烃基硝酮的扩展表明,除了N-甲基硝酮只有45%的收率之外,其余硝酮均可取得72%~96%的收率和91%~99%的对映选择性。
2017年,Shibata课题组[3]报道了在手性Ni(ClO4)2·6H2O/双(恶唑啉)配合物催化作用下,利用β-氟烷基化α,β-不饱和2-吡啶砜与硝酮进行的不对称环加成来合成氟烷基化的异噁唑烷。反应广普性研究表明,当硝酮氮上为苯基时,不论其双键碳上的取代基是吸电子基还是供电子基取代的芳基,反应均可取得83%~97%的收率和87%~99%的对映选择性;当硝酮双键碳上的取代基为脂肪基,不管氮上是苯基还是苄基时,反应均可取得81%~93%的收率和83%~86%的对映选择性。对β-氟烷基化的α,β-不饱和砜进行拓展表明,大多数反应均取得68%~96%的收率和75%~95%的对映选择性。
2 硝酮与三键的环加成反应
2.1 硝酮与C≡C三键的环加成反应
2017年,Li课题组[4]利用N-叔丁基芳甲酰基硝酮羰基邻位碳的C-H活化并与炔烃的环化反应来合成萘酚。该反应以8%(摩尔分数)的[RhCp*(MeCN)3]-(SbF6)2和30%(摩尔分数)的Ni(OTf)2作催化剂,1.2当量的三甲基乙酸、0.3当量的柠檬酸和100 mg 0.4 nm分子筛作添加剂,1,2-二氯乙烷作溶剂于90 ℃下进行。反应广普性研究表明,不同的硝酮均可得到53%~87%的收率;此外,对称二芳基炔烃可取得61%~85%的收率,而1,2-二(3-噻吩基)乙炔仅得到37%的收率。
2.2 硝酮与C≡N三键的环加成反应
2017年,Kukushkin课题组[5]利用N-烷基二苯基硝酮与二烷基氨基腈发生的[3+2]环加成来合成5-氨基-2,3-二氢-1,2,4-噁二唑类化合物。该反应以10%(摩尔分数)的[Cu(NCMe)4](BF)4作催化剂,1,2-二氯乙烷作溶剂于45℃下进行。对二烷基氨基腈的拓展发现,当硝酮的氮上为甲基时,反应能取得45%~73%的收率;当硝酮的氮上为苄基时,反应取得28%~55%的收率。
3 硝酮与累积双键的环加成反应
2017年,Liu课题组[6]利用三氟甲基取代的丙二烯与N-甲基芳基硝酮进行的[3+2]环加成反应合成了三氟甲基化异噁唑烷,该反应中生成的异噁唑烷非常稳定,不易发生重排。反应广普性的研究表明,对于含有不同取代基的丙二烯和N-甲基芳基硝酮,反应均具有高的反应活性,并可取得86%~94%的收率。
4 硝酮与环状化合物的环加成反应
4.1 硝酮与三元环化合物的环加成反应
2015年,Selander课题组[7]报道了三元杂环化合物与硝酮的高选择性环加成反应。该反应以AlCl3或者InCl3作催化剂,乙腈、1,2-二氯乙烷或甲苯作溶剂于40 ℃~80 ℃下进行。广普性研究发现,当三元杂环为环氧乙烷时,其与硝酮的反应能取得25%~98%的收率;当三元杂环为氮杂环丙烷时,反应可以取得51%~90% 的收率;硫杂环丙烷与硝酮反应可取得中等的收率。
2015年,Nolin课题组[8]报道了硝酮与二酯基取代的环丙烷的非对映选择性环加成反应。该反应以2%(摩尔分数)的Ca(OTf)2作催化剂,乙腈作溶剂于70 ℃下进行。对环丙烷广普性的研究表明,当硝酮氮上的取代基为甲基时,反应均可取得83%~94%的收率;当硝酮氮上的取代基为苯基时,反应均可取得78%~99%的收率。对硝酮底物的扩展表明,富电子基和芳基取代的硝酮均可取得74%~95%的收率。
4.2 硝酮与四元环化合物的环加成反应
2015年,Tang课题组[9]报道了双(噁唑啉)/Cu(Ⅱ)配合物催化剂催化1,1-环丁二酯与硝酮的不对称[4+3]环加成反应。对环丁烷的广普性研究表明,当环丁烷酯基邻位碳上的取代基为4-苄氧基苯基、2-噻吩基、苯硫基或者烷氧基时,反应取得了54%~91%的收率和良好的对映选择性;对硝酮的扩展表明,大部分硝酮具有高的反应活性,并可取得56%~96%的收率。
5 硝酮与酰胺类化合物的环加成反应
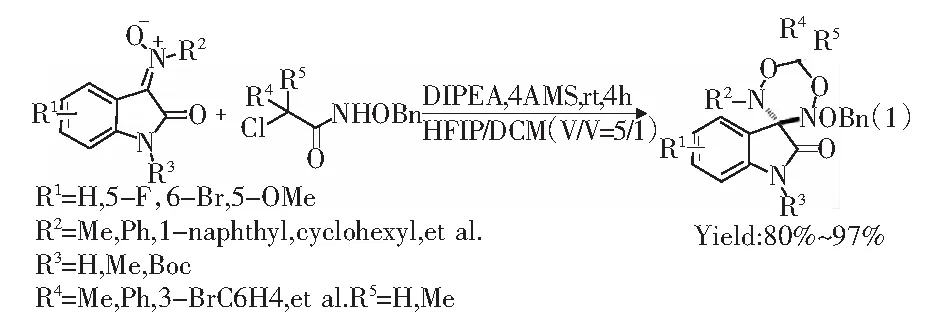
2017年,Chen课题组[10]报道了在二异丙基乙基胺(DIPEA)作用下,利用六氟异丙醇(HFIP)和1,2-二氯乙烷(DCM)作混合溶剂完成了α-氯代异羟肟酸酯与硝酮的反应来制备螺[1,2,4-噁二嗪-5-酮]羟吲哚类化合物。对硝酮的扩展表明,无论R1是缺电子基还是富电子基,反应均能取得88%~97%的收率;当R2为烷基、芳基或苯乙烯基时,反应均能取得83%~95%的收率。不同芳基与二甲基取代的α-氯代异羟肟酸酯均能取得88%~97%的收率。
2018年,Feng课题组[11]报道了在Na2CO3作用下利用N-(邻氯甲基)芳基酰胺与N-烷基芳基硝酮发生[4+3]环加成来制备七元环苯并恶二氮杂衍生物。对硝酮广普性的研究表明,当氮上为异丙基时反应仅取得25%的收率,其余的硝酮均可取得78%~99%的收率。对N-(邻氯甲基)芳基酰胺的考察发现,不论苯环上是何种取代基,也不管它在苯环的何种位置,反应均能取得79%~98%的收率。
6 结论与展望
综上所述,硝酮作为一种重要的有机试剂,它们可以与含有各种不饱和键的化合物进行各种不同类型的环加成反应来制备具有各种环状结构的天然产物和具有生物活性的化合物,因此,期待科研工作者不断地开发出硝酮与含有各种不饱和键化合物的环加成反应,并把这些反应逐渐应用到更复杂化合物的合成中。
