贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用
2021-01-10赵山山杨园园周玉岩刘贵巧郝光飞
赵山山,杨园园,周玉岩,刘贵巧,郝光飞
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056038;2.河北省药品检验研究院,河北石家庄 050011)
泡菜又称为腌渍菜,是利用新鲜蔬菜为原料添加八角、花椒、盐等辅料,经乳酸菌为主的多种微生物发酵制成的传统美食。蔬菜经过乳酸菌主导的厌氧发酵改善了蔬菜的风味,延长了蔬菜的贮藏期[1-2]。发酵过程中还产生了醇、醛、酮、烯和酯等风味物质,赋予了泡菜独特的风味[3]。泡菜中除了蔬菜中的营养成分外,还有发酵过程乳酸菌产生的有机酸和蛋白酶等物质,具有促进肠道蠕动,帮助人体消化,降低胆固醇,以及调节生理机能等保健功效[4-6]。泡菜以其独特风味和多种保健功效成为人们餐桌上必不可少的菜肴。
传统自然发酵方式发酵周期相对较长,生产效率低,食品安全问题难控制,难以实现大规模的工业化生产。针对这些问题国内外研究者对泡菜发酵过程中起主要作用的微生物菌群进行了研究。叶陵等[7]研究发现,乳杆菌属(Lactobacillus)是促使泡菜发酵成熟的主要菌群,主要包括植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)、短乳杆菌(Lactobacillus brevis)、戊糖乳杆菌(Lactobacillus pentosus)等。研究学者从发酵食品中分离得到具有不同发酵性能的菌株,如高产酸菌株[8]、耐盐菌株[9]和降解亚硝酸盐的乳酸菌[10]。其中高产酸、耐酸的乳杆菌能够控制泡菜发酵的周期,加速发酵蔬菜的快速成熟[11-12]。除此之外,还分离得到一些拮抗性乳酸菌,对大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)等有较强的抑制作用[13-14]。但是具有益生功能的乳酸菌多从酸奶中筛选得到,发酵泡菜中的筛选相对较少[15]。李清等[16]从贵州剑河采集的传统自然发酵豆酱中分离筛选的植物乳杆菌DJ-04对人工胃肠液表现出良好的耐受性,具有肠道益生菌的潜能。吴伟杰等[17]将分离获得的乳酸肠球菌(Enterococcusfaecium)WJ03接种发酵萝卜泡菜后,缩短了泡菜的发酵周期,改善了泡菜风味。由此可见,发酵蔬菜是潜在的优质乳酸菌的自然资源库,为制备不同种类的乳酸菌发酵剂提供了选择。
本研究从贵州遵义市采取的泡菜中分离筛选高产酸乳酸菌,通过形态观察、生理生化试验及分子生物学技术对其进行鉴定,并探究其耐酸、耐胆盐性能、抑菌性能和耐盐性能,获得具有多种优良性能的乳酸菌。最后,将筛选得到的优良乳酸菌应用到泡菜中,分析对比自然发酵泡菜和接种乳酸菌泡菜的各项指标,为泡菜的工业化生产和发酵剂的制备提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料泡菜样品:从贵州遵义市采集11份不同家庭制作的发酵泡菜;新鲜白萝卜:贵州农家。
1.1.2 菌株
大肠杆菌(Escherichia coli)ATCC 8739、金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538:美国菌种保藏中心(American type culture collection,ATCC);植物乳杆菌(Lactobacillus plantarum)ST-III:河北工程大学生命科学与食品工程学院微生物资源与利用实验室保藏。
1.1.3 试剂
氢氧化钠、氯化钠、无水乙醇(均为分析纯):天津欧博凯化工有限公司;牛胆盐(生化试剂):北京索莱宝科技有限公司。
1.1.4 培养基
MRS液体培养基、MRS固体培养基、明胶液化培养基、接触酶试验培养基、H2S产生试验培养基、硝酸盐还原试验培养基:国药集团化学试剂有限公司;糖发酵培养基:上海晶纯试剂有限公司;营养琼脂培养基、营养肉汤培养基:北京奥博星生物技术有限责任公司;LB培养基:上海博微生物科技有限公司;CaCO3-MRS固体培养基:在MRS固体培养基中加入1.5%的碳酸钙。
1.2 仪器与设备
SW-CJ-2D型超净工作台:苏州净化设备有限公司;DHG-9070A电热鼓风干燥箱、DHP-9162电热恒温培养箱:上海一恒科学仪器有限公司;Microfuge 20高速离心机:美国贝克曼库尔特公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、Power pac2000电泳仪、Universal Hood II凝胶成像仪:美国Bio-Rad公司;YXQ-LS-50SII立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;JTNJB牛津杯(内径为6.0 mm):北京吉泰远成科技有限公司;ZHPW-70台式振荡培养箱:天津市莱玻特瑞仪器设备有限公司;UV1901紫外可见分光光度计:杭州艾普仪器设备有限公司;OPTEC双目生物显微镜:重庆奥特光学仪器有限公司。
1.3 实验方法
1.3.1 乳酸菌的分离
在无菌条件下取样品中泡菜汁,用无菌生理盐水进行10倍梯度稀释。选取稀释度为10-4、10-5、10-6、10-7的稀释液1 mL于无菌培养皿中,用CaCO3-MRS固体培养基浇注混匀,凝固后37 ℃恒温倒置培养48 h[18]。挑取有明显溶钙圈,且溶钙圈较大的单菌落进行平板划线,37 ℃培养48 h,反复纯化多次。将纯化得到的单菌落接种到MRS肉汤培养基培养,所得菌液加入30%的甘油中在-20 ℃保存。
1.3.2 高产酸乳酸菌的筛选
将分离纯化的菌株接种于MRS液体培养基中,37 ℃厌氧培养24 h,参照文献[19]测定产酸量,选取产酸能力较高的菌株进行菌种鉴定。
1.3.3 乳酸菌的鉴定
形态观察:挑选筛选菌株的单菌落接种于MRS固体培养基,37 ℃条件下培养24 h,观察单菌落的色泽、形态、大小,并进行镜检,观察菌株的细胞形态。
生理生化实验:将筛选菌株进行革兰氏染色及过氧化氢酶实验,筛选出革兰氏染色阳性、过氧化氢酶阴性的菌株进行硝酸盐还原实验、明胶液化实验、吲哚实验、硫化氢实验和糖发酵实验[18],参照《伯杰细菌鉴定手册》(第八版)[20]、《乳酸菌细菌的分类鉴定与实验方法》[18]对菌种进行综合判定。
分子生物学鉴定:提取筛选乳酸菌的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用16S rDNA的通用引物27F(5'-AACTGAGTTTGATCCTGGCTC-3')、1492R(5'-TACGGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系:DNA模板1 μL,2×TaqPCR MasterMix 10 μL,双蒸水(ddH2O)7 μL,27F 1 μL,1492R 1 μL。PCR扩增条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃末端延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测。选取在1 500 bp左右的PCR扩增产物送至上海生物工程有限责任公司进行测序。DNA编码用DNA star软件中的Seq Man II进行序列拼接、校对;将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据中进行局部序列比对基本检索工具(basic local alignment search tool,BLAST)比对搜索,选取同源性较高的模式菌株的16S rDNA序列,采用MEGA5软件中的邻接(neighborjoining,NJ)法构建系统发育树[21]。
1.3.4 乳酸菌种子液的制备
将-80 ℃保藏的甘油管菌液37 ℃水浴,直至全部溶解。采用接种环沾取少量菌液,在MRS固体平板上划线,37 ℃倒置培养至长出单菌落。挑取单菌落接种到MRS液体培养基,37 ℃静置培养12 h后,连续转接3次,将菌液的菌体浓度调整至1×108CFU/mL作为种子液备用。
1.3.5 乳酸菌耐酸能力的测定
以3%(V/V)的接种量将乳酸菌种子液接种于MRS液体培养基中,37℃条件下静置培养12h。将菌悬液在10000r/min条件下离心1 min,弃上清液,用无菌生理盐水清洗菌体3次。用pH 2.0的盐酸水溶液重悬菌体,酸处理2 h后进行10倍梯度稀释,选取合适稀释度的稀释液,采用MRS固体培养基平板浇注法在37 ℃条件下培养48 h后,采用平板菌落计数法计算菌落数,并计算乳酸菌的存活率[22]。同时以未经酸处理的菌株作为对照,每个实验重复3次,每株菌每次实验做3个平行。乳酸菌耐酸存活率计算公式如下:
式中:N2为酸耐受2 h的活菌数,CFU/mL;N1为酸耐受前的活菌数,CFU/mL。
1.3.6 乳酸菌耐胆盐能力的测定
以3%(V/V)的接种量将乳酸菌种子液接种于MRS液体培养基中,37℃条件下静置培养12h。将菌悬液在10000r/min条件下离心1 min,弃上清液,用无菌生理盐水清洗菌体3次。用0.3%的无菌胆盐水重悬菌体,处理2 h后进行10倍梯度稀释,选取合适稀释度的稀释液,采用MRS固体培养基平板浇注法在37 ℃条件下培养48 h后,采用平板菌落计数法计算菌落数,并计算乳酸菌的存活率[22]。同时以未经胆盐处理的菌株作为对照,每个实验重复3次,每株菌每次实验做3个平行。乳酸菌耐胆盐存活率计算公式如下:
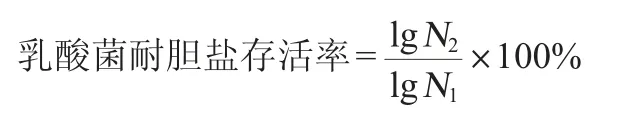
式中:N2为胆盐耐受2 h的活菌数,CFU/mL;N1为胆盐耐受前的活菌数,CFU/mL。
1.3.7 乳酸菌抑菌能力的测定
(1)指示菌株的活化
将大肠杆菌和金黄色葡萄球菌分别划线于营养琼脂培养基,37 ℃条件下培养48 h。然后挑取单菌落接种于营养肉汤培养基中,37 ℃、180 r/min条件下培养24 h。调整菌体浓度为1×107CFU/mL作为指示菌悬液。
(2)乳酸菌菌株上清液的制备
4)注意作为修正标记语的well,如果well处于话轮的中间,则为自己修正标记语;而处于话轮开始时,则为他人修正标记语。
以3%(V/V)的接种量将乳酸菌种子液接种于MRS液体培养基,37 ℃条件下静置培养12 h,10 000 r/min离心2 min后取上清液,4 ℃保存备用。
(3)牛津杯法测定抑菌性能[23]
向培养皿中倾注10 mL灭菌后的0.5%~0.8%营养琼脂培养基,水平静置凝固,接种100 μL指示菌菌液,涂布均匀后备用。用镊子将牛津杯垂直培养基表面均匀放置,牛津杯中加入100 μL乳酸菌上清液。4 ℃扩散2 h,37 ℃恒温培养24 h。用游标卡尺,采用十字交叉法测量抑菌圈直径,根据抑菌圈直径大小判断菌株抑菌性能。抑菌圈直径>7 mm时,判定为有抑菌作用。
1.3.8 乳酸菌的耐盐性能测定
初筛:以2%(V/V)的接种量将乳酸菌种子液接种于盐含量为8%的MRS液体培养基中,37 ℃条件下静置培养24 h,测定OD600nm值。观察各个菌株的生长情况。
复筛:将筛选出的菌株以2%(V/V)的接种量将种子液分别接种于盐含量为0、8%的MRS液体培养基中,37 ℃条件下静置培养,每2 h取样,测定OD600nm值[24]。用植物乳杆菌(Lactobacillus plantarum)ST-III作为对照组。每个实验重复3次,做3个平行。
1.3.9 优良乳酸菌发酵泡菜的制备及指标测定
(1)发酵泡菜的制备
人工接种组:将性能优良的乳酸菌接种于MRS液体培养基,37 ℃条件下静置培养24 h,5 000 r/min离心2 min,用无菌生理盐水将菌体冲洗干净。调整菌体浓度为1×108CFU/mL,菌种接种量为0、2%、4%、6%,加入与自然发酵组工艺相同的泡菜中,密封常温发酵。每3 d取样进行感官评价和pH值的测定。
(2)泡菜质量指标的测定
pH值的测定:采用pH计测定发酵后泡菜汁的pH值。
感官评价[25]:选取15名专业人员对自然发酵的泡菜和人工接种泡菜进行感官评价,满分9分,具体评分标准见表1。

表1 泡菜感官评分标准Table 1 Sensory evaluation standards of pickles
2 结果与分析
2.1 高产酸乳酸菌的筛选
从贵州泡菜样品中共分离出143株乳酸菌,根据在CaCO3-MRS固体培养基上形成透明的溶钙圈越大则产酸能力越强[7],挑选出11株产酸能力较强的菌株,其溶钙圈直径和产酸量见表2。

表2 筛选菌株的产酸能力Table 2 Acid-producing ability of screened lactic acid bacteria
由表2可知,菌株A50f7、A50b9、A50c2和A50b2产生的溶钙圈显著大于其他菌株(P<0.05),初步确定这4株菌产酸能力较强。根据菌株产酸量可以得出菌株A50f7、A50b9、A50c2和A50b2的产酸量显著高于其他菌株(P<0.05)。其中菌株A50f7、A50b9产酸量最高,分别为3.83 g/L和2.97 g/L。因此,确定菌株A50f7和A50b9为高产酸乳酸菌。
2.2 乳酸菌的鉴定结果
2.2.1 形态学鉴定
11株产酸能力较高的菌株的形态观察结果见表3。由表3可知,11株乳酸菌的菌落均为白色或乳白色,细胞均呈杆状,且均为革兰氏染色阳性菌(G+)。
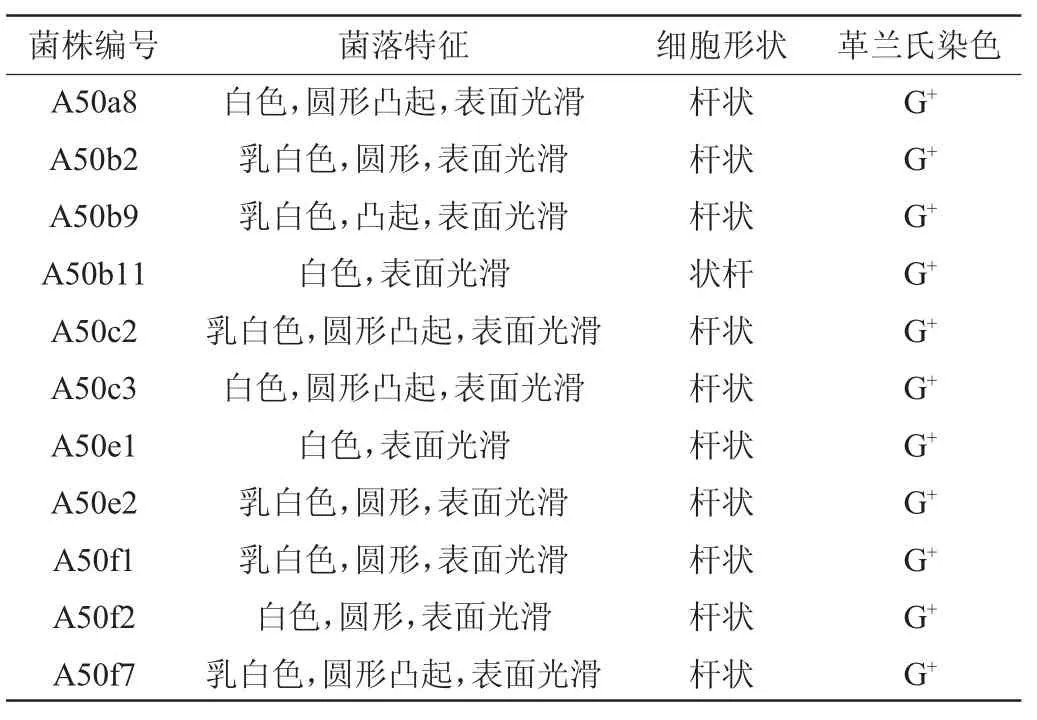
表3 不同菌株的形态学特征Table 3 Morphological characteristics of different strains
2.2.2 生理生化鉴定
根据《伯杰细菌鉴定手册》[20]和《乳酸菌细菌的分类鉴定与实验方法》[18],这11株菌株的发酵特征与植物乳杆菌一致,可以利用葡萄糖发酵,不运动、不产生吲哚、不液化明胶、不产生H2S、不还原硝酸盐,可以发酵苦杏仁苷、阿拉伯糖、纤维二糖、七叶灵、果糖、半乳糖、乳糖、麦芽糖、甘露糖、甘露醇、核糖、水杨苷、山梨醇、蔗糖、棉籽糖、海藻糖和木糖。结合菌株形态学鉴定结果可以初步鉴定这11株菌为植物乳杆菌(Lactobacillus plantarum)。
2.2.3 分子生物学鉴定[26]
11株乳酸菌的系统发育树见图1。由图1可知,菌株A50a8、A50b9、A50b11、A50c2、A50c3与植物乳杆菌(Lactobacillus plantarum)ST-III(GenBank登陆号:FJ423546)聚于一支,亲缘关系最近,因此,将这5株菌鉴定为植物乳杆菌(Lactobacillus plantarum)。菌株A50e2、A50f7、A50f2、A50b2、A50f1、A50e1与副植物乳杆菌(Lactobacillus paraplantarum)BIM B-535(GenBank登录号:JF965381.1)聚于一支,亲缘关系最近,因此,将这6株菌株鉴定为副植物乳杆菌(Lactobacillus paraplantarum)。

图1 基于16S rDNA基因序列11株菌株的系统发育树Fig.1 Phylogenetic tree of 11 strains based on 16S rDNA genes sequences
2.3 乳酸菌耐酸能力的测定
人的胃液pH值在1.5~4.5之间,其pH值的大小因食物结构不同而波动。乳酸菌能够耐受胃液中高酸性环境,才能进入到肠道中定殖。因此,菌株需对酸性环境具有一定耐受能力。分离筛选得到的11株乳酸菌,在pH 2.0条件下处理2 h,其耐酸能力见表4。

表4 不同乳酸菌的酸耐受能力Table 4 Acid tolerance of different lactic acid bacteria strains
由表4可知,11株乳酸菌经过pH 2.0的酸溶液处理2 h后均能存活,存活率均达到87%以上,说明这11株乳酸菌均具有良好的耐酸性能。其中,菌株A50f7和A50b9的存活率较高,活菌数达到了108CFU/mL以上,耐酸存活率分别为(99.19±0.39)%和(98.17±0.06)%。因此,菌株A50f7、A50b9可以作为具有潜在益生特性的耐酸乳酸菌菌株。
2.4 乳酸菌耐胆盐能力的测定
人体的肠道环境胆盐浓度通常为0.03%~0.30%,因此菌株进入肠道定殖,并能发挥益生功能,必须对胆盐有一定耐受能力。菌株经过0.30%的胆盐溶液处理2 h后,11株乳酸菌的耐胆盐能力见表5。

表5 不同乳酸菌的胆盐耐受能力Table 5 Bile salt tolerance of different lactic acid bacteria strains
由表5可知,11株乳酸菌表现出不同的耐胆盐能力。其中,菌株A50b9、A50e2、A50c3、A50a8、A50f7的耐胆盐能力较好,存活率均在70%以上。0.3%的胆盐溶液处理2 h后其中菌株A50f7、A50b9的活菌数达到了107CFU/mL以上,存活率分别为(85.36±0.78)%和(81.98±0.55)%。
2.5 乳酸菌抑菌能力的测定
蔬菜表面附着的大量微生物中含有大量的腐败菌和致病菌,使食品的安全性受到影响。乳酸菌在代谢过程中可以产生具有高效、无毒、耐高温、无残留、无抗药性等特点的乳酸菌细菌素,对细菌、真菌,甚至病毒均有抑制作用[27],对泡菜具有防腐保鲜的作用。本研究利用大肠杆菌和金黄色葡萄球菌为指示菌,研究11株乳酸菌的抑菌能力,结果见表6。

表6 不同乳酸菌的抑菌能力Table 6 Bactericidal capacity of different lactic acid bacteria strains
由表6可知,11株乳酸菌对大肠杆菌和金黄色葡萄球菌均有不同程度的抑制作用。其中,菌株A50f7和A50b9的抑菌能力显著高于其他菌株(P<0.05),对大肠杆菌的抑菌圈直径分别为(15.49±0.65)mm和(13.62±1.13)mm,对金黄色葡萄球菌的抑菌圈直径分别是(14.89±0.34)mm、(14.02±0.67)mm。结果表明,菌株A50f7、A50b9对大肠杆菌和金黄色葡萄球菌均有较强的抑制作用。
2.6 乳酸菌耐盐性能的测定
乳酸菌的耐盐能力是用于制作泡菜的重要指标[28]。研究表明,高浓度的盐会导致细胞内水分外流,细胞胞质分离,最终致使细胞停止生长,甚至死亡[29]。泡菜中盐浓度过高会延长泡菜的发酵周期,间接影响泡菜的风味[30]。但一定的盐浓度可以抑制腐败微生物的生长,防止泡菜腐烂变质。初筛结果显示,11株乳酸菌菌在含有8%NaCl的MRS液体培养基中培养24 h后,菌株A50f7、A50b2、A50b9、A50b11、A50c2生长情况较好,将这5株乳酸菌进行复筛,复筛结果见图2。

图2 在无NaCl(a)及8%NaCl含量(b)条件下5株乳酸菌的生长曲线Fig.2 Growth curves of 5 lactic acid bacteria strains without NaCl (a)and with 8% NaCl (b)
由图2a可知,在不含NaCl的培养基中,6株乳酸菌培养2 h后进入对数期,乳酸菌A50f7、A50b9、ST-III培养12 h时进入稳定期,乳酸菌A50b2、A50b11、A50c2延滞期较长,生长较为缓慢,培养14 h时进入稳定期。
由图2b可知,6株乳酸菌在含有8%NaCl的MRS液体培养基中生长时均受到抑制,乳酸菌A50f7、A50b9、ST-III生长速度显著高于其他菌株,且生长曲线相似,培养10 h时开始进入对数期,26 h时进入稳定期。乳酸菌A50b2、A50b11、A50c2延滞期较长,14 h时开始进入对数期,培养28 h时进入稳定期。综合以上实验结果,选取乳酸菌A50f7、A50b9进行泡菜发酵实验。
2.7 乳酸菌发酵泡菜结果分析
乳酸菌发酵蔬菜过程中产生大量的酸能快速降低泡菜pH值,抑制腐败菌生长,防止泡菜腐败变质,延长泡菜保质期,并能促进泡菜色泽的形成,加快泡菜发酵,缩短泡菜发酵周期。乳酸菌A50f7和A50b9的不同接种量对发酵泡菜pH值的影响结果见图3,不同接种量发酵的泡菜的感官评价结果见表7。
由图3可知,发酵0~3 d发酵体系的pH值下降较为明显,且下降速度为乳酸菌A50f7>乳酸菌A50b9>自然发酵;发酵12~15 d发酵体系的pH值下降速度趋于平缓,泡菜发酵成熟,发酵成熟所需时间为乳酸菌A50f7<乳酸菌A50b9<自然发酵。说明人工接种乳酸菌缩短了发酵泡菜达到泡菜所需pH值的发酵时间,提高了发酵泡菜的生产率。
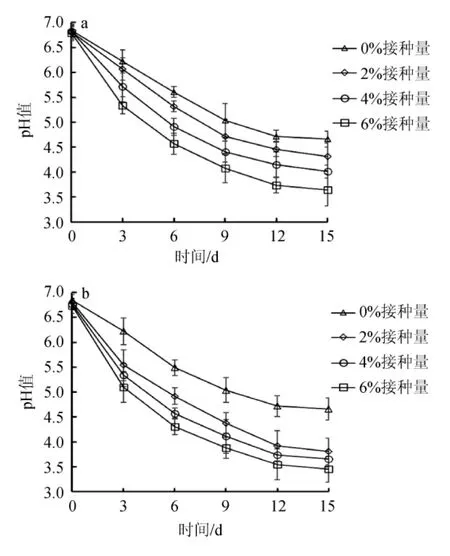
图3 乳酸菌A50b9(a)及A50f7(b)不同接种量对发酵泡菜pH值的影响Fig.3 Effect of different inoculum of lactic acid bacteria A50b9 (a) and A50f7 (b) on pH value of fermented pickle

表7 不同接种量乳酸菌发酵的泡菜的感官评价结果Table 7 Sensory evaluation results of pickles fermented by lactic acid bacteria with different inoculum
由表7可知,综合色泽、气味、滋味、脆度评分,当乳酸菌接种量为4%时得分由高到低依次是乳酸菌A50f7>乳酸菌A50b9>自然发酵。但是滋味评分中乳酸菌A50b9>乳酸菌A50f7>自然发酵,说明菌种不同发酵泡菜的品质也有所不同。而且当乳酸菌的接种量过大时,会对泡菜风味有一定程度的破坏。证明了人工接种适量乳酸菌发酵泡菜可以提高泡菜的品质和风味,有效的缩短泡菜的发酵周期。说明乳酸菌A50b9、A50f7具有做为泡菜发酵剂的潜能。
3 结论
本研究从贵州遵义市自制泡菜中分离得到143株乳酸菌,筛选得到11株产酸量较高的乳酸菌,产酸量均在1.89 g/L以上,经鉴定5株为植物乳杆菌(Lactobacillus plantarum),6株为副植物乳杆菌(Lactobacillus paraplantarum),11株高产酸乳酸菌经过耐酸、耐胆盐、抑菌和耐盐性能的测定筛选得到兼有多种优良发酵性能的乳酸菌A50f7和A50b9并应用于泡菜。接种4%乳酸菌A50f7可以改善泡菜的品质和风味,发酵12 d就能达到所需pH值,缩短了泡菜的发酵周期,解决了工业生产中泡菜发酵周期长,生产效率低等问题,为乳酸菌泡菜发酵剂开发的菌种选育提供了依据。
