纳豆芽孢杆菌发酵菜用大豆中纳豆激酶的提取及其性质分析
2021-01-10李秀凉李倩文韩晓云孙庆申
李秀凉,李倩文,朱 玉,韩晓云,孙庆申,宋 永
(1.黑龙江大学农业微生物技术教育部工程研究中心,黑龙江哈尔滨 150500;2.黑龙江大学生命科学学院黑龙江省普通高等学校分子生物学重点实验室,黑龙江哈尔滨 150080;3.黑龙江大学生命科学学院黑龙江省普通高等学校微生物重点实验室,黑龙江哈尔滨 150080)
纳豆激酶(nattokinase,NK)是从传统发酵食品纳豆中获得的一种丝氨酸蛋白酶,是微生物中唯一的纤维蛋白溶解酶[1-2],因其具有极强的溶栓活性、安全、高效、体内半衰期长等特点,被认为是一种很有研究价值和应用前景的溶栓剂,它不仅可预防血栓形成,还能抵抗高血压和动脉粥样硬化等疾病的发生[3]。有研究将纳豆激酶与野樱莓、红参和香菇复配,该产品具有消炎和抗氧化作用,从而能改善胰岛素分泌,缓解2型糖尿病症状及其并发症[4]。此外,近期研究发现纳豆激酶还具有抑制乳腺癌细胞生长的功能[5]。
目前市面上纳豆激酶的主要来源是纳豆。纳豆是一种传统的发酵保健食品,由煮熟的大豆接种纳豆菌发酵制得[6],它作为一种历史悠久的传统食物,其中的活性成分赋予了纳豆多种保健功能[7-8],因此,各种纳豆深加工产品如纳豆激酶软糖、压片糖果和胶囊等相继出现[9]。近年来,各国学者对纳豆开展了广泛的研究,包括菌种分离[2],不同原料制备纳豆[10-12],纳豆激酶发酵条件的优化[13-14]、分离提取、酶学性质研究[15-17]等。
菜用大豆也叫鲜食大豆,其主要特点在于鲜采食用,含有丰富的营养元素及食用蛋白质,对预防心脑血管疾病具有一定效果[18]。以菜用大豆等外品作为发酵原料,生产纳豆激酶,不仅能够提高这些菜用大豆的附加值,也为相关企业延伸产业链提供了新的思路。
1 材料与方法
1.1 材料与试剂
纳豆芽孢杆菌(Bacillus subtilis)菌粉:日本有限会社高桥祐藏研究所;菜用大豆:山东阳光农业生物科技有限公司;琼脂糖(生化试剂)、微生物纳豆激酶酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒:上海酶联生物科技有限公司;凝血酶(1 000 U)、尿激酶(58 491 IU/mL)、纤维蛋白原(蛋白含量50%~70%)、二乙氨乙基(dicthylaminoethyl,DEAE)阴离子交换柱(S14024-100g):上海源叶生物科技有限公司;二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒:江苏凯基生物技术股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MLS-3781-PC高压蒸汽灭菌锅:日本松下健康医疗器械;SW-CJ-2F(D)生物洁净工作台:苏州净化设备有限公司;VersaMAX美谷MD酶标仪:美谷分子仪器(上海)有限公司;A560型双光束紫外可见分光光度计:翱艺仪器(上海)有限公司;BSZ-160自动部份监测器:上海精科实业有限公司;BTP冷冻干燥机:美国SP Virtis公司;HZQ-X 100振荡培养箱:哈尔滨市东联电子技术开发有限公司。
1.3 方法
1.3.1 纳豆的制备工艺流程
菜用大豆→挑选、清洗→灭菌蒸熟→接种→发酵→4 ℃后熟→纳豆成品
操作要点:
菜用大豆经过挑选,以除去过于破碎的豆粒,再经过清洗、沥干,称取一定质量后分装入三角瓶,用三层纱布封口后蒸熟(121 ℃恒温15 min),然后保持其温度在50 ℃左右备用。称取纳豆芽孢杆菌直投式菌粉0.1 g,加入40 ℃左右的温水10 mL进行混匀,取样进行适度稀释后,通过平板计数确定每毫升菌液中的活菌数以后,向蒸熟的菜用大豆中接入不同体积的菌液,并混匀,用纱布封口后放置于不同温度(35~41 ℃)恒温培养箱中,保持纱布的湿润,防止水分的蒸发。在发酵不同时间点将发酵好的纳豆从培养箱中取出,放入4 ℃冰箱中后熟不同时间,得到不同的纳豆成品。
1.3.2 纳豆激酶提取液的制备
将后熟好的纳豆取出,倒入平板中于-20 ℃预冻6 h后,真空冷冻干燥过夜,冻干后使用万能粉碎机进行打粉,将纳豆冻干粉和生理盐水按照料液比为1∶10(g∶mL)的比例混匀,放入4 ℃冰箱中盐溶12 h后,在4 ℃条件下10 000 r/min离心15 min,弃去沉淀,保留的上清液使用医用脱脂棉过滤掉脂肪组织和其他的不溶物质,处理后所得的澄清液体即为纳豆激酶提取液。
1.3.3 蛋白质含量和纳豆激酶活性分析
(1)蛋白质含量测定
利用BCA试剂盒测定纳豆激酶提取液中的蛋白质含量,具体操作按照试剂盒说明书进行。在562 nm波长条件下测得标准蛋白含量(x)与吸光度值(y)关系曲线的回归方程为y=0.055 8x+0.112 1(R2=0.999 1)。根据标准曲线回归方程计算纳豆激酶粗提液中的蛋白质含量。
(2)纳豆激酶活性测定
采用酶联免疫吸附法[2],具体操作按照试剂盒说明书进行,以空白孔调零,依序测量各孔的吸光度值(OD450nm值),在加终止液后15 min内完成测定。
1.3.4 纳豆发酵条件的优化
单因素试验:以纳豆激酶活性为评价指标,根据纳豆发酵工艺的关键点设计发酵时间(12 h、24 h、36 h、48 h)、发酵温度(35 ℃、37 ℃、39 ℃、41 ℃)、接种量(0.580×1011CFU/100 g、1.150×1011CFU/100 g、1.730×1011CFU/100 g、2.300×1011CFU/100 g)和后熟时间(6 h、12 h、18 h、24 h)4个影响因素。
在单因素试验基础上,选取发酵时间、接种量、后熟时间3个单因素,每个因素设置3个水平,每个水平进行3次重复,以确定产酶活最佳发酵条件。正交试验因素与水平见表1。

表1 纳豆发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization of natto
1.3.5 纳豆激酶的纯化
(1)硫酸铵分段盐析
取30 mL纳豆激酶粗提液,采用固体加入法向其中缓慢地加入研磨后的硫酸铵固体粉末,使其最终分别达到20%、40%、60%和80%的饱和度,并在4 ℃条件下静置过夜析出蛋白质。然后在4 ℃、10 000 r/min条件下离心15 min,将沉淀用pH 7.4的磷酸盐缓冲溶液复溶后,装入事先预处理好的透析袋(截留分子质量为8 000~14 000 Da,纳豆激酶的分子质量>14 000 Da,所以会留在透析袋内)中,两端夹好,确保没有液体漏出。处理好后放入蒸馏水中在4 ℃下透析24 h,每隔4 h更换一次蒸馏水,透析后测定蛋白质含量及酶活性。以硫酸铵饱和度(%)为横坐标,总蛋白含量(μg)和总酶活力(IU)为纵坐标作双Y轴折线图。
(2)DEAE阴离子交换柱处理
本实验选用了DEAE阴离子交换柱层析纯化纳豆激酶,具体操作如下:填料(DEAE)保存于体积分数75%乙醇溶液中,用时先将乙醇倾倒出,再用蒸馏水反复清洗至没有乙醇味,用超声波仪除去气泡。然后取50 cm×φ1.5 cm的层析柱关闭其出水口并向其注入1/3柱高的pH 7.4的磷酸盐缓冲溶液,然后缓慢加入溶胀好的柱填料,小心倾倒,防止气泡产生,同时打开出水口,使其在距离柱顶的1/3处时停止沉降。当上层溶液完全澄清,就可以打开恒流泵用适当流速压柱子,填料的体积不再变化后,继续平衡一段时间后,将1.5 mL样品加入填料的上方,待样品完全进入柱填料后,开始用1.5 mL/min的流速进行洗脱,用紫外分光光度计在波长280 nm条件下进行检测,自动部份收集器收集吸收峰,然后进行冷冻干燥,于-20 ℃条件下备用保存。
(3)SDS-PAGE电泳检测
参考文献[19]的方法配制分离胶和浓缩胶。采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamidegelelectrophoresis,SDS-PAGE)垂直板电泳法,比较各步分离纯化效果,并测定纳豆激酶的分子质量。
1.3.6 纳豆激酶酶学性质
最适温度:将所得纳豆激酶粗酶液分别置于30℃、37℃、40 ℃、50 ℃、60 ℃、70 ℃反应15 min,加入制备好的纤维蛋白平板的孔中,37 ℃保温18 h,测量透明溶圈直径,以其中最高酶活力时的温度相对应的纳豆激酶的酶活力为100%,其余温度下的酶活力与最高酶活力的比值为该温度条件下的相对酶活力。
热稳定性:将所得纳豆激酶粗酶液在不同温度(30 ℃、40 ℃、50 ℃、60 ℃)分别处理10 min、20 min、30 min、60 min后,立即冰浴冷却,确定酶的热稳定性。以不做任何热处理的酶液的酶活力为100%,其余温度下的酶活力与最高酶活力的比值为该温度下的相对酶活力。
最适pH:将所得纳豆激酶粗酶液分别与pH值为2~12的磷酸盐缓冲液(phosphate buffer solution,PBS)反应15 min,加入到制备好的纤维蛋白平板中的孔中保温18 h,以其中最高酶活力时的pH值相对应的纳豆激酶的酶活力为100%,其余pH值下的酶活力与最高酶活力的比值为该pH值下的相对酶活力。
pH值稳定性:将所得纳豆激酶粗酶液分别与不同pH值(5~10)的缓冲液混合均匀,在37 ℃条件下处理1 h后测定酶活性,以其中最高酶活力时的pH值相对应的纳豆激酶的酶活力为100%,其余pH值下的酶活力与最高酶活力的比值为该pH值下的相对酶活力。
1.3.7 纳豆激酶体外溶栓效果的研究
取新鲜猪血于烧杯中使其凝固,将其切割成大小均匀、质量相近的血凝块,吸干多余水分后准确称质量,分别置于试管中。分别取经过硫酸铵分段盐析并透析后的冻干酶粉10 mg和20 mg溶于1 mL生理盐水,混合均匀后加入试管内(10 mg/mL的酶活力大小约为2 285.33 IU/mL,20 mg/mL约为4 556.98 IU/mL)。以生理盐水为对照组,每组设置3个平行,在37 ℃恒温下水浴,分别在5 h和10 h后将血凝块取出,吸干多余水分后称质量。血凝块的溶解率计算公式如下:

式中:m为溶解前血块质量,g;m1为溶解后血块质量,g。
1.3.8 数据处理
所有实验进行3次重复,利用Origin 9.0软件进行数据分析,结果表示为“平均值±标准差”。
2 结果与分析
2.1 菜用大豆产纳豆激酶发酵条件优化的单因素试验
2.1.1 发酵时间对酶活性的影响
按照每100 g灭菌蒸熟后的菜用大豆中接种1.150×1011CFU/100 g纳豆枯草芽孢杆菌直投式发酵剂,于37 ℃分别静置培养12 h、24 h、36 h、48 h,发酵完成后放入4 ℃冰箱中后熟12 h,分别测定纳豆激酶活性,结果见图1。

图1 发酵时间对酶活性的影响Fig.1 Effect of fermentation time on enzyme activity
由图1可知,发酵时间在12~48 h的范围内,纳豆激酶活性先增加后减少,在36 h时,酶活力达到最大值。36 h之后,酶活力开始降低,纳豆激酶的产量不会继续增加,菌种代谢或菜用大豆等外品内部物质的转化产生酶抑制剂或者纳豆激酶会进一步转化或降解为其他物质,所以导致后期的酶活性降低[20-21]。发酵时间太短,发酵不完全,菜用大豆等外品中的营养物质不能被完全利用。而发酵时间过长,一方面会导致酶活力降低,另一方面,产生的氨味也会更加的明显,令人不悦。因此,最佳发酵时间为36 h。
2.1.2 发酵温度对酶活性的影响结果
按照每100 g灭菌蒸熟后的菜用大豆中接种1.150×1011CFU/100 g纳豆枯草芽孢杆菌直投式发酵剂,于温度为35 ℃、37 ℃、39 ℃、41 ℃条件下恒温静置培养36 h,发酵完成后放入4 ℃冰箱中后熟12 h,分别测定纳豆激酶活性,结果见图2。

图2 发酵温度对酶活性的影响Fig.2 Effect of fermentation temperature on enzyme activity
由图2可知,当温度在35~41 ℃的范围内,纳豆激酶活性呈现先上升后下降的变化趋势,当发酵温度为37 ℃时,纳豆激酶活性达到最大值,表明纳豆菌可以充分地生长繁殖,并且产生的纳豆激酶具有较高的活性。在菜用大豆等外品的发酵过程中,温度对纳豆枯草芽孢杆菌的生长以及纳豆菌对营养物质的分解利用程度有着一定的影响,并且过低或过高的温度都不利于纳豆菌的生长和纳豆激酶活性的增加,因此,最佳发酵温度为37 ℃。
2.1.3 接种量对酶活性的影响结果
分别向每100 g灭菌蒸熟的菜用大豆中接种0.580×1011CFU、1.150×1011CFU、1.730×1011CFU和2.300×1011CFU直投式发酵剂,放入预设温度为37 ℃的恒温培养箱中培养36 h,发酵完成后放入4 ℃冰箱中后熟12 h,分别测定纳豆激酶活性,结果见图3。

图3 接种量对酶活性的影响Fig.3 Effect of inoculum on enzyme activity
由图3可知,在本实验的接种量范围内,纳豆激酶的活性随接种量的增加先上升后下降,在接种量为1.150×1011CFU/100g时酶活力达到最大。过高过低的接种量都不利于菌种的生长繁殖。当接种量低于1.150×1011CFU/100 g之前,培养基营养丰富,随着接种量增加,纳豆菌开始快速的不断繁殖,纳豆激酶的产量逐渐增加,酶活性也呈增大的趋势;当接种量>1.150×1011CFU/100 g时,由于菌体对氧气及营养物质的竞争加剧,所以其繁殖会受到限制,使酶活性开始下降。因此,最佳接种量为1.150×1011CFU/100 g。
2.1.4 后熟时间对酶活性的影响结果
在灭菌蒸熟后的菜用大豆中按照1.150×1011CFU/100 g的接种量进行接种,放入37 ℃恒温培养36 h,发酵完成后放入4 ℃冰箱中分别后熟6 h、12 h、18 h、24 h,分别测定纳豆激酶活性,结果见图4。
由图4可知,纳豆激酶活性随着后熟时间的延长呈现先增大后降低的趋势,在后熟时间为12 h时达到最大。而当纳豆的后熟时间超过12 h,酶活力开始降低。对于发酵食品来说,这可能是由于纳豆激酶随着后熟时间的延长而进行转化或是开始降解,也可能由于在后熟过程中会产生特殊的活性物质对其有一定的抑制作用,并且随后熟时间的不断延长,这种物质会继续增加,导致纳豆激酶活性逐渐降低。因此,最佳后熟时间为12 h。
2.2 纳豆发酵条件优化正交试验
根据单因素试验结果,选取对纳豆激酶活性有主要影响的3个因素按照3因素3水平进行正交试验,按照L9(33)正交试验设计,以纳豆激酶的酶活性作为评价指标,正交试验结果与分析见表2。

表2 纳豆发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization of natto
由表2可知,纳豆最佳发酵条件:接种量为1.150×1011CFU/100 g菜用大豆,发酵温度37 ℃,发酵时间36 h,后熟时间18 h。
2.3 纳豆激酶的分离纯化
2.3.1 硫酸铵盐析结果
向纳豆粗酶提取液中缓慢加入研磨后的硫酸铵固体粉末,分别使硫酸铵的饱和度达到20%、40%、60%和80%。将离心后所得沉淀复溶并透析24 h,分别测定各组中所含有的纳豆激酶活性大小以及蛋白质的含量,结果见图5。
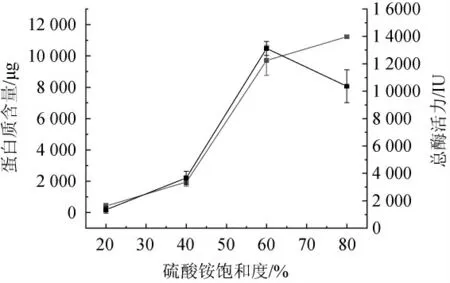
图5 不同饱和度硫酸铵对纳豆激酶活性的影响Fig.5 Effect of different saturation ammonium sulfate on nattokinase activity
由图5可知,当硫酸铵的饱和度为20%时,沉淀出的蛋白质中基本没有纤溶酶活性,大多数为杂蛋白质;而加入60%饱和度的硫酸铵后,纳豆激酶的总酶活力达到最大;饱和度超过60%时,总酶活开始下降,蛋白质含量一直处于增多的趋势。因此,本实验后续选取使用20%饱和度的硫酸铵沉淀杂蛋白,再向上清液中继续加入硫酸铵,使其最终饱和度达到60%沉淀纳豆激酶,以此来实现初步分离纳豆激酶的目的。
2.3.2 DEAE阴离子交换柱纯化纳豆激酶
将60%饱和硫酸铵沉淀的纳豆激酶经DEAE离子交换层析,结果见图6。
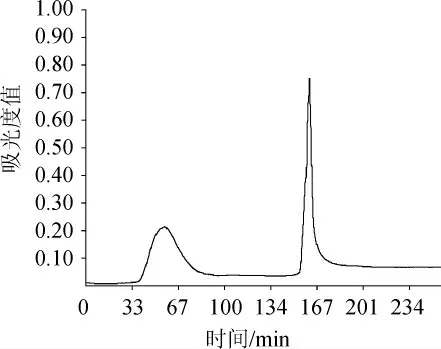
图6 DEAE离子交换层析纯化纳豆激酶Fig.6 DEAE ion exchange chromatogram of purified of nattokinase
由图6可知,样品溶液在经过DEAE离子交换柱层析时,会在280 nm波长下产生两个明显的吸收峰。对收集管中的纳豆激酶液进行活性检测,结果发现在第39~75 min之间出现的峰组分具有明显的纤溶活性,所以保留此段时间内的洗脱液,进行真空冷冻干燥,保存于-20 ℃备用。
2.3.3 SDS-PAGE电泳检测结果
纳豆激酶采用SDS-PAGE垂直板电泳法,比较各步分离纯化效果,并测定纳豆激酶的分子质量,结果见图7。

图7 纯化纳豆激酶SDS-PAGE电泳图Fig.7 Electrophoresis of SDS-PAGE of purified nattokinase
由图7可知,纳豆激酶经过硫酸铵分段盐析之后,在电泳的泳道中仍会存在较多的条带(泳道2),而在经过DEAE离子交换层析之后的样品泳道,杂蛋白条带减少,条带的位置处于25~35 kDa之间(泳道1),与相关文献[13,22]中报道的纳豆激酶的分子质量相近,目前仍然没有获得单一组分达到电泳纯,有待后续进一步的分离。
2.3.4 纳豆激酶分离纯化效果评价
在纯化纳豆激酶的整个过程中,需要对纯化过程中的每一步收集的样品酶液中纳豆激酶的活性进行测定,计算出各步的酶比活力、总酶活力、纯化倍数和回收率,结果见表3。

表3 纳豆激酶的分离纯化结果Table 3 Results of nattokinase isolation and purification
由表3可知,发酵液经离心除菌、硫酸铵分段盐析、离子交换层析等纯化步骤后,由于大部分杂蛋白被除去,所以会出现总蛋白呈逐渐降低、而比活力和纯化倍数逐渐增高的趋势;在纯化的过程中,酶活力会有一定程度上的损失,这会导致总酶活力的下降。最终经DEAE离子交换层析之后的纯化结果为:纯化倍数16.3倍,回收率22.5%,比活力达到3 578.3 IU/mg。JU S等[2]研究表明,枯草芽孢杆菌亚种纳豆(Bacillus subtilissubsp.natto)WTC016发酵产纳豆激酶最佳时间为26 h,酶活力为(3 284±58)IU/mL。这些差异性可能与纳豆芽孢杆菌的种类、发酵温度等因素有关。
2.4 纳豆激酶的酶学性质研究
2.4.1 纳豆激酶的最适温度及热稳定性
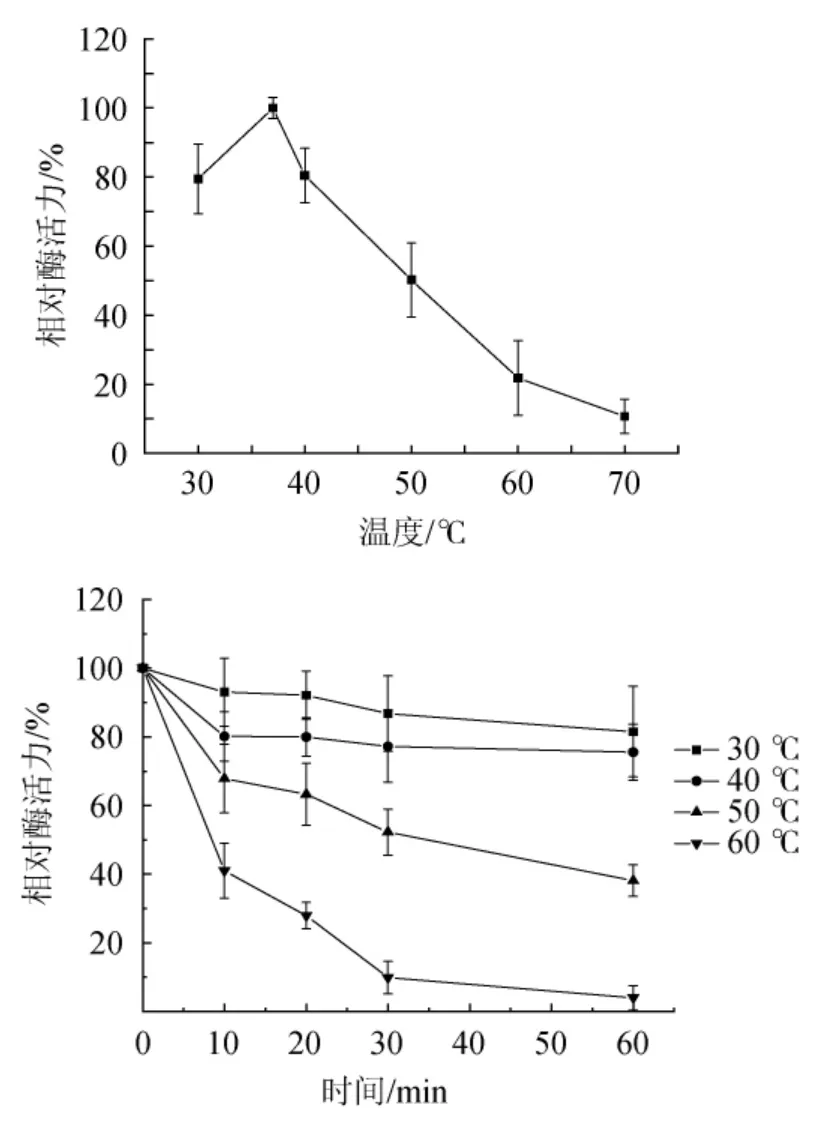
图8 纳豆激酶的最适反应温度(A)及热稳定性(B)Fig.8 Optimum reaction temperature (A) and thermal stability (B) of nattokinase
由图8A可知,纳豆激酶的最适反应温度为37 ℃,在该温度条件下酶活力达到最大。由图8B可知,温度在30~40 ℃范围内,其相对酶活都保持在80%左右,为其最适作用温度范围。超过最适温度之后,温度继续升高,酶活性则开始迅速下降。随着温度的升高,纳豆激酶的稳定性下降。在30 ℃、40 ℃条件下热处理60 min后,其酶活性依然达到原酶活性70%以上;而在50 ℃条件下热处理60 min后,其酶活性仅达到原酶活性的38%左右;在60 ℃条件下热处理20 min后其酶活性仅达到原酶活性的27%,热处理60 min后,酶活性几乎完全丧失。因此,纳豆激酶在低于40 ℃时较稳定。
2.4.2 纳豆激酶的最适pH值及pH值稳定性结果
由图9A可知,纳豆激酶的最适pH值为8.0,pH值偏高或是偏低,会对纳豆激酶的活性产生一定的影响。由图9B可知,纳豆激酶在不同pH值条件下反应1 h后,当pH值在6.0~8.0 范围比较稳定,其酶活力可达原酶活力的60%以上。在pH值>8及pH值<6时,纳豆激酶稳定性较差,纳豆激酶的活力迅速下降。

图9 纳豆激酶的最适反应pH值(A)及pH值稳定性(B)Fig.9 Optimum reaction pH (A) and pH stability (B) of nattokinase
2.4.3 纳豆激酶体外溶栓效果
纳豆激酶体外血凝块的溶解作用见表8。由表8可知,随着反应时间的延长,纳豆激酶对血块的溶解率呈不断上升的趋势;在相同时间内,纳豆激酶的溶栓效果随浓度的增加而增高,且与对照组相比均有显著差异(P<0.05)。在反应时间为5 h、纳豆激酶质量浓度为10 mg/mL时,该酶对血凝块的溶解率比对照组高38.40%;在纳豆激酶质量体浓度为20 mg/mL时,该酶对血凝块的溶解率比对照组高49.03%;随着反应时间的延长或者酶浓度的提高,该酶体外血凝块的溶解率都明显上升,结果表明纳豆菌发酵菜用大豆等外品产生的纳豆激酶具有明显的体外溶栓作用。

表4 纳豆激酶的体外溶栓作用Table 4 Thromobolytic effects of nattokinase in vitro
3 结论
本实验利用纳豆菌发酵菜用大豆等外品生产纳豆,以纳豆激酶活性作为标准,确定了纳豆的最佳发酵条件,并对纳豆激酶进行了初步分离纯化和部分性质的研究。在此条件下,发酵纳豆中的纳豆激酶活力可达2 326.60 IU/g。分别采用20%饱和度和60%的饱和度硫酸铵沉淀杂蛋白质和纳豆激酶,再经过DEAE阴离子交换层析对其进一步的分离纯化,最终得到酶的分子质量介于25~35 kDa之间,酶纯化倍数为16.3倍,回收率为22.5%,比活力为3 578.3 IU/mg。纳豆激酶的最适作用pH值及温度分别为37 ℃、8.0,当温度低于40 ℃及pH值在6.0~8.0的范围内较稳定;在体外的溶栓作用结果表明:加入酶液组的溶解率与对照组相比均有显著差异(P<0.05),说明纳豆菌发酵菜用大豆等外品产生的纳豆激酶具有良好的体外溶栓作用。
