应用血管活性药物评分评估完全性肺静脉异位引流患儿术后早期死亡风险
2021-01-10
完全性肺静脉异位引流(TAPVC)是一类由于胚胎发育异常导致的所有肺静脉直接或间接通过静脉支流异常引流至右心房的紫绀型先天性心脏病,其发病率较低,约占先天性心脏病的1.5%~3.0%[1]。TAPVC 患儿在出生后早期便会出现不同程度的紫绀、肺动脉高压以及心力衰竭等表现,需及时手术治疗,但由于该类型心脏病解剖畸形复杂,患儿年龄幼小,因此矫治手术风险较高,术后并发症较多,术后病死率也较高。血管活性药物具有强心、升高血压的作用,在临床上被广泛应用于先天性心脏病术后[2]。由于血管活性药物种类较多,因此临床上使用血管活性药评分(VIS)将血管活性药物进行整合,通过评分数值来反映患儿对于血管活性药物的依赖情况,从而评估患儿术后的心血管系统功能[3]。本文通过回顾性研究TAPVC 术后患儿的VIS 与患儿术后早期死亡的关系,希望能够对临床工作起到指导作用。
1 资料与方法
1.1 研究对象
回顾性选取2015 年1 月1 日至2019 年8 月31 日在重庆医科大学附属儿童医院住院诊断为TAPVC 并行一期根治术的≤1 岁患儿99 例,其中<1 个月患儿28 例,1 个月~1 岁患儿71 例,男性73 例,女性26 例。TAPVC 的诊断依据主要参考患儿的超声心动图及CT 血管成像报告。排除标准:(1)合并大动脉转位、单心室、右心室双出口等复杂畸形的患儿;(2)术后入住重症监护室时间小于1 d;(3)存在资料缺失、家属治疗中途放弃无法评估治疗结局的患儿。
1.2 资料收集
收集患儿的基本信息:包括性别、年龄、体重、婴儿心力衰竭分级评分(ROSS 评分)、超声心动图指标(左心室射血分数、肺静脉梗阻情况等)、是否急诊手术、术前有创呼吸机使用情况、术中情况(体外循环时间、主动脉阻断时间、是否心肺复苏等)、术后第三代小儿死亡风险评分(PRISM Ⅲ评分)、术后24 h 时血乳酸值和酸碱度(pH)值、VIS(包括术后24 h 内最大VIS 及平均VIS)、治疗结局(术后30 d 内是否死亡)、术后并发症发生情况、以及血液净化和腹膜透析使用情况等。根据术后早期(术后30 d 内)死亡情况,将患儿分为死亡组和存活组。
VIS=多巴胺[μg/(kg·min)]+多巴酚丁胺[μg/(kg·min)]+10× 米力农[μg/(kg·min)]+100× 肾上腺素[μg/(kg·min)]+100×去甲肾上腺素[μg/(kg·min)]+10 000×垂体后叶素[U/(kg·min)][3]。评分每小时1 次,计算第1 个24 h 内的最大VIS 及平均VIS。根据影响TAPVC 术后早期死亡的VIS 临界点,分为高VIS 组和低VIS 组。
1.3 统计学方法
使用SPSS 22.0 软件对数据进行统计学处理。正态分布的计量资料以表示,非正态分布的计量资料用中位数(四分位数)表示,使用t检验或秩和检验进行组间比较;计数资料以例或百分比表示,使用卡方检验进行组间比较。并使用ROC 曲线以及多因素Logistic 回归分析进行分析评价。当P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿的一般资料资料(表1)
99 例患儿中,术后早期死亡13 例(13.1%),存活86 例(86.9%)。死亡组患儿术前的ROSS 评分、有创呼吸机使用率、术中体外循环时间、术中和术后心肺复苏发生率、缺血缺氧性脑损伤和低心排综合征并发症发生率、以及血液净化和腹膜透析使用率等均明显高于存活组(P均<0.05),但死亡组的总住院时间、术后入住重症监护室时间、机械通气时间及血管活性药物使用时间明显低于存活组患儿(P均<0.05)。死亡组术前肺静脉梗阻率较存活组稍高,但差异无统计学意义(P>0.05)。两组患儿术前左心室射血分数差异无统计学意义(P>0.05),但死亡组患儿术后左心室射血分数明显低于存活组(P<0.05)。

表1 两组患儿一般资料比较[例(%)]
2.2 死亡组与存活组术后血乳酸、PRISM Ⅲ评分、VIS、pH 值比较(表2)
死亡组的术后血乳酸值、PRISM Ⅲ评分、最大VIS 及平均VIS 均较存活组高,差异均有统计学意义(P均<0.05)。死亡组术后pH 值明显低于存活组(P<0.05)。

表2 死亡组和存活组关于术后乳酸、PRISM Ⅲ评分、VIS、pH 值的比较
2.3 关于术后早期死亡的多因素Logistic 回归分析(表3)
通过逐步回归筛选,最终将术后血乳酸值、最大VIS、平均VIS、术后pH 值<7.35、体外循环时间、主动脉阻断时间纳入多因素Logistic 回归分析中。结果发现,最大VIS 为影响术后早期死亡的独立危险因素(OR=0.74,95%CI:0.54~1.00,P<0.05)。
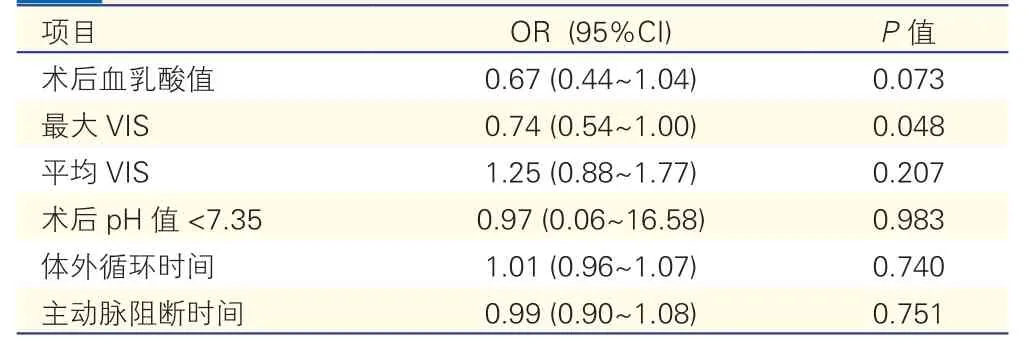
表3 关于术后早期死亡的多因素Logistic 回归分析
2.4 关于术后早期死亡的ROC 曲线分析(表4、图1)
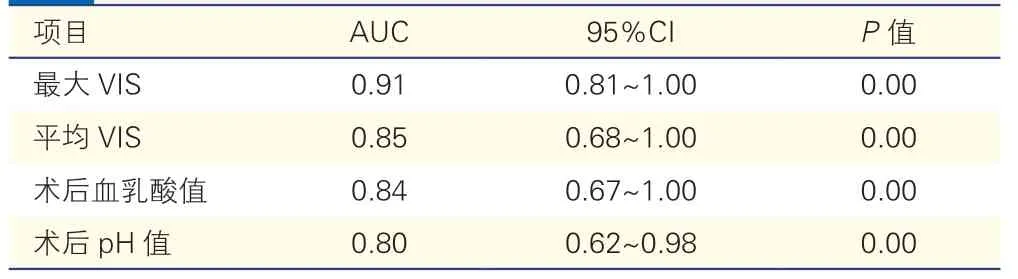
表4 影响TAPVC 患儿术后早期死亡的ROC 曲线分析比较
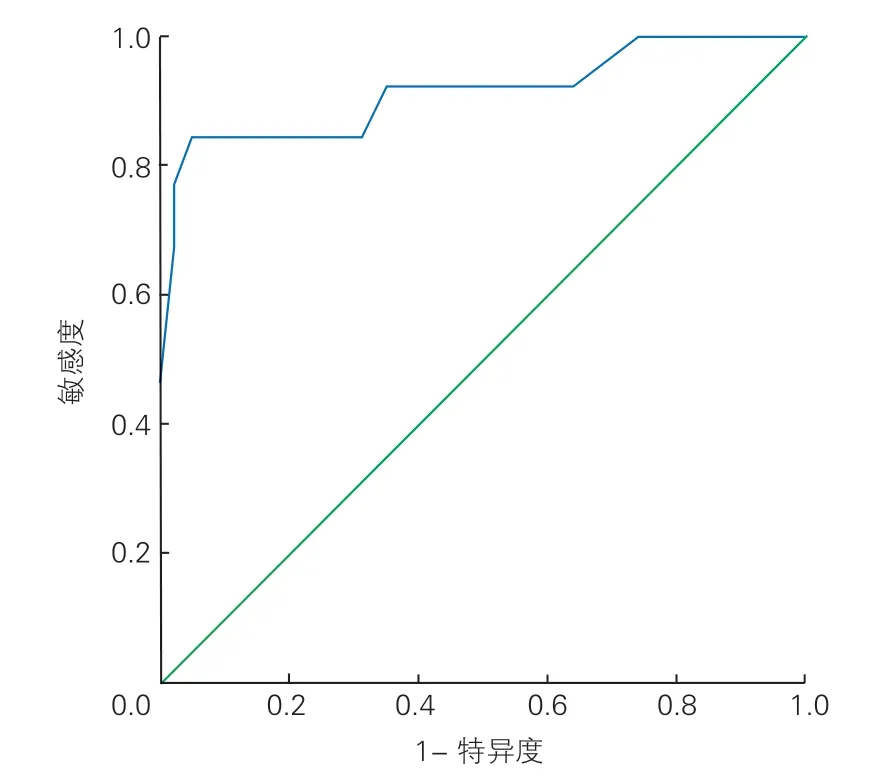
图1 最大VIS 预测患儿术后早期死亡的ROC 曲线
99 例TAPVC 术后患儿的最大VIS、平均VIS、血乳酸及pH 值预测术后早期死亡的AUC 均>0.5,且P<0.05。其中最大VIS 评分的AUC 最大(AUC=0.91,95%CL:0.81~1.00,P<0.01),根据最大约登指数(约登指数=0.799,敏感度=0.846,特异度=0.953),选择最大VIS=29 分作为影响TAPVC术后早期死亡的VIS 临界值。
2.5 高VIS 组与低VIS 组的比较(表5、6)
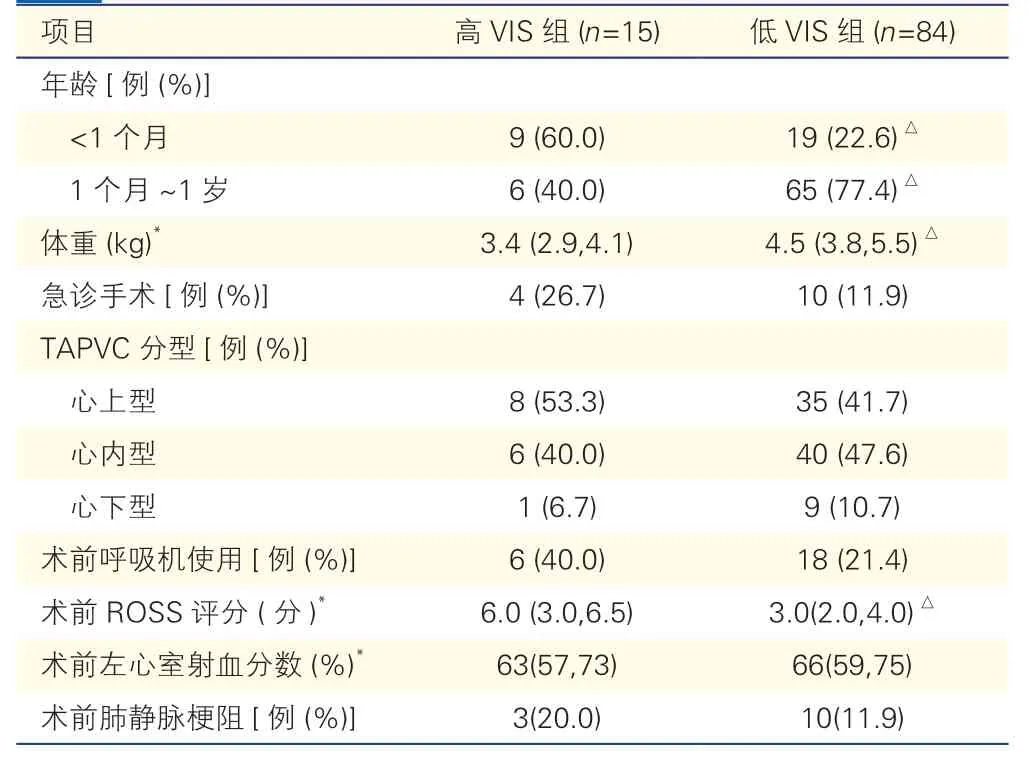
表5 高VIS 组与低VIS 组术前各项指标的比较
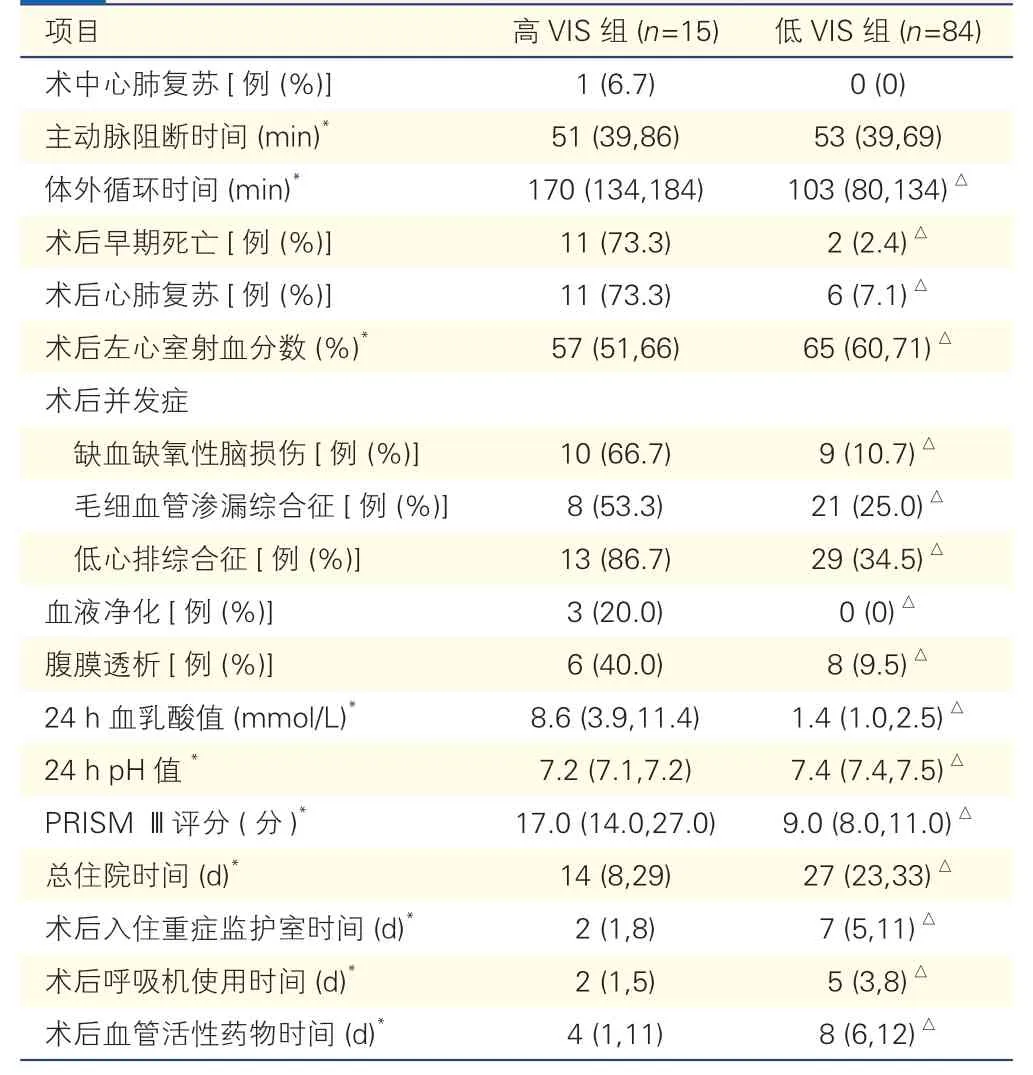
表6 高VIS 组与低VIS 组术中及术后情况的比较
根据最大VIS 是否大于29 分,将99 例患儿分为高VIS 组(n=15)和低VIS 组(n=84)。高VIS 组主要以<1 个月的患儿为主,且患儿的体重明显小于低VIS 组,术前ROSS 评分高于低VIS 组,差异均有统计学意义(P均<0.05)。高VIS 组术中体外循环时间,术后早期死亡、心肺复苏和并发症的发生率、术后腹膜透析和血液净化的使用率、术后PRISM Ⅲ评分、24 h 血乳酸值均明显高于低VIS 组,而术后左心室射血分数、24 h pH 值、总住院时间、术后入住重症监护室时间、术后呼吸机使用时间、术后血管活性药物使用时间则均明显少于低VIS 组,差异均有统计学意义(P均<0.05)。
3 讨论
TAPVC 是一类死亡率较高的复杂型先天性心脏病[4]。由于左右肺静脉血均引流至右心房,导致右心系统过度充盈,进而引起肺动脉高压及心力衰竭,而同时,由于通过房间隔缺损进入左心房的血液为动静脉混合血,患儿早期便会出现发绀、缺氧等表现,并且右向左分流的血流量越少,患儿心力衰竭、肺动脉高压等表现就越重,甚至会直接死亡[5]。因此,早期确诊,尽快行手术矫治是治疗该疾病最有效的方法。由于术前左心系统发育不良,术后当大量的肺静脉血重新进入左心房时会造成左心系统的过度充盈,甚至左心衰竭,因此术后常规会使用血管活性药物改善心血管系统功能[6],对于严重心力衰竭,尤其术中无法脱离体外循环的患儿,术后甚至需要使用体外膜肺氧合来支持心脏循环功能[7]。
目前临床上使用的血管活性药物种类较多,作用机制也各有不同,VIS 将患儿使用的所有血管活性药物进行整合,能够直观的反映出患儿对于血管活性药物的依赖程度,进而评估患儿的心功能情况。国内外有少量文献对于先天性心脏病术后预后情况与VIS 的关系进行了研究[8-9],研究发现VIS 越高,患儿的病死率越高,并且VIS ≥20 分可以作为评估不良预后的临界值。但以上文献均未对先天性心脏病进行分类,且研究病例均以非复杂型先天性心脏病为主,因此更无法得知某一类型复杂先天性心脏病与VIS 的关系,不利于临床上制定个体化治疗方案。本研究中发现死亡组患儿的最大及平均VIS 均明显高于存活组,并且在多因素Logistic 回归分析中发现,最大VIS 是影响患儿术后早期死亡的独立危险因素,而关于患儿术后早期死亡的ROC 曲线中,最大VIS 和平均VIS 的AUC 均大于0.5,再次证明VIS 与TAPVC 术后患儿早期死亡的相关性。但本研究中最大VIS 预测术后患儿早期死亡的ROC 曲线临界值为29 分,较目前国内外关于先天性心脏病预后研究中的临界值高,这可能是因为TAPVC 作为复杂型先天性心脏病,患儿术前及术后的心功能较非复杂型先天性心脏病更差,因此术后需要的血管活性药物剂量更大,VIS 也更高。血管活性药物虽然能够提高心血管功能,改善预后情况,但如果过量或者不合理的使用将会对患儿造成不可逆转的危害。因此临床上使用VIS 不仅有利于评估患儿病情,更有利于调整血管活性药物使用方案。
目前国内外研究发现患儿的术前年龄、体重、TAPVC 分型、术前肺静脉是否梗阻,术中主动脉阻断时间、体外循环时间均与患儿术后早期死亡有关[10-12]。而本研究发现,高VIS 组和低VIS 组患儿的TAPVC 分型、急诊手术比例、术前有创呼吸机使用比例等差异均无统计学意义,高VIS 组主要以<1 个月及低体重患儿为主,且术前ROSS 评分高于低VIS 组,表明低龄、低体重均是手术耐受力以及术后心功能低下的危险因素。两组患儿术前的超声心动图指标如肺静脉梗阻、左心室射血分数等虽差异无统计学意义,但高VIS 组患儿术后左心室射血分数明显低于低VIS 组,并且高VIS 组患儿术中体外循环时间,术后心肺复苏、早期死亡的比例以及RRISM Ⅲ评分均明显高于低VIS 组。这可能是由于体外循环过程中全身组织器官处于缺血缺氧状态,体外循环时间越长,大脑、心脏等重要脏器缺血时间就越长,损伤就越严重,而当体内循环重新建立时产生的缺血-再灌注损伤将进一步加重脏器损害,对于TAPVC 患儿,术前ROSS 评分越高,心力衰竭的程度越重,对手术的耐受力越差,在经过一系列手术打击之后,将导致心功能进一步明显下降,增加了术后早期死亡的风险,因此VIS 也就越高。
术后心功能降低是导致患儿术后早期死亡的主要原因,术后并发症如低心排综合征、脑缺血缺氧损伤都是可以反映心血管功能的指标[13-14]。组织器官由于缺血缺氧,将导致大量无氧酵解产生,因此术后乳酸升高也是反应心功能情况的一个重要指标。本研究发现高VIS 组患儿的术后24 h 血乳酸明显高于低VIS 组。而国外同样有研究发现先天性心脏病术后血乳酸大于4.5 mmol/L 与术后早期死亡相关[15]。而体外循环在引起机体缺血-再灌注损害的同时,还将刺激机体释放大量炎症因子,导致全身炎症反应发生,临床上最主要的表现就是毛细血管渗漏综合征。毛细血管内皮细胞在炎症因子作用下受到损伤,进而引起毛细血管通透性增加,大量血浆蛋白进入组织间隙[16]。毛细血管渗漏在心功能下降的基础上进一步导致有效循环血量减少,引起肾前性肾功能损害,导致少尿或者无尿,无法将机体内的代谢产物排出体外。腹膜透析和血液净化能够在一定程度上代替肾脏的清除功能,排出代谢产物、纠正水电解质紊乱,促进肾脏功能的恢复[17-18]。本研究中高VIS 组术后毛细血管渗漏综合征比例,以及使用血液净化和腹膜透析的比例更高。可能是由于高VIS 组体外循环时间更长,导致毛细血管渗漏综合征的发生率更高,术后肾脏功能更差。除此之外,高VIS 组术后24 h pH 值较VIS 组低,这可能与乳酸引起的代谢性酸中毒以及术后肺渗出增加导致肺部感染加重有关。
本研究中高VIS 组患儿的治疗时间,如总住院时间、重症监护时间、呼吸机使用时间以及血管活性药物使用时间等均明显低于低VIS 组患儿。这可能是由于高VIS 组患儿的心功能更差,病情更加危重,进而在短时间内因病情极速恶化而死亡导致治疗时间较短。
结论:VIS 与TAPVC 术后的早期死亡有关,术后24 h 内最大VIS ≥29 分的患儿病死率更高。进一步开展前瞻性、多中心、大样本的相关研究有助于对临床工作起到指导作用。
利益冲突:所有作者均声明不存在利益冲突
