中国多学科微血管疾病诊断与治疗专家共识
2021-01-10
近年来随着磁共振(magnetic resonance,MR)成像、正电子发射断层扫描(positron emission tomography,PET)等影像学技术的迅速发展,人们对于微血管疾病(microvascular disease,MVD)的认识不断深入。MVD 是一个全身性的病理生理过程,涉及心脏/脑血管、肾脏及外周等多器官多系统,但目前围绕MVD 的研究大都集中在不同的靶器官水平,尤其是冠状动脉方面。伴随着全身MVD 的防控形势日益严峻,国内外学者逐渐认识到逐个器官水平研究和治疗的局限性,开始着眼探究此类疾病系统性累及心、脑、肾等多个脏器的病理特征共性,以期探寻MVD 共同防控策略。为此,本共识集中了多学科专家,在广泛搜集国内外文献的基础上,经过分工撰写、集体讨论和反复修改,结合我国实际情况撰写了本专家共识。限于目前相关临床研究及治疗证据仍略显不足,因而本共识的内容仍然是初步的,许多方面仍有待于进一步完善;但专家组仍希望本共识和建议的制定与发布能够对未来该领域进一步临床研究工作的深化起到积极的推动作用。
1 微血管疾病的定义及流行病学
目前并没有公认的MVD 定义及分类,多指基于多种病因引起的,以直径<500 μm 的小动脉、微动脉、微静脉和毛细血管的损伤为共同病生理特征的系统性血管疾病综合征[1]。血管损伤最常见的机制包括:血管内皮功能障碍、炎症和氧化应激反应等,最终会导致慢性器官灌注不足。MVD 是心脏-脑血管、肾脏以及代谢相关疾病发生和发展的关键途径,并且与心血管疾病死亡率增加密切相关。广义的MVD 除了冠状动脉微血管功能障碍(coronary microvascular dysfunction,CMVD)和脑微血管疾病(cerebral small vessel disease,CSVD)以外,往往还包括:慢性肾脏病(chronic kidney disease,CKD)、胰岛素抵抗相关疾病和(或)病理性肥胖等,以女性多见。
目前尚无有关MVD 的大样本人群的流行病学资料。CMVD 是迄今研究最为深入的一种MVD,在美国至少有约300 万~400 万患者。在患有慢性心绞痛的患者中,有创冠状动脉造影显示10%至30%的患者没有明显的冠状动脉疾病(coronary artery disease,CAD),其中约有60%可能患有CMVD。2012 年欧洲一项包括11 223 例稳定性心绞痛患者的7.5 年随访研究显示,入院时近1/3 的男性和2/3 的女性患者冠状动脉造影未发现阻塞性CAD。但无论在男性或女性,冠状动脉造影显示正常和非阻塞性冠状动脉病变患者的主要心血管事件和全因死亡率仍显著高于对照人群,而CMVD 是导致这些患者不良预后的最重要原因[2]。CSVD 则是患者腔隙性脑梗死的主要原因,约占所有脑卒中的25%[3];而CSVD也是血管性痴呆发生的重要危险因素,在各类痴呆中的比例约为20%[4]。另有横断面研究证实在老年(65~90 岁)患者中肾小球滤过率(glomerular filtration rate,GFR)降低与其存在的经MR 扫描证实的CSVD改变密切相关。此外在我国成人2 型糖尿病患者中糖尿病肾脏疾病(diabetic kidney disease,DKD)患病率约为10%~40%[5];糖尿病视网膜病变(diabetic retinopathy,DR) 的患病率为 24.7%~37.5%[6];10%~15%新确诊的2 型糖尿病患者合并有远端对称性多发性神经病(distal symmetric polyneuropathy,DSPN),10 年以上病程者则可高达50%[7]。
2 微血管疾病的危险因素和病理机制
目前较为明确的与MVD 发生密切相关的危险因素包括:遗传因素、出生低体重、肥胖、缺乏体力活动及高龄等[8]。罹患高血压父母的正常血压子女会出现微血管结构和(或)功能性变化[9];此外其子女的肾小球滤过储备降低,其与一氧化氮(nitric oxide,NO)合成减少相关[10],提示存在肾小球高过滤状态的肾脏MVD,后者则可能导致肾小球毛细血管稀疏,并最终导致蛋白尿及肾功能下降。出生体重过轻与成年后的心脏代谢疾病相关[11],内皮功能障碍尤其是NO 合成减少和活性氧对NO 清除增加可能是解释以上关联的机制。与健康对照者相比,运动员和训练有素的成年人的内皮细胞依赖性/非依赖性微血管功能均得到增强[12-13]。与此相反,健康志愿者卧床休息、运动不足可以诱发急性MVD[14-15]。尽管相关机制仍尚待阐明,已有研究提出运动可以增加剪应力/压力和降低氧化应激水平,从而有助于增加NO 生物利用度并降低血管收缩通路活性[16-17]。在肥胖患者中发现了皮肤的毛细血管修复能力和皮肤、肌肉中的内皮依赖性微血管扩张受损,可能的机制包括游离脂肪酸水平升高直接导致了皮肤的MVD以及脂肪组织扩张/功能失调[18]。肥胖相关MVD 的相关临床结局往往是胰岛素抵抗和血压升高[19],而慢性高血糖又会进一步加剧微血管内皮功能的恶化[20],血压升高也会进一步引发内皮功能障碍、小动脉壁重构以及毛细血管/小动脉稀疏[9]。衰老的标志包括微血管系统在内的所有器官和组织功能储备逐渐丧失[21],研究发现年龄与皮肤微血管流动性相关[22],内皮中的氧化应激和炎症过程被认为是衰老导致MVD 的主要原因[23]。
MVD 患者的血管内可发生一系列生化和/或生理功能和组织结构改变,但导致MVD 患者发生相关临床病理改变的顺序仍不清楚,在全身不同器官发生MVD 的诱因、病理生理学过程也不尽相同。在多重危险因素的作用下,患者血管内皮功能障碍的持续存在,导致内皮细胞NO、前列环素、血栓素A1 和内皮素-1(endothelin-1,ET-1)等内皮相关分子表达异常[24-26];此外在氧化应激、线粒体功能障碍、慢性低度炎症反应、对分子应激因子抵抗力减弱以及蛋白质稳态失调等过程(涉及多种炎症因子、细胞因子、胰岛素和脂肪因子通路)的参与下,MVD 患者的小动脉和前小动脉血管平滑肌细胞出现僵硬与增殖,继发小动脉和前小动脉血管壁胶原沉积增加,出现血管舒张活性减低,并最终导致毛细血管密度及直径的改变,甚至阻塞继而影响组织灌注,并最终导致组织损伤[27-31]。此外近年来研究还揭示了能量代谢紊乱在全身MVD 发生过程中也起着重要作用[32-33]。
3 微血管疾病的分类和临床特征
MVD 主要分为CMVD 和其他微血管病,包括:CSVD、慢性肾脏疾病、胰岛素抵抗以及病理性肥胖等。
3.1 冠状动脉微血管功能障碍
CMVD 是研究最为深入的一类MVD,其在合并心血管疾病危险因素患者中普遍存在,并且与这些患者长期的心血管不良事件风险密切相关。从病理生理学角度,CMVD 患者的冠状动脉通常会出现一系列微血管结构改变,包括:微血管阻塞,壁内小动脉和毛细血管腔狭窄,和毛细血管稀疏等。其次CMVD 患者的冠状动脉还往往存在多种功能异常,包括:(1)内皮细胞依赖性血管舒张异常,即NO 的产生和释放异常;(2)非内皮细胞依赖性血管舒张异常,即血管活性物质通过刺激血管平滑肌细胞膜受体和细胞内信号通路而引发血管舒张异常;(3)微血管缩窄;(4)微血管栓塞;(5)血管外机制:由左心室舒张压明显升高的疾病(如:左心室肥厚/纤维化等)或可直接降低冠状动脉舒张压的疾病(如:主动脉瓣狭窄、冠状动脉重度狭窄和前小动脉缩窄等)所致。
在同一CMVD 患者中可能同时合并有上述多种病理生理过程;且无论是哪一种致病机制,CMVD 最终将导致正常的冠状动脉生理功能发生损坏,影响心肌血流(myocardial blood flow,MBF)在心肌氧耗发生改变时的适应力。
3.1.1 冠状动脉微血管功能障碍的临床特征及分型
3.1.1.1 临床特征
CMVD 患者的主要临床表现包括心绞痛,劳力性呼吸困难以及潜在的心力衰竭等。CMVD 的自然病程往往具有相对较长的无症状期,因此早期诊断比较困难,在此期间很多患者的CMVD 往往都是经由一些偶然的心脏检查发现并最终确诊。约30%至60%的CMVD 患者合并心绞痛症状,其与经典CAD所致的心绞痛没有区别,通常由劳力性活动诱发而通过休息缓解[34]。非典型心绞痛,包括静息性胸痛发作也很常见。患者也可能表现为运动耐力的逐渐降低或劳力性呼吸困难。运动耐力降低多由运动负荷增加时心输出量增加不良所致;而劳力性呼吸困难往往提示由左心室舒张功能不全引发的舒张末期压力过度升高致肺淤血[35]。
3.1.1.2 临床分型
通常将CMVD 分为5 种不同的临床类型[36](表1)。第1 型:无心肌病或阻塞性心外膜冠状动脉疾病的原发性CMVD,该类别CMVD 是在经典心血管危险因素作用下引起的早期CAD 或冠状动脉微血管舒缩功能异常;女性多见,约占CMVD 患者的56%~79%,多数发生在绝经期后。第2 型:合并有心肌病(如:肥厚型心肌病、心肌淀粉样变等)的CMVD,该型通常伴有心肌肥大、间质和血管周围纤维化、冠状微动脉壁内不良重构以及在各型心肌病患者中发生毛细血管密度的降低、动脉高血压、糖尿病和(或)肥胖症;第3 型:合并阻塞性心外膜冠状动脉疾病的CMVD,该类患者临床可以表现为稳定性心绞痛或急性冠状动脉综合征;第4 型:医源性CMVD,此类CMVD 发生在冠状动脉血运重建术后,通常与操作相关的微循环水平血管收缩反应和(或)血管远端栓塞密切相关;第5 型:移植后的CMVD,是致长期原位心脏移植幸存者死亡的主要原因。
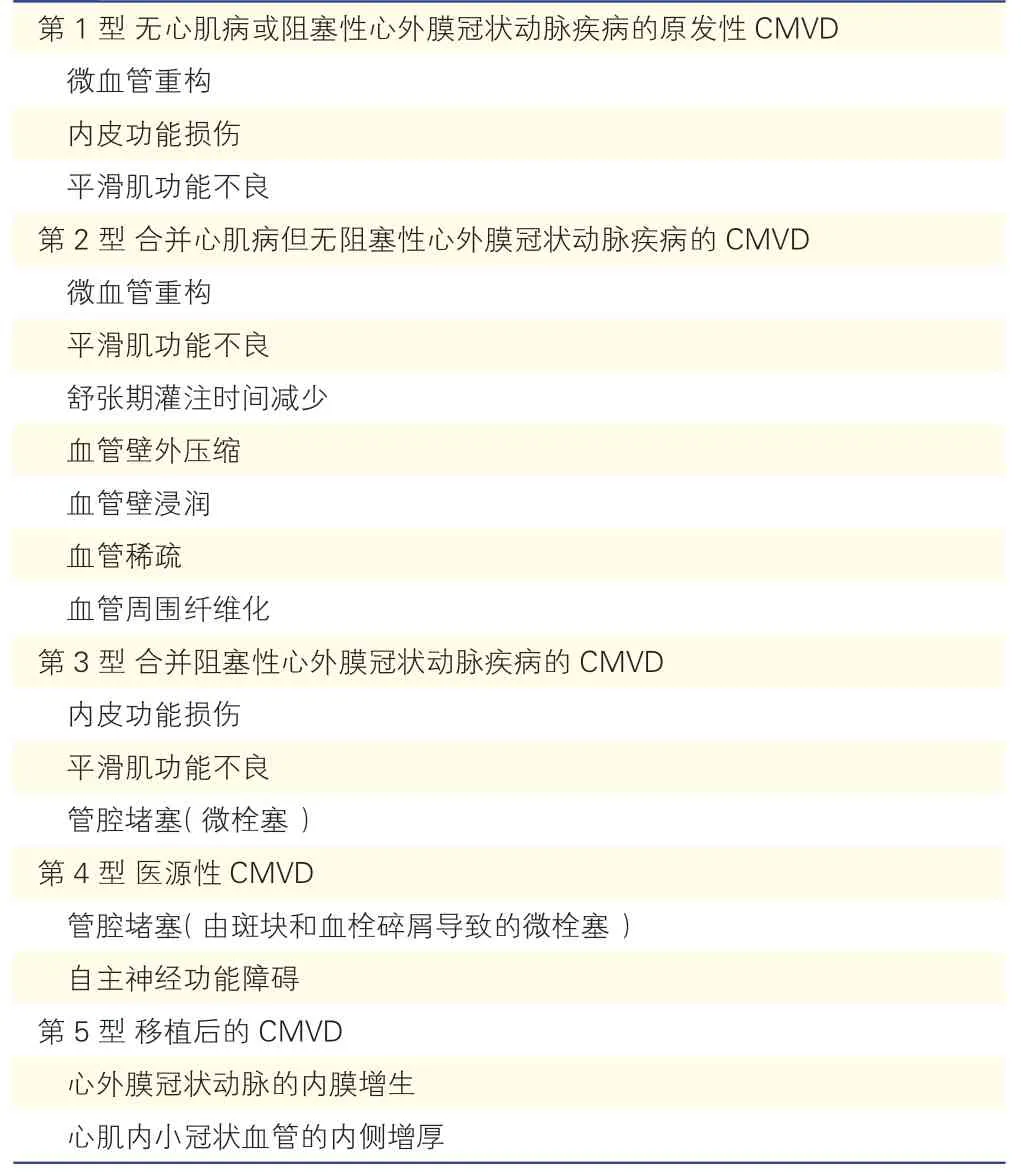
表1 冠状动脉微血管功能障碍的临床分型及致病机理
CMVD 是一类复杂的累及冠状动脉微血管结构与功能异常的临床综合征群,在强调微血管病变的同时,须关注“微血管病”与冠状动脉“大血管病”之间的紧密联系。CMVD 的危险分层应纳入到患者冠心病整体风险评估之中,依据患者有无合并动脉粥样硬化(非阻塞性CAD 或阻塞性CAD)、CMVD 的严重程度以及是否合并已知的心血管危险因素等要素进行风险评估(图1),从而更全面系统地预测患者临床预后,并指导CMVD 患者治疗策略的选择。
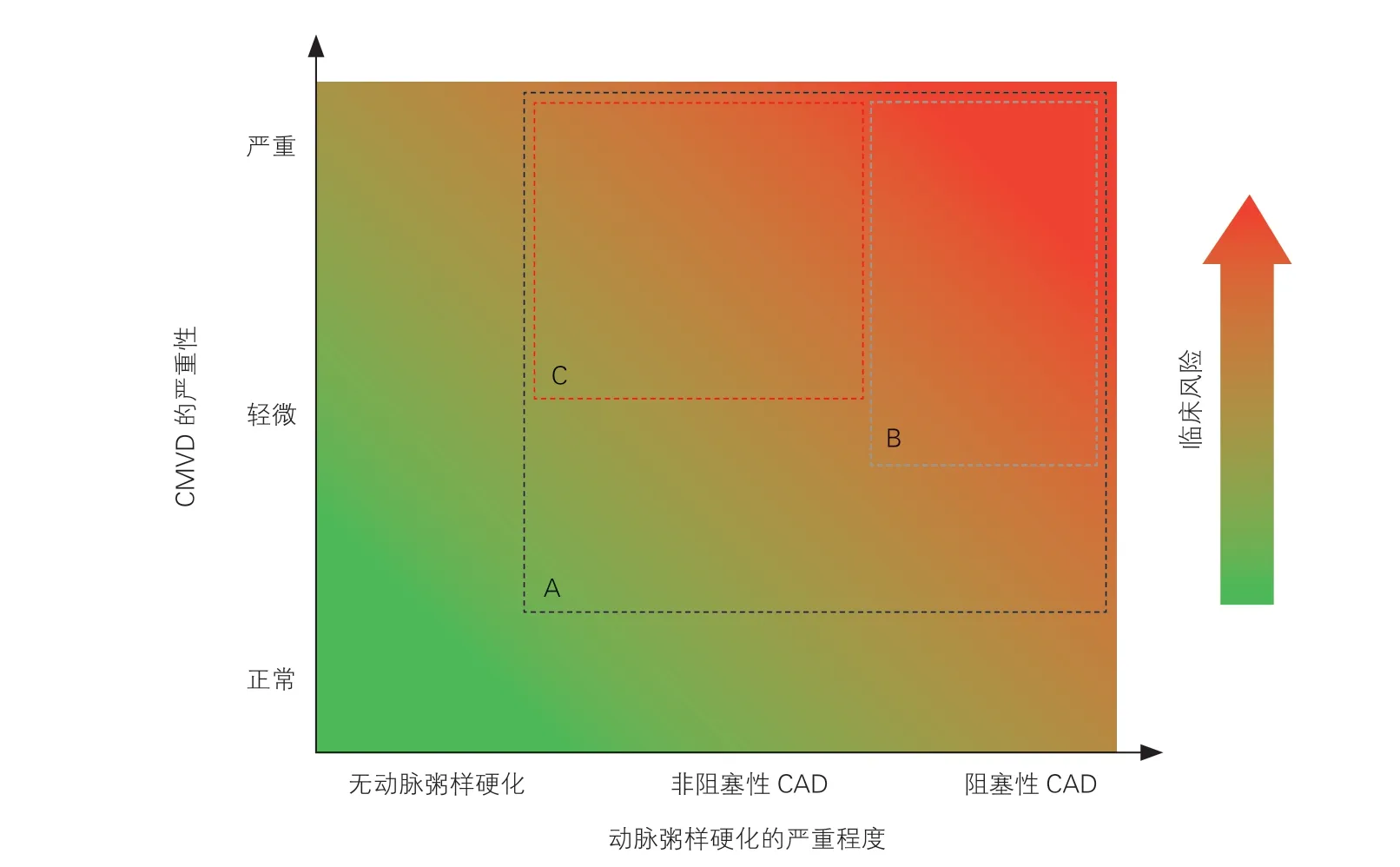
图1 纳入了动脉粥样硬化严重程度以及患者临床风险的冠状动脉微血管功能障碍危险分层
3.2 其他微血管疾病
3.2.1 脑微血管疾病
CSVD 是指脑内小动脉、微动脉、毛细血管、微静脉和小静脉病变导致的一系列临床、影像、病理综合征[37-38]。按病因可将其分为6 类:(1)小动脉硬化,也称为年龄和血管危险因素相关性小血管病;(2)散发性或遗传性脑淀粉样血管病(cerebral amyloid angiopathy,CAA);(3)其他遗传性小血管病;(4)炎性或免疫介导性小血管病;(5)静脉胶原化疾病;(6)其他脑小血管病[39]。临床上以第一、二类最常见。
在过去的20 年中CSVD 的发病率不断升高,CSVD 临床表现复杂多样,缺乏特异性。通常隐匿起病、缓慢发展,也可以急性发病,疾病早期可以没有症状。CSVD 常见的临床表现有急性脑卒中综合征[包括脑出血(intracerebral hemorrhage,ICH)和腔隙性脑梗死]、轻度认知障碍、痴呆、情绪或行为障碍、步态障碍、运动障碍和总体功能下降[40]。CSVD 引起的认知障碍以执行和注意功能下降为主要特征,记忆功能相对保留。反复发作的脑叶出血、短暂性局灶性神经系统症状发作(transient focal neurological episode,TFNE),即:“淀粉样发作”,是CAA 的临床特征[41]。
尽管临床上缺血性脑卒中的发生率是出血性脑卒中的3 至4 倍,但出血性脑卒中的病死率和幸存者发生严重残疾的风险却高3 至4 倍。因此特别要指出CSVD 与出血性脑卒中的密切相关性,55 岁以上成年人ICH 发生的最常见病因是CSVD 合并CAA,即淀粉样-β 肽在软脑膜和皮质血管壁中积聚或高血压-动脉硬化[42-43]。
此外长期抗凝治疗已成为诸如心房颤动患者等心血管病高危人群预防缺血性卒中发生的标准治疗,ICH 是抗凝治疗的一种致命性并发症。在使用华法林或非维生素K拮抗剂口服抗凝药(non-vitamin K antagonist oral anticoagulants,NOAC)的情况下,其近期死亡率可达50%。而合并CSVD(例如有腔隙性脑梗死史)患者在抗凝治疗中发生这种潜在的致命性并发症的风险显著升高[44-45]。
3.2.2 微循环障碍与慢性肾脏病
在肾脏,微血管网络受到精密的调控,而肾小球和肾小管毛细血管承受着巨大的工作负荷,包括肾小球滤过、肾小管重吸收以及一些关键性的体液、营养素、激素和其他物质的全身再循环等。内皮功能障碍、血管重构和肾微血管丢失在与主要心血管危险因素(例如高血压、血脂异常、2 型糖尿病和动脉粥样硬化)相关的肾脏损伤的发生过程中起到了关键性的作用。
广义的MVD 相关肾脏疾病包括:原发性肾小球肾炎和继发性肾小球肾炎,其中后者包括抗中性粒细胞胞质抗体(antineutrophilcytoplasmic antibody,ANCA)相关性小血管炎(ANCA associated vasculitis,AAV)肾损害、以血栓性微血管病(thrombotic microangiopathy,TMA)为主要表现的继发肾小球病(包括恶性高血压、硬皮病肾危象、妊娠相关肾脏损害和抗磷脂综合征等)以及狼疮性肾炎(lupus nephritis,LN)、DKD 等。MVD 相关肾脏病多与免疫介导、补体活化异常、内皮细胞损伤等多种因素相关,部分机制尚不完全清楚。当肾损害病程超过3 个月,即称为CKD。未得到有效控制的CKD 最终可进展为终末期肾脏病(end stage renal disease,ESRD)。
3.2.3 病理性肥胖与MVD
肥胖症是以脂肪细胞的数量增多、体脂分布失调以及局部脂肪沉积为特征的慢性代谢性疾病。肥胖是全身微血管功能障碍的公认的危险因素之一。脂肪组织由脂肪细胞、前脂肪细胞、免疫细胞和广泛的内皮细胞网组成,同时还拥有密集的毛细血管网,担负组织供氧和营养运送功能,还可以分泌多种脂肪细胞因子,包括瘦素、脂联素、炎症趋化因子(如肿瘤坏死因子-α、白细胞介素)、血管内皮生长因子、血管紧张素Ⅱ等[46]。肥胖发生时,白色脂肪组织扩张,造成脂肪组织相对缺氧,同时还常常伴有循环中游离脂肪酸的升高,从而导致脂肪组织(尤其是内脏和血管周围脂肪组织)释放脂肪因子和炎性细胞因子[47-48],这些因素进一步导致肝脏、骨骼肌、脑、心脏、肺脏、肾脏等脏器的微血管内皮细胞功能障碍和胰岛素抵抗,不仅通过损害组织灌注影响不同器官的功能,而且还通过改变内皮细胞的旁分泌来影响不同器官的功能。临床上则表现为肥胖症患者出现脂肪肝、运动耐力下降、微血管性痴呆、心肌缺血、高血压、蛋白尿和糖耐量受损等风险显著增加[49]。
3.2.4 胰岛素抵抗、高血糖与微血管疾病
糖尿病患者常伴有全身代谢异常,如高血糖、高血压、血脂紊乱等都对微血管有着不同程度的影响,其中高血糖是最主要的致病因素,微血管的细胞成分比大血管更易受到持续高血糖的损害。但单纯的高血糖并不足以完全解释微血管病变,其他未明确的遗传因素和内在的保护机制可能也发挥重要作用。糖尿病微血管损伤的主要细胞学机制包括高糖状态下糖基化终末产物(advanced glycation end products,AGE)的形成和多元醇代谢通路的激活,活性氧簇(reactive oxygen species,ROS)的产生和作用、内质网应激、蛋白激酶C(protein kinase C,PKC)通路和肾素-血管紧张素-醛固酮系统(renin aniotension aldosterone system,RAAS)激活等[50]。高血糖诱导细胞内外的变化可能改变信号转导通路,从而影响基因表达和蛋白质功能,导致不同靶组织的细胞功能障碍和损伤。
上述病理生理变化在糖尿病早期可导致肾小球肥大,肾小球和肾小管基底膜的增厚及系膜区细胞外基质(ECM)的进行性聚积;后期则可能发生肾小球、肾小管间质纤维化,最终导致蛋白尿和(或)GFR 下降甚至发生肾衰竭[5]。
高血糖还可导致视网膜周细胞丢失、内皮细胞异常、毛细血管基底膜增厚和视网膜色素上皮异常。早期可能先出现视网膜小静脉增宽、微血管瘤和出血点;之后出现非增殖性表现,如:硬性渗出、软性渗出、缺血、区域周边毛细血管扩张以及静脉串珠等,最终发展到增殖期,即视盘或视网膜小静脉旁出现新生血管和纤维组织,继而导致视网膜前和玻璃体出血,并因黄斑牵拉而导致视力丧失[6]。
此外,糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)也是一种微血管病变,尽管其病理改变是受损神经纤维的渐进性轴突变性和脱髓鞘病变。在糖尿病早期外周神经内的微血管结构已经发生改变,其血管壁由于基底膜改变而增厚,伴有周细胞变性和内皮细胞增生,进而导致神经内血流量减少、血氧不足。临床上则表现为手足远端对称性麻木、疼痛和感觉异常等[7]。
CMVD 与非冠状动脉微血管病(包括:CSVD、CKD、胰岛素抵抗和病理性肥胖等)通常在危险因素、发病机制和病理生理学改变方面存在紧密的联系,临床上MVD 患者可能同时在多个不同靶器官水平存在微血管病变,其临床精确评估往往需要多学科协作。
4 微血管疾病的诊断
4.1 CMVD 的诊断
CMVD 的诊断须结合四方面的证据,包括:(1)临床心肌缺血的症状,如:劳力性/静息型心绞痛,或心绞痛等危症等。(2)经冠状动脉CT血管造影(CTA)或有创性的冠状动脉造影检查除外阻塞性CAD 存在,即:心外膜冠状动脉直径狭窄<50%或冠状动脉血流储备分数(fractional flow reserve,FFR)≥0.80。(3)客观的心肌缺血证据,如:胸痛发作时出现特征性的缺血性的心电图改变;运动负荷试验诱发胸痛和(或)缺血性的心电图改变时伴随有一过性或可逆性的心肌灌注异常和(或)室壁运动异常等。(4)明确的冠状动脉微循环功能受损证据,包括:冠状动脉血流储备受损——冠状动脉血流储备(coronary flow reserve,CFR)<2.5 或<2.0;除外冠状动脉微血管痉挛,即:反复的心绞痛发作以及心电图改变的同时乙酰胆碱激发试验证实心外膜冠状动脉无痉挛发生;冠状动脉微血管阻力指数(index of microcirculatory resistance,IMR)异常,通常>25;以及存在冠状动脉慢血流现象——TIMI 血流计帧法(TIMI frame count,TFC)> 25 等。
4.1.1 冠状动脉微血管功能的评估
临床评价冠状动脉微血管功能的检查主要包括:血管活性药物试验、无创伤性诊断技术和创伤性诊断技术等三类。
4.1.1.1 冠状动脉血流储备
在心外膜冠状动脉中测算两个参数:冠状动脉血流速度(coronary blood flow velocity,CBFV;单位:cm/s)和冠状动脉血流(coronary blood flow,CBF;单位:ml/ml 表示的体积流量),结合MBF[单位:ml/(min·g)]可用来反映在各种血管活性药物刺激下的CFR,即冠状动脉充血期与基线血流量之比。因此CFR 是对心外膜大血管和冠状动脉微循环流量的综合评估。通常认为在没有心外膜动脉阻塞性狭窄的情况下,CFR 降低是CMVD 的标志[51-52]。但是由于心外膜动脉阻塞性狭窄经常与CMVD 并存,因此临床上要截然区分这两种情况对心肌灌注产生的影响往往极具挑战性。临床上通常将CFR的阈值设为2.0,低于该临界值通常认为患者存在微血管功能异常。
4.1.1.2 评价冠状动脉微血管功能的血管活性药物试验
冠状动脉微血管功能常通过检测冠状动脉微血管对血流扩张剂的反应来评估,常用的测量指标是冠状动脉微血管呈最大限度扩张时的冠状动脉血流量与基础状态下冠状动脉血流量的比值。临床上常用的冠状动脉舒张剂有:腺苷和尼可地尔等。此外临床也可使用乙酰胆碱(注:国内目前无药)、麦角新碱和过度通气及冷加压超声心动图试验等激发试验(表2)。
4.1.1.3 评价冠状动脉微血管功能的无创伤性影像学技术
近年来,多种无创影像学技术,如:经胸超声冠状动脉血流显像(transthoracic Doppler echocardiography,TTDE)、心脏超声造影、PET 和CMR 等的进步极大地推动了临床对于CMV 病理生理过程、发病率以及药物治疗效果评估等研究的深入(表3)。
PET 技术通过采用静脉注射不同的放射性核素示踪剂(如:82铷、13氮、15氧和18氟),可连续监测血液循环及心肌中的放射活性,通过记录心肌摄取核素动态变化的左心室腔和心肌的时间-放射活性曲线,可准确计算出每克心肌每分钟单位体积的MBF[单位:ml/(min·g)],并计算CFR(表4)。最新数据证实在已知或可疑的CAD 患者中以CFR 减低为特征的冠状动脉血管功能障碍普遍存在[53-54];CFR减低(<2)还可以预测可诱发的心肌缺血/心肌损伤的严重程度;并筛选主要不良心血管事件(MACE,包括心原性猝死)发生高危患者[55-56]。
4.1.1.4 评价冠状动脉微血管功能的常用侵入性检查方法
常用的评价冠状动脉微血管功能的创伤性技术包括TIMI 血流计帧法、冠状动脉血流储备和微循环阻力指数测定等。
TFC:TFC 测量从冠状动脉起始部显影至标准化的远端标记显影所需的冠状动脉造影帧数,是半定量的冠状动脉灌注情况评价方法。在无明显心外膜冠状动脉阻塞的情况下,造影采集帧数若为30 帧/s,TFC > 25 提示存在微循环障碍[57]。
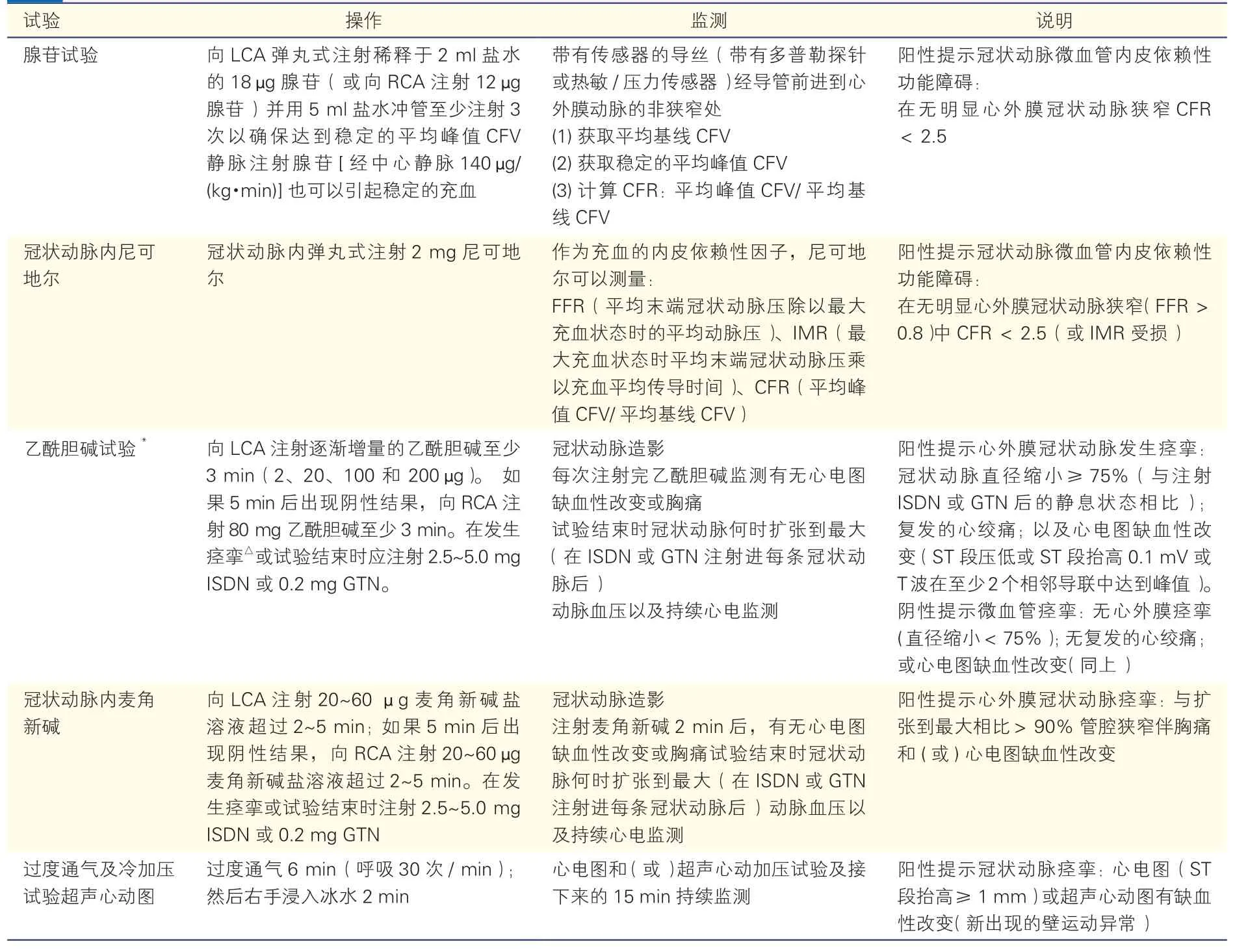
表2 评估冠状动脉微血管功能障碍的诊断性血管活性药物试验
CFR:CFR 是指药物诱导冠状动脉扩张的程度,定义为最大充血状态下冠状动脉循环血流量与静息状态下冠状动脉循环血流量的比值。冠状动脉循环血流量与传导时间成反比,可以通过多普勒导丝或压力导丝分别测得静息状态下的平均传导时间与充血状态下的平均传导时间,两者比值即为CFR 值。由于国内目前无冠状动脉内多普勒导丝应用,目前多通过压力导丝采用热稀释法测量CFR 值。CFR 反映心外膜血管及微循环的储备扩张能力且二者成正相关,当心外膜血管出现狭窄或微循环功能异常时,CFR 值降低。若CFR 值<2,推荐行冠状动脉微循环阻力指数测定评价是否存在冠状动脉微循环障碍。
IMR:静脉泵入三磷酸腺苷或腺苷达到冠状动脉最大充血态后,通过压力导丝可以测的冠状动脉远端压力(Pd),冠状动脉内注入生理盐水,依据温度稀释法,可测的充血态下的平均通过时间(the mean transit time,Tmn),即可计算得到IMR 值,IMR=Pd×Tmn。IMR 的正常值目前尚未完全统一,但IMR 值>25 时认为存在冠状动脉微循环功能障碍[58]。国内外研究证实,IMR 值升高与急性心肌梗死预后不良[59],心肌存活及左心室功能恢复不佳相关[60],而且可以预测冠状动脉介入围手术期心肌损伤[61-63]。
迄今尚无可以在人体内直接观察冠状动脉微循环的技术。对于MVD 患者来说,在诸多无创伤性诊断技术中基于PET 技术测算出的MBF 数据最具预后预测价值。其在无创定量测量心肌血流和CFR 方面的准确性已在实验动物和人类试验中得到了广泛验证;但受到经济、技术条件等多种因素的限制,在国内该技术尚未得到广泛应用。
推荐冠状动脉微循环功能评估可采用在结合患者接受多种血管活性药物的情况下,通过有创性技术进行评估,检测与冠状动脉微循环功能的完整性具有较高相关性的参数(如:FFR >0.8、CFR <2.0 且IMR ≥25)来明确CMVD 的诊断。
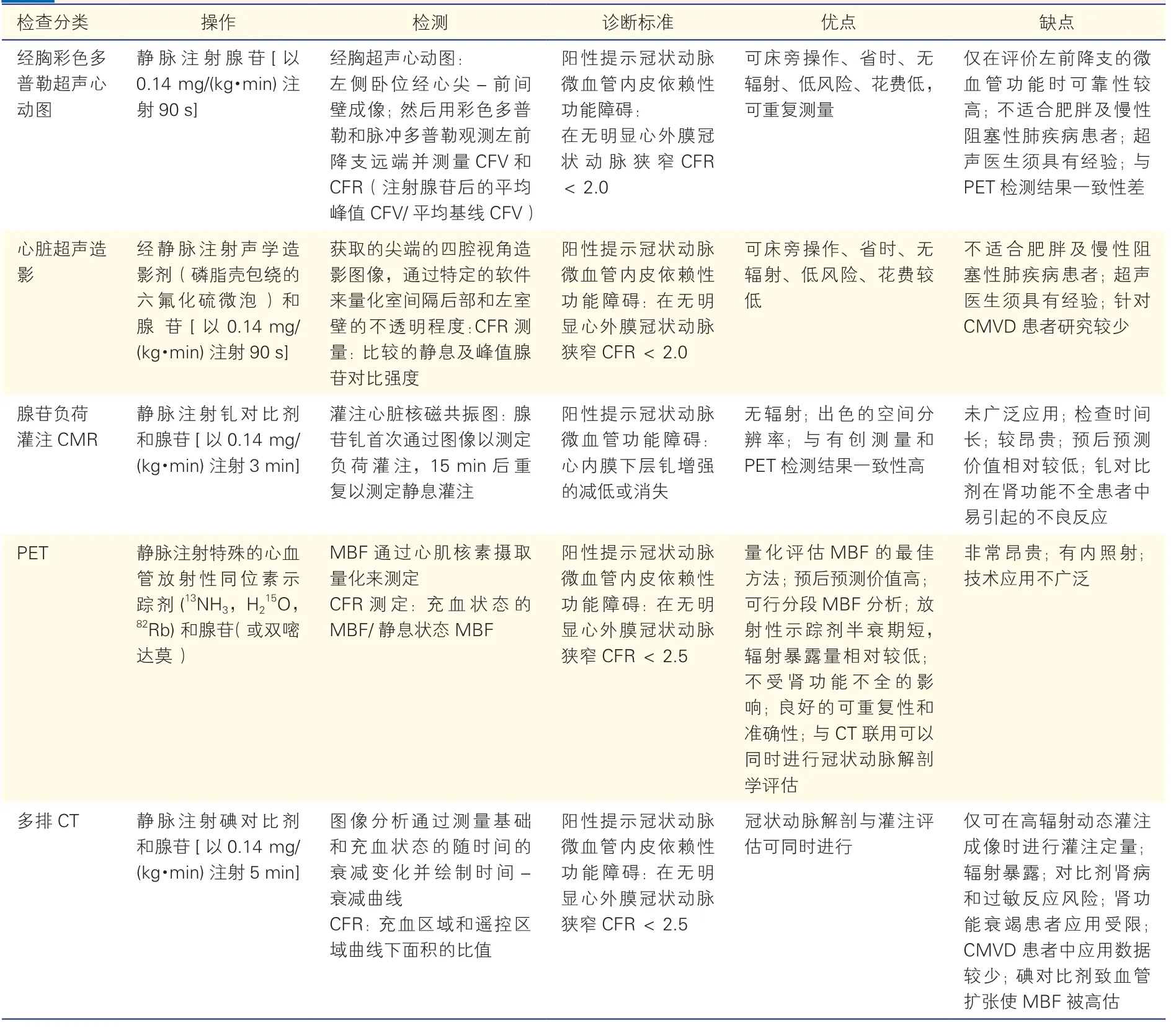
表3 评价冠状动脉微血管功能的无创性影像学技术

表4 放射性示踪剂的特点、PET 灌注成像的获取、MBF 量化及阈值
此外,在临床实践中合理的诊断流程也格外重要(详见4.1.2 部分)。
4.1.2 专家组建议CMVD 的诊断流程建议
可疑CMVD 患者的临床诊断流程见图2,再次强调对患者同时进行微血管病与大血管病评估的重要性。
建议心肌缺血的评估可始于无创的冠状动脉CT 血管造影或有创性的冠状动脉造影检查,即以冠状动脉解剖评估作为初始评估策略建议。当患者被证实合并有严重阻塞性CAD 时,可依据患者的症状负荷,血管造影显示的冠状动脉病变位置、性质、程度和严重性以及是否存在与该病变相关的心肌缺血(如可通过FFR 证实)考虑对患者进行相应的血运重建。而对于有症状的非阻塞性CAD 患者则应考虑合并CMVD 可能,并继而进行相关专项检查(如:血管活性药物试验,图2A)。
当然对有部分患者的心肌缺血的评估也可以始于联合了不同影像学检测的心脏负荷试验,即以冠状动脉功能评估作为初始评估策略。通常认为负荷试验阳性往往提示阻塞性CAD 存在,因此相关患者多被转诊接受冠状动脉造影以进行明确的解剖学诊断。如果明确存在阻塞性CAD,则可根据其症状负荷以及心肌缺血和血管造影显示的疾病严重程度,考虑对这些患者进行血运重建。但是当排除了阻塞性CAD,即负荷试验出现 “假阳性”结果时,为除外CMVD 应考虑通过无创或有创技术进一步评估这些患者的冠状动脉舒缩功能。此外如果常规负荷试验结果为阴性,但临床上仍高度怀疑CMVD,则可以将患者转诊进行冠状动脉血管舒缩反应性测试。如果检查结果为阳性,则应继续行冠状动脉造影以排除阻塞性CAD(图2B)。
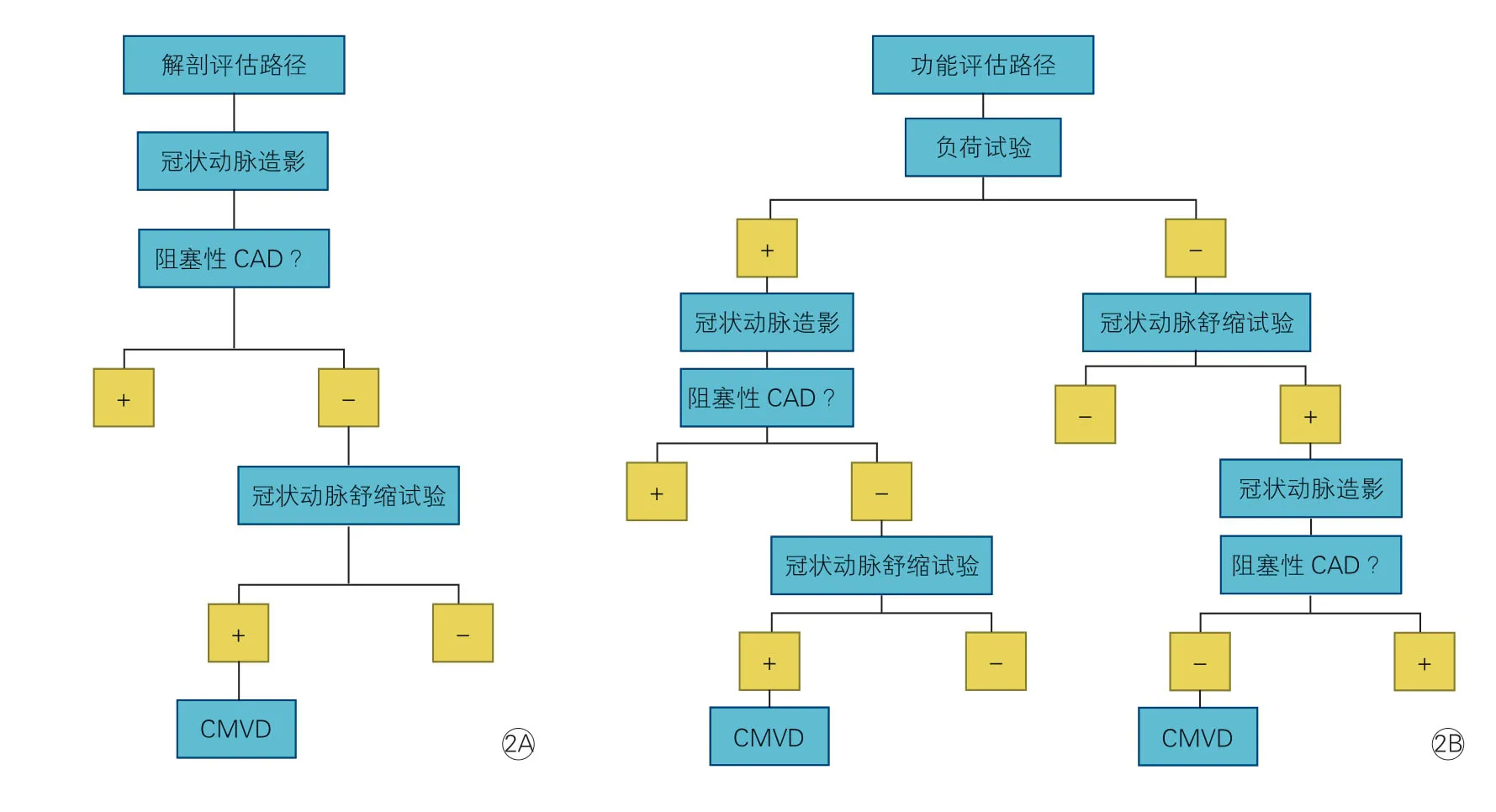
图2 临床冠状动脉微血管功能障碍患者的临床诊断流程
4.2 其他微血管疾病的诊断
4.2.1 CSVD 的诊断
CSVD 特征性的脑组织损伤,如:腔隙性脑梗死、白质高信号(white matter hyperintensities,WMH)、ICH以及CMB 等,可以通过不同的脑成像技术检出[24],其中MR 是检测CSVD 最重要的工具[64-65]。可用于CSVD 诊断的MR 影像学标志包括:(1)新发皮质下小梗死:为穿支动脉闭塞引起的腔隙性脑梗死,病灶直径在轴位上小于20 mm;(2)腔隙:为皮质下3~15 mm圆形或卵圆形病灶,其内容物信号在各序列与脑脊液相同;(3)脑白质高信号:病灶在T2 或T2-FLAIR序列呈高信号,在T1 序列呈等信号或低信号,病变范围大小不等。(4)血管周围间隙:为沿血管走行的间隙,随血管由脑表面穿入脑实质,间隙中液体信号与脑脊液相同,常见于基底节下部;(5)微出血:在磁敏感序列上呈现为直径2~5 mm 的圆形或卵圆形信号缺失灶,具有高光溢出效应。(6)脑萎缩:指脑体积减少,但与特定的、大体局灶性损伤无关。其他CSVD 影像学改变还包括脑微梗死、脑灌注和氧代谢率变化、血管壁强化等。
4.2.2 微血管疾病相关慢性肾脏病的诊断
原发性肾小球肾炎可以表现为单纯性血尿和/或蛋白尿、肾病综合征、肾炎综合征、高血压和肾功能损害。MVD 相关CKD 诊断主要依靠尿检、肾功能评估以及肾穿刺病理活检。
AAV 是一类可侵犯多个器官系统的自身免疫性疾病,病变累及微动脉、微静脉及毛细血管,约50%以上患者就诊时存在肾脏受累。临床可有多系统受损表现。ANCA 是AAV 诊断、检测病情活动和预测复发的重要指标,特异性和敏感性均较好。肾穿刺病理活检以寡免疫沉积,新月体形成为特征,毛细血管袢坏死多见。
TMA 是一组具有共同病理特征的急性临床病理综合征,主要表现为内皮细胞肿胀脱落、内皮下绒毛状物质沉积和血管腔内血小板聚集形成微血栓、血管腔内栓塞及红细胞碎裂等微血管系统异常。临床上主要表现为血小板减少、溶血性贫血和微循环中血小板血栓造成的器官受累,其临床表现与TMA 的病变范围和累及不同器官造成的功能障碍有关。当急性肾炎综合征或急进型肾炎综合征患者发生溶血和血小板减少者,需寻找机械性溶血的证据如外周血可见破碎红细胞,抗人球蛋白实验(Coombs 实验)阴性,条件许可应尽早行肾穿刺活检明确诊断、指导治疗并判断预后。系统性红斑狼疮的肾脏受累在成人的发生率可高达40%[66],LN可表现为血尿、蛋白尿、肾功能异常以及其他多系统受损表现,实验室检查可有多种自身抗体和补体异常,LN 的病理分型及活动性病变程度须依赖肾穿刺病理活检。
4.2.3 糖尿病相关微血管疾病的诊断
4.2.3.1 糖尿病肾脏疾病的诊断
专家组推荐应根据尿白蛋白/肌酐比值(urea albumin creatinine ratio,UACR)升高和(或)GFR 下降、同时排除其他CKD 而作出的临床诊断DKD;特别推荐采用随机尿测定UACR 反映尿白蛋白的量。随机尿UACR ≥30 mg/g 为尿白蛋白排泄增加,即白蛋白尿。在3~6 个月内重复检查UACR,3 次中有2 次尿白蛋白排泄增加,排除感染等其他因素即可诊断白蛋白尿。白蛋白尿对于预测DKD 进展存在一定局限性因此白蛋白尿作为诊断依据时,需进行综合判断,多次检测并结合GFR 长期随访,且需排除其他可引起白蛋白尿的病因。此外肾功能改变是DKD 的重要表现,反映肾功能的主要指标是GFR。DKD 诊断确定后,应根据GFR 进一步判断CKD 严重程度(分期标准同CKD),推荐使用CKD-EPI 公式或MDRD 公式计算估算GFR(eGFR)。当患者eGFR<60 ml/(min·1.73 m2)时,可诊断为eGFR 下降。合并DR 有助于DKD 的诊断。
4.2.3.2 糖尿病视网膜病变的诊断
DR 分级标准(表5)须由眼科医师散瞳做眼底检查明确诊断。在没有条件全面开展由眼科医师进行眼部筛查的情况下,由内分泌科经培训的技术人员使用免散瞳眼底照相机进行分级诊断,或借助人工智能设备是可行的DR 初步筛查方法。

表5 糖尿病视网膜病变分级
4.2.3.3 糖尿病周围神经病变的诊断
DPN 是指在排除其他原因的情况下,糖尿病患者出现周围神经功能障碍相关的症状或体征,其中最常见及代表性的是DSPN。
DSPN 诊断标准包括:(1)明确的糖尿病病史;(2)诊断糖尿病时或之后出现的神经病变;(3)临床症状和体征与DSPN 的表现相符;(4)有临床症状(疼痛、麻木、感觉异常等)者,5 项检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)中任一项异常;无临床症状者,5 项检查中任2 项异常,临床诊断为DPN;(5)排除其他病因引起的神经病变。如根据以上检查仍不能确诊,需要进行鉴别诊断,可以做神经肌电图检查。DSPN 的诊断流程图见图3。
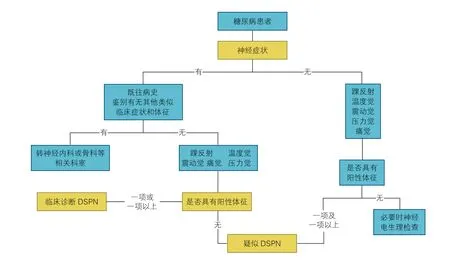
图3 糖尿病远端对称性多发性神经病变的诊断流程
4.2.4 肥胖症的诊断
一般以体重指数(BMI)≥28.0 kg/m2诊断肥胖症,也可以腰围诊断中心型肥胖,男性≥90 cm,女性≥85 cm。中心型肥胖较为精确的诊断方法为采用CT 或MRI,选取第4 腰椎与第5 腰椎间层面图像,测量内脏脂肪面积含量,中国人群面积≥80 cm2定义为中心型肥胖。肥胖症诊断确定后需结合病史、体征及实验室检查等排除继发性肥胖症,如:皮质醇增多症、甲状腺功能减退、下丘脑或垂体疾病以及性腺功能减退等。
5 微血管疾病的治疗
迄今为止,MVD 的病理生理过程涉及多个因素,临床表型也经常与多种疾患重叠并存(图4)。MVD在某些患者中可能是原发性异常,而在另一些患者中则是继发性病理特征。迄今尚无专门针对MVD/CMD 设计的临床试验,而且由于缺乏标准化的诊断,设计不足,样本量小,临床改善的证据不足等原因,可供患者选择治疗方法或药物也非常有限。
虽然不同的MVD 表现不同,靶器官各异,但延缓MVD 进展的总体治疗思路应涵盖以下几个方面:(1)积极控制相关危险因素(如高血压、血脂异常、高血糖、肥胖)。(2)抑制代谢紊乱所诱导的血管功能障碍发生的主要机制(如微血管内皮功能障碍、微血栓形成)。(3)中和促进病变发生的不利因素,如炎症因子和氧化应激。(4)激活组织特异性保护因子等。最终实现保护靶器官、改善患者生活质量、预防大血管相关MACE并降低患者死亡率。
5.1 控制与微血管疾病发生及进展密切相关的诸多心血管病危险因素是防控、治疗MVD 的基石。
MVD 患者应戒烟,避免被动吸烟,必要时可借助药物戒断。高血压患者首选血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)治疗改善微血管功能。在高脂血症以及炎性活性和氧化应激水平增加的患者,他汀类药物治疗可改善血管内皮功能和心肌缺血症状[67]。口服降糖药或应用胰岛素控制血糖可改善微血管内皮功能。肥胖患者还可通过减轻体重有效改善微血管功能[68]。
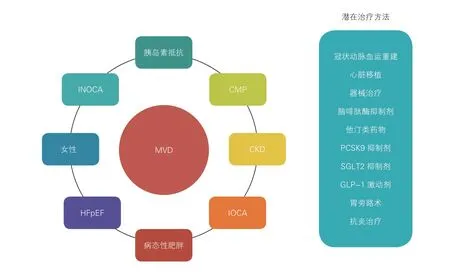
图4 微血管疾病的异质性及其潜在治疗方法
5.2 微血管疾病的药物治疗
5.2.1 抗心肌缺血的经典药物
β 受体阻滞剂和短效硝酸酯类是控制CMVD症状的一线药物[69]。若不能耐受β 受体阻滞剂可应用伊伐布雷定替代[70]。在症状控制不充分的情况下,在应用β 受体阻滞剂的基础上加用钙拮抗剂和(或)长效硝酸酯类药物有助于进一步控制患者的症状[69]。钙拮抗剂对以微血管痉挛为主的心绞痛疗效好,但增加CBF 的效果较差。硝酸酯类药物对合并存在心外膜下冠状动脉狭窄和痉挛的患者效果好,但对单纯的CMVD 患者疗效差。RAAS 抑制剂(包括ACEI/ARB)也可以通过阻断血管紧张素Ⅱ的血管收缩作用进而改善冠状动脉微血管功能[69]。合并心外膜冠状动脉阻塞的CMVD 患者接受冠状动脉血运重建治疗是合理的,并可能改善合并有CMVD 患者的临床症状及预后[69,71]。
5.2.2 其他抗心肌缺血药物
已有多种非经典的抗心绞痛药物被应用于CMVD 患者,包括:尼可地尔、伊伐布雷定、曲美他嗪、雷诺拉嗪和米贝拉地尔等[72-74]。尼可地尔是被研究最多的药物之一,有研究显示尼可地尔治疗可有效改善运动诱导的心肌缺血,而不改变心脏自主神经活动,提示尼可地尔可能存在对微血管性心绞痛患者的冠状动脉微血管具有直接的血管舒张作用[75-77]。
鉴于尼可地尔在治疗心脏微血管病变导致的冠状动脉微血管性心绞痛方面具有一定的优势。专家组建议对于合并微血管性心绞痛或高危人群,尼可地尔亦可作为一线用药。
5.2.3 其他药物
外源性辅酶Ⅰ(NAD+)可特异提升Sirtuins 去乙酰化活性,抑制内皮细胞炎症损伤、氧化应激损伤,改善线粒体功能和细胞代谢功能,减少微血管内皮细胞凋亡和促进微血管生成,改善冠状动脉微循环[78],并能显著减轻心肌缺血再灌注引起的微血管损伤[79]。
能量代谢作为改善冠状动脉微循环的新方向,具有良好的临床转化潜力,未来的研究应更多地去开发新的靶向药物,通过改善能量代谢恢复冠状动脉微循环稳态[80-81]。
其他药物如:脑啡肽酶抑制剂、前蛋白转化酶枯草杆溶菌素(PCSK)9 抑制剂、胰高血糖素样肽-1(GLP-1)受体激动剂和钠-葡萄糖共转运蛋白2(SGLT2)抑制剂等对于CMVD 患者的疗效则仍有待进一步证实。
5.3 其他微血管疾病的治疗
5.3.1 脑微血管疾病的特异治疗
专家组指出,CSVD 的预防和治疗与其他病因脑血管病的原则相同,包括控制危险因素、静脉溶栓、抗血小板药物、抗凝治疗和他汀类调脂药物等。高血压是小动脉硬化最重要的危险因素,研究发现,严格控制血压可以减缓脑白质高信号进展[82],减少出血性脑卒中发生率[83]。除了降压达标以外,建议选用减少血压变异性的药物,如长效钙拮抗剂和RAAS 抑制剂。
由于CSVD 具有易患脑梗死和脑出血的双向性,在进行抗栓治疗前,应仔细评估脑出血风险。严重脑白质高信号和微出血是溶栓后出血转化的独立危险因素,但尚未被列为溶栓治疗禁忌证。对于脑出血高风险患者,如血压控制不好、血压变异性大、严重脑白质病变及脑微出血数量多,应慎用抗血小板药物。CAA 患者脑出血复发率高,应尽量避免使用抗血小板药物和抗凝治疗。
5.3.2 微血管疾病相关慢性肾脏病的特异性治疗
原发性肾小球肾炎治疗应立足于控制血压和降低尿蛋白并延缓肾功能进展。足量应用ACEI/ARB[84]、限盐利尿[85]及适时合理使用醛固酮抑制剂[86]可使多数患者血压和尿蛋白达标。经上述治疗方案,蛋白尿仍未达标者,根据病理类型,经谨慎权衡利弊后,可加用激素和(或)免疫抑制剂治疗。AAV 的治疗分为诱导治疗和维持缓解,治疗措施包括传统的激素、免疫抑制剂、血浆置换和新型生物制剂等。继发感染是AAV 死亡的独立预测因素[87],故针对高危患者治疗需谨慎权衡利弊。TMA 的首选治疗方法为血浆疗法。LN 则须加用羟氯喹或类似抗疟药物,根据肾活检病理分型和组织学活动度给与相应强度的免疫抑制治疗。
5.3.3 糖尿病微血管疾病的特异性治疗
良好的血糖控制可降低DKD、DR 和DPN 的发生风险并延缓其进展。良好的血压控制可降低DKD 和DR 的发生风险,并延缓DKD 的进展[5-6]。对于DR 和DPN,除控制血糖外,并无其他证据充分的可延缓疾病进展的有效手段,因此预防微血管并发症显得尤为重要[50]。糖尿病的主要微血管病变(包括DKD、DR、DPN)治疗措施的推荐意见见表6。
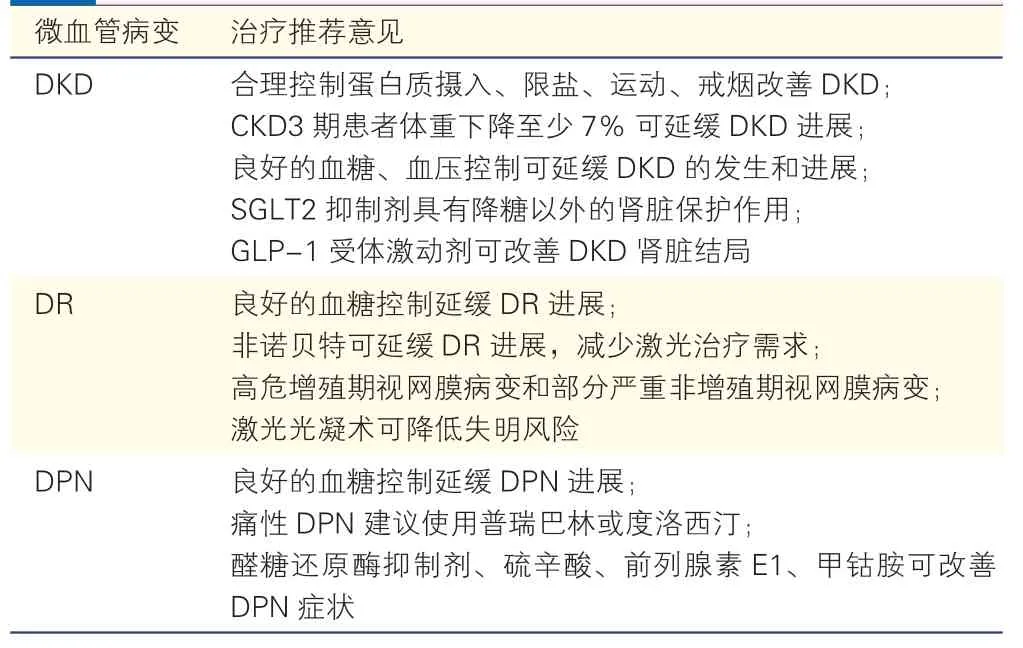
表6 糖尿病主要微血管病变治疗推荐意见
5.4.1 肥胖症的特异性治疗
肥胖症治疗主要包括减轻和维持体重的措施和对伴发疾病及并发症的治疗。改善体重的具体治疗措施包括医学营养治疗、体力活动、认知行为干预、药物治疗以及手术治疗[88-89]。当BMI ≥24 kg/m2且合并2 型糖尿病、血脂异常、高血压、脂肪肝、呼吸暂停低通气综合征及关节疼痛等,或单纯BMI ≥28 kg/m2,不论是否有并发症,经过 3 个月的单纯饮食方式改善和增加活动量处理仍不能减重5%者,可考虑加用减重药物。目前,美国FDA 批准的治疗肥胖症药物主要有:环丙甲羟二羟吗啡酮(纳曲酮)/安非他酮、氯卡色林、芬特明/托吡酯、奥利司他和利拉鲁肽等。但目前在我国,有肥胖症治疗适应证且获得国家药品监督管理局批准的药物只有奥利司他(推荐剂量为120 mg tid)。经上述生活和行为方式治疗及药物治疗未能控制的严重肥胖患者,可考虑代谢手术治疗[88]。
5.5 中药治疗
动物实验和体外研究表明黄芪[90]、三七[91]、当归[92]等植物药及参附注射液[93]、参松养心胶囊[94]、通心络[95]、银杏叶提取物[96]等中成药/制剂可通过改善微血管内皮功能、促进舒血管物质释放等机制改善微循环。国内小规模临床研究表明通心络可显著减少ST 段抬高型心肌梗死患者经皮冠状动脉介入治疗术中无复流的发生率和术后6 个月心肌梗死面积[97];而丹参和银杏提取物则对糖尿病微血管病变具有一定的治疗作用[98-99]。
共识执笔者:陈浩(北京医院),龚涛(北京医院),王晓霞(北京医院),孙颖(北京医院)
共识专家组成员(以姓氏笔画为序):于青(上海市第一人民医院),王晓霞(北京医院),艾虎(北京医院),史冬梅(首都医科大学附属北京安贞医院),丛洪良(天津市胸科医院),乔树宾(中国医学科学院阜外医院),伍贵富(中山大学附属第一医院),刘梅林(北京大学第一医院),刘斌(吉林大学第二医院),孙志军(中国医科大学附属盛京医院),孙爱军(复旦大学附属中山医院),孙颖(北京医院),李为民(四川大学华西医院),李伟(北京医院),李国庆(新疆维吾尔自治区人民医院),李建平(北京大学第一医院),杨进刚(中国医学科学院阜外医院),杨杰孚(北京医院),杨跃进(中国医学科学院阜外医院),吴元(中国医学科学院阜外医院),吴强(贵州省人民医院),邱蕾(北京医院),汪芳(北京医院),沈珠军(北京协和医院),张钲(兰州大学第一医院),张萍(清华大学附属北京清华长庚医院),陈玉辉(北京医院),陈纪言(广东省人民医院),陈茂(四川大学华西医院),陈浩(北京医院),陈章炜(复旦大学附属中山医院),苑海涛(山东省立医院),郑金刚(中日友好医院),姚朱华(天津市人民医院),贾绍宾(宁夏医科大学总医院),宾建平(南方医科大学南方医院),黄超联(中国中医科学院望京医院),龚涛(北京医院),董吁钢(中山大学附属第一医院),程标(四川省人民医院)
利益冲突:所有作者均声明不存在利益冲突
